ВВЕДЕНИЕ
Преимплантационное генетическое тестирование (ПГТ) прочно заняло свое место среди ранних профилактических мероприятий, предупреждающих рождение больного ребенка. Применение новых технологий открывает широкие возможности для обнаружения генетических нарушений. Однако при внедрении новых диагностических методов возникли проблемы, связанные с возможностью получения различных результатов при исследовании разных клеток одного и того же эмбриона.
Известно, что у новорожденных в среднем около 10% всех генетических нарушений развития связаны с трисомиями и моносомиями по различным хромосомам, а с увеличением возраста матери эта цифра возрастает до 50%[1]. До недавнего времени было принято считать, что численные хромосомные аномалии возникают главным образом в результате аномальной сегрегации хромосом в мейозе, преимущественно в оогенезе[2].
На первых этапах развития ВРТ на основе ЭКО главным критерием оценки качества эмбрионов для переноса в полость матки была их морфология. Накопленный опыт ВРТ показал, что, к сожалению, морфологические характеристики эмбрионов не могут отражать их генетический статус[3]. В связи с этим требовались новые подходы к профилактике рождения больного ребенка в рамках ВРТ.
Необходимость повышения эффективности программ ВРТ способствовала развитию методов ПГТ, которые сейчас входят в комплекс исследований, объединяющих различные технологические подходы для проведения ПГТ на наличие анеуплоидий (ПГТ-А), анализа на моногенные заболевания и структурные перестройки[4]. Уже с 1990-х годов исследователи рекомендуют для повышения результативности всей процедуры проводить селекцию и перенос эуплоидных эмбрионов в рамках программы ЭКО.
В настоящее время ПГТ-А — наиболее часто применяемая технология, направленная на увеличение эффективности лечения бесплодия с помощью ВРТ. Это связано с тем, что численные хромосомные аномалии служат причиной остановки развития эмбрионов, приводят к спонтанным абортам и рождению детей с пороками развития. Показано, что на ранних стадиях развития у человека до 80% нарушений вызваны хромосомными аномалиями[5].
За более чем 20-летний период исследований накопилось множество данных, подтверждающих высокий уровень анеуплоидий у ранних эмбрионов человека, причем оказалось, что, помимо нарушений сегрегации хромосом во время мейоза, численные хромосомные аномалии могут быть следствием нарушения расхождения хромосом в ходе первых делений дробления эмбриона, которые приводят к возникновению в составе одного эмбриона клонов клеток с различным хромосомным набором[6]. Это явление получило название эмбрионального мозаицизма. Очевидно, что мозаицизм может искажать результаты ПГТ-А.
Для повышения эффективности процедур ВРТ в целом необходимы дополнительные исследования природы мозаицизма и его значимости для разных стадий эмбрионального и пренатального развития человека. Оценивая мозаицизм доимплантационных эмбрионов на стадии бластоцисты, следует помнить, что уровень мозаицизма в клетках трофэктодермы (ТЭ) не обязательно тождественен уровню мозаицизма в клетках внутренней клеточной массы (ВКМ). Опубликованных данных, позволяющих сравнить уровни мозаицизма клеток ТЭ и клеток ВКМ, немного, и они противоречивы.
Гораздо больше достоверной информации о мозаицизме получено на основе результатов пренатальной диагностики. Показано, что около 1% всех прогрессирующих беременностей первого триместра имеют в хорионе мозаицизм, но при этом не более 10% плодов с мозаичным хорионом являются мозаиками, то есть присутствие аномального клеточного клона в тканях плода при его наличии в хорионе (истинный, или генерализованный, мозаицизм) составляет около 0,1% от всех случаев развивающихся беременностей[7].
Воздействие плацентарного (истинного и псевдо-) мозаицизма на пренатальное и постнатальное развитие имеет широкий диапазон — от отсутствия эффекта (недетектируемое влияние) до гибели плода на разных сроках беременности или рождения ребенка с генетическими нарушениями.
Влияние мозаицизма на развитие человека зависит от его типа, хромосомы или хромосомных участков (размера), вовлеченных в мозаицизм, типа патологии (моносомия, трисомия, мозаичная форма структурной хромосомной аномалии), локализации гетероплоидных клеток, уровня мозаицизма (%). Предположительно, аналогичное влияние мозаицизма должно наблюдаться и у доимплантационных эмбрионов. Так, локализация летальных геномных изменений в ВКМ (истинный мозаицизм) может привести к нарушению формирования эмбриональных структур и к гибели эмбриона, а локализация их в ТЭ — к нарушению имплантации или, в дальнейшем, к нарушению формирования хориона. Влияние сублетальных геномных аберраций будет менее выражено, но может вызывать гибель эмбриона на постимплантационных стадиях развития или рождение ребенка с врожденной генетической патологией.
Феномен мозаицизма доимплантационных эмбрионов человека, выявляемый почти в каждом цикле ЭКО с ПГТ-А, ставит перед специалистами неизбежный вопрос о том, насколько точно определены наличие и уровень мозаицизма. Многочисленные опубликованные данные показывают, что детектируемый уровень мозаицизма у доимплантационных эмбрионов меняется в зависимости от стадии дробления и от используемого метода исследования.
Первоначально используемый метод флуоресцентной гибридизации in situ (FISH) позволял определить мозаицизм лишь по половым хромосомам и 10 аутосомам у эмбрионов третьего дня развития и только в случаях биопсии двух и более бластомеров. Таким образом, нельзя было получить информацию о мозаицизме неисследованных хромосом и определить истинный уровень (%) мозаицизма по исследованным хромосомам.
Начиная с 2012 года благодаря использованию метода микроматричного анализа (array CGH) появилась возможность одновременного исследования всех хромосом набора в нескольких клетках ТЭ. Однако этот метод позволяет выявлять мозаицизм, если доля анеуплоидных клеток в образце ТЭ более 40%, следовательно, достоверно определить наличие мозаицизма и его уровень с помощью этого методического подхода не всегда возможно[8, 9].
Развитие методов Next Generation Sequencing (NGS) в сочетании с современными технологиями полногеномной амплификации ДНК из единичных клеток позволило начать их внедрение в практику ПГТ. Благодаря высокой чувствительности метод на основе высокопроизводительного секвенирования позволяет уверенно выявлять мозаицизм в образце ДНК из ТЭ с точностью до 20% (одна клетка с анеуплоидией из пяти).
Цель исследования: выполнить исследование клеток ТЭ из разных областей эмбриона методом NGS на платформе Illumina и сравнить данные для выявления степени дискордантности разных образцов одного эмбриона.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследования использованы эмбрионы человека на ранних этапах развития, полученные в результате искусственного оплодотворения гамет здоровых доноров в рамках программы ЭКО. Обязательным условием проведения исследования стало наличие индивидуального добровольного согласия доноров на основе этических принципов исследований в соответствии с Хельсинкской декларацией в редакции 2013 года.
Отбор доноров гамет соответствовал требованиям, перечисленным в Приказе Минздрава РФ № 107н от 30 августа 2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению», с некоторыми дополнительными условиями, определенными на основе нашего опыта работы[10]. Все доноры прошли обязательное кариотипирование и генетическое консультирование до вступления в программу донации в АО «МЦРМ». Оплодотворение проводили в лабораторных условиях по опубликованному ранее протоколу[4].
Для исследования были выбраны 14 эмбрионов человека, полученных в результате оплодотворения ооцитов от 10 доноров в возрасте от 20 до 32 лет донорской спермой 9 доноров из банка спермы АО «МЦРМ». Через 16–18 часов после оплодотворения производили визуальную качественную оценку пронуклеусов и полярных телец, после чего эмбрионы культивировали 5–6 дней на средах COOK до формирования бластоцист.
Морфологическую оценку бластоцист осуществляли, согласно классификации Гарднера[11, 12]. У бластоцист отличного и хорошего качества выполнены биопсия клеток ТЭ с использованием лазера и последующая их криоконсервация методом витрификации на средах Kitazato. Полногеномную амплификацию проводили набором PicoPLEX WGA Kit (Rubicon Genomics), количественную оценку ДНК (WGA продукта) — с помощью флюориметра Quantus™ Fluorometer (Promega) и набора реактивов QuantiFluor® dsDNA System, приготовление библиотек — набором VeriSeq PGS kit (Illumina). Качество геномных библиотек оценивали на приборе TapeStation 4200 (Agilent). Секвенирование (NGS) выполняли на аппарате Illumina MiSeq, анализ на численные хромосомные аномалии — с применением программного обеспечения BluеFuse Multi v4.3 (Illumina). Эффективное разрешение метода — 20 м. п. н.
Секвенирование выполнено на базе сектора клинико-генетических исследований СПб ГБУЗ «Городская больница № 40».
По результатам ПГТ-А у всех исследованных бластоцист установлено наличие анеуплоидии по одной из хромосом. После получения заключения клинического генетика анеуплоидные эмбрионы (непригодные для переноса и развития здорового плода) были разморожены и культивировались до 6 суток развития. Два эмбриона деградировали в процессе разморозки. У 12 эмбрионов произведена повторная биопсия клеток ТЭ в двух независимых участках: одна биопсия ТЭ, прилежащей к клеткам ВКМ, и вторая биопсия ТЭ с противоположного от эмбриобласта полюса бластоцисты.
Последующее тестирование образцов проводили на базе ЦГИ «Хайтек Генетикс». Полногеномную амплификацию выполняли, как описано выше. Приготовление библиотек осуществляли набором VeriSeq PGS, секвенирование объединенной библиотеки — на приборе MiSeq компании Illumina, анализ на численные хромосомные аномалии — с использованием программного обеспечения BluеFuse Multi v4.5.
РЕЗУЛЬТАТЫ
Интересен факт, что оба эмбриона, оказавшиеся нежизнеспособными после криоконсервации, имели моносомии разных хромосом. У 12 эмбрионов, подвергшихся дальнейшему исследованию (24 образца), получены результаты секвенирования, отвечающие всем необходимым требованиям для выдачи результата анализа (табл.).
Таблица
Результаты секвенирования исследуемых образцов
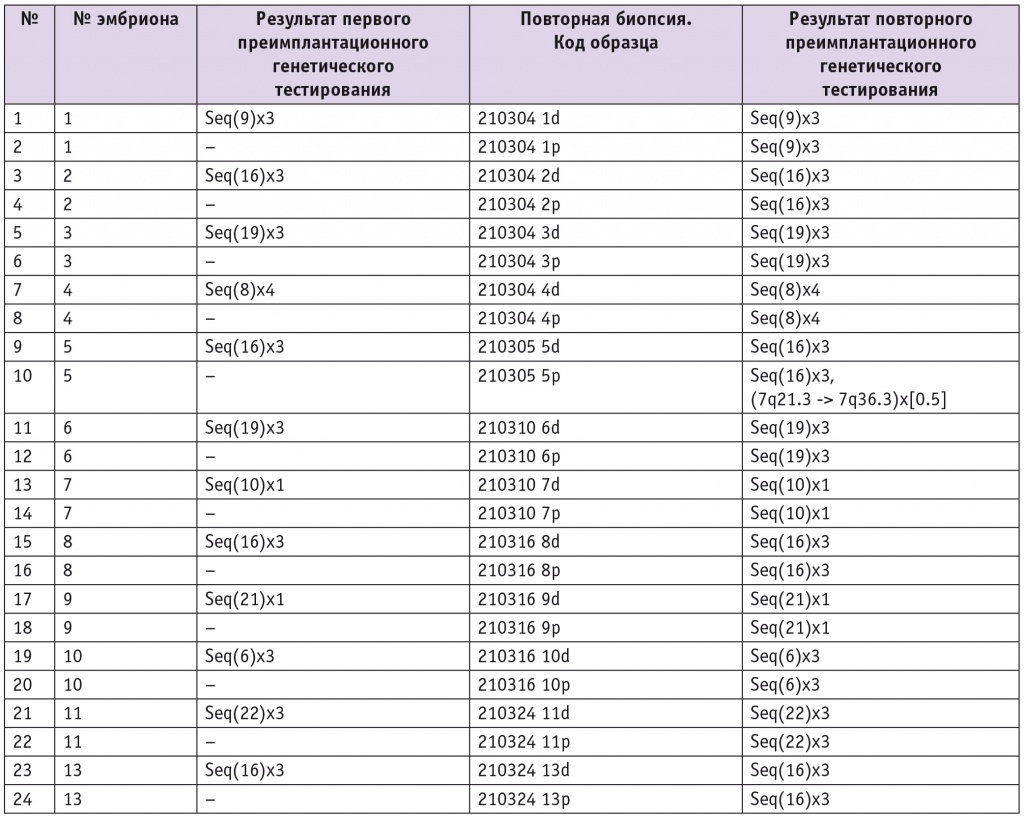
Девять из 12 повторно успешно проанализированных эмбрионов имели трисомии по различным хромосомам. Два эмбриона имели моносомии хромосом 10 и 21 (рис. 1 А–С). У одного эмбриона выявлена тетрасомия хромосомы 8 и при первичном, и при вторичном исследовании (рис. 1 D–F). В одном образце, где первично была установлена трисомия хромосомы 16, при повторной диагностике найдена дополнительно делеция района длинного плеча хромосомы 7 в мозаичной форме, не обнаруженная в других участках ТЭ этого эмбриона (рис. 2).
Рис. 1. Примеры анализов результатов секвенирования клеток ТЭ методом NGS на платформе Illumina в программе BlueFluse Multi. A — профиль секвенирования образца ТЭ при первичном исследовании эмбриона № 7. Результат анализа: Seq(10)x1,(X)x2. B — профиль секвенирования образца участка рядом с ВКМ эмбриона № 7 при повторном исследовании. Результат анализа: Seq(10)x1,(X)x2. C — профиль секвенирования образца участка противоположной стороны от ВКМ при повторном исследовании эмбриона № 7. Результат анализа: Seq(10)x1,(X)x2. D — профиль секвенирования образца ТЭ при первичном исследовании эмбриона № 4. Результат анализа: Seq(8)x4,(XY)x1. E — профиль секвенирования образца участка рядом с ВКМ при повторном исследовании эмбриона № 4. Результат анализа: Seq(8)x4,(XY)x1. F — профиль секвенирования образца участка противоположной стороны от ВКМ при повторном исследовании эмбриона № 4. Результат анализа: Seq(8)x4,(XY)x1.
Примечание. Здесь и в рисунке 2: ВКМ — внутренняя клеточная масса, ТЭ — трофэктодерма, NGS — Next Generation Sequencing
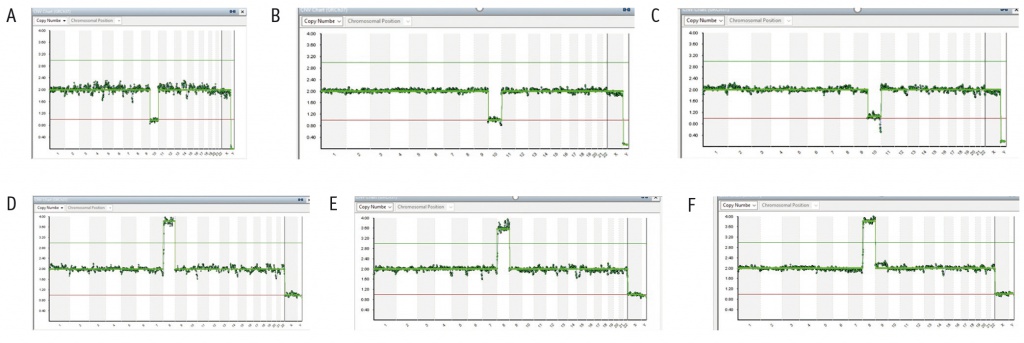
Рис. 2. Анализ результатов секвенирования клеток ТЭ методом NGS на платформе Illumina в программе BlueFluse Multi. A — профиль секвенирования образца при первичном исследовании эмбриона № 5. Результат анализа: Seq(16)x3,(XY)x1. B — профиль секвенирования образца участка рядом с ВКМ при повторном исследовании эмбриона № 5. Результат анализа: Seq(16)x3,(7q21.3 -> 7q36.3)x[0.5]. C — профиль секвенирования образца участка противоположной стороны от ВКМ при повторном исследовании эмбриона № 5. Результат анализа: Seq(16)x3,(XY)x1
ОБСУЖДЕНИЕ
Профилактика генетических заболеваний, отношение к здоровью населения служат одними из основных показателей развития современного общества, его социальной политики. Во всем мире ранней профилактике рождения больных детей уделяется особое внимание. Это связано с тем, что репродуктивное поведение человека сильно изменилось за последние годы и женщины стали рожать в позднем репродуктивном возрасте, что повышает риск рождения ребенка с генетическими отклонениями. Применяя новые технологии в профилактике, врачи должны быть уверены в точности проводимых мероприятий, особенно в рамках программ ЭКО, цель которых — рождение здоровых детей.
Однако на сегодняшний день не существует ни одного метода профилактической диагностики, который давал бы стопроцентную гарантию рождения здорового младенца. Это может быть связано с возможностями и ограничениями применяемого метода, а также с особенностью исследуемого материала. В современном мире чувствительность и специфичность технологий можно повышать, а повлиять на биологию раннего развития организма пока не представляется возможным. Проведенное исследование демонстрирует высокую точность метода, однако не может точно указывать на наличие или отсутствие мозаицизма в эмбрионе.
Для точного понимания причин возникновения мозаицизма, его уровня и исключения влияния на его возникновение нарушений репродуктивной функции необходимо детально исследовать показатели выявляемого мозаицизма эмбрионов, полученных в программах ВРТ. Анализ уровня мозаицизма у доимплантационных донорских бластоцист на основе данных ПГТ-А методом NGS, выполненный в девяти различных центрах ВРТ, показал, что он может колебаться от 17% до 47%[13]. Это является серьезным вызовом для специалистов, работающих в области ПГТ, и приводит к появлению сомнений в целесообразности таких исследований.
В основе указанных публикаций лежит утверждение о том, что на стадии бластоцисты наличие высокого уровня хромосомного мозаицизма может быть нормальным явлением и клетки ТЭ в разных частях эмбриона с высокой частотой (если не всегда) будут иметь различия в наборе хромосом[14]. В то же время на результаты выполненного анализа могли оказать влияние различные факторы, включая деградацию ДНК под влиянием «человеческого фактора», а верификация данных в независимой лаборатории не была включена в протокол исследования.
Теоретические оценки указывают на то, что с учетом числа клеток в биоптате доля выявляемого мозаицизма не должна достигать таких высоких показателей. Эти данные также не соответствовали результатам исследований молекулярного кариотипа клеток из разных участков эмбрионов, выполненных при повторных биопсиях одних и тех же эмбрионов[15].
Анализ результатов молекулярного кариотипа различных участков эмбрионов с выявленным ранее мозаицизмом, по данным проведенного ПГТ-А, показал некоторые отличия в клетках из различных участков ТЭ и ТЭ с ВКМ[16]. Однако в этих исследованиях не выявлены значимые различия в молекулярном кариотипе исследованных образцов, что свидетельствует о существовании определенных биологических закономерностей. В то же время до сих пор до конца не изучен механизм возникновения мозаицизма, а также характер его влияния на дальнейшее развитие эмбриона человека. Вышесказанное указывает на необходимость проведения дальнейшего исследования доимплантационных эмбрионов современными генетическими методами с участием независимых лабораторий для повышения уровня достоверности результатов.
Наше сравнительное исследование молекулярного кариотипа клеток ТЭ, полученных из разных участков 12 эмбрионов, 36 образцов (по 3 от каждого), показало частичное расхождение только в одном наблюдении. При первичном исследовании у эмбриона молекулярный кариотип был представлен трисомией хромосомы 16: Seq(16)x3,(XY)x1. При вторичном выявлена дополнительно делеция в виде мозаицизма участка хромосомы 7 в клетках, прилежащих к ВКМ эмбриона: Seq(16)x3,(7q21.3 -> 7q36.3)x[0.5]). Все остальные результаты показали полную конкордантность вне зависимости от исследуемого участка ТЭ, а также лаборатории, в которой проведено исследование.
ЗАКЛЮЧЕНИЕ
Можно сделать вывод, что преимплантационное генетическое тестирование на анеуплоидии эмбрионов 5-го дня развития на основе методов высокопроизводительного полногеномного секвенирования на платформе Illumina позволяет получить надежные данные о хромосомных аномалиях и может быть успешно применено для выявления анеуплоидий у доимплантационных эмбрионов. Но необходимо изучать процессы доимплантационного развития эмбрионов, приводящие к появлению мозаицизма, и учитывать их при разработке новых методов повышения точности профилактических мероприятий.
Благодарности. Авторы выражают благодарность президенту Российской ассоциации репродукции человека, проф., д. м. н. Владиславу Станиславовичу Корсаку за активную поддержку развития самых передовых методов преимплантационных генетических исследований в России. Мы также благодарны к. б. н. Олегу Сергеевичу Глотову и Ирине Васильевне Поляковой за предоставление первичных данных преимплантационного генетического тестирования на анеуплоидии, выполненного на базе сектора клинико-генетических исследований СПб ГБУЗ «Городская больница № 40» для проведения сравнительного анализа с результатами исследований материала повторно выполненных биопсий.
Авторы статьи благодарят компанию «Альбиоген» и ее генерального директора Фролова Александра Сергеевича за предоставленные наборы VeriSeq PGS компании Illumina для выполнения данной работы.
Поступила: 20.01.2022
Принята к публикации: 02.02.2022








