ВВЕДЕНИЕ
Актуальность проблемы прогнозирования и профилактики неблагоприятных перинатальных исходов в Дагестане неразрывно связана с ухудшением за последние десятилетия соматического здоровья матерей, возрастанием частоты осложненного течения беременности и нарушений антенатального развития плода[1]. Расширение представлений о генезе анемии беременных позволяет более детально обсуждать возможности сокращения ее встречаемости в Республике Дагестан на фоне региональных особенностей питания, высокого паритета, короткого интергенетического интервала.
Снижение частоты гестационных осложнений и сохранение здоровья новорожденных достигаются посредством уточнения последствий влияния анемии на организм матери и плода в зависимости от ее генеза, сроков и объема оказываемой медицинской помощи.
Дефицит железа (ДЖ) является наиболее распространенным гипомикроэлементозом в мире и значимой причиной анемии [2].
Согласно мировым данным, анемия встречается у 40–50% женщин репродуктивного возраста [3], ее частота среди беременных составляет от 5,4% в экономически развитых странах до более чем 80% — в развивающихся [4]. В России около трети женщин фертильного возраста страдает железодефицитной анемией (ЖДА), латентный ДЖ как предстадию анемии наблюдают почти у половины всего населения [5].
Развитие анемии связывают с влиянием социально-экономических факторов (дефицита питания, образа жизни и поведенческих реакций), гиповитаминоза (по витаминам A, B12 и фолиевой кислоте) и хронической кровопотери на фоне инфекций [6]. Большинство беременных страдает заболеванием до зачатия [7]. В период беременности для развития эмбриона и плацентации требуется 300–350 мг железа, для роста количества эритроцитов у матери — 500 мг, для компенсации кровопотери при деторождении — 250 мг [5, 8].
Ионное железо — минерал, который обеспечивает окислительно-восстановительные реакции, антиоксидантную защиту, функционирование нервной и иммунной систем [9].
Актуальность совершенствования лечения анемии обусловлена ростом ее распространенности и неблагоприятным влиянием на течение и исход беременности. Анемия ведет к развитию тканевой гипоксии беременных, а в последующем — гемической гипоксии и вторичных метаболических расстройств [10]. Метаанализ (2000) показал возрастание частоты осложнений при уровне гемоглобина ниже 100–110 г/л в течение первых двух триместров беременности [11]. Невозможность удовлетворения потребности в кислороде, возрастающей в ходе беременности на 15–33%, сопряжена с развитием на фоне длительной анемии нарушения функций плаценты (трофической, метаболической и газообменной), плацентарной недостаточности (ПН), вплоть до задержки роста плода [10]. Следствием влияния хронической гипоксии при ЖДА считают развитие гипотрофии плода, асфиксии и патологической незрелости новорожденных [12]. Согласно мнению S. Parks и соавт., высокий риск неблагоприятных исходов для матери, плода и новорожденного реализуется только при анемии тяжелой степени [13].
Неэффективность терапии железосодержащими препаратами указывает на необходимость проведения дифференциальной диагностики с анемией хронических заболеваний (АХЗ, D63.8 по МКБ-10), однако данные о частоте и способах коррекции АХЗ при беременности малочисленны.
АХЗ — патогенетический ответ организма на длительный инфекционный, воспалительный или аутоиммунный процесс с нарушением пролиферации эритроидных предшественников [14]. Термином «инфект-анемия» обозначается частный вариант АХЗ, резистентной к препаратам железа, выделенный с целью акцентирования инфекционного генеза анемии. На инфект-анемию приходится порядка 4% от всех анемий у беременных [10].
Использование современных методов диагностики ЖДА и других анемий дает возможность понять основные механизмы регуляции метаболических процессов в организме. Указания на низкие уровни чувствительности и специфичности маркеров общего анализа крови (среднего объема эритроцитов (MCV), среднего содержания гемоглобина в одном эритроците (MCH), цветового показателя) нивелируют их изолированную диагностическую значимость [8].
Основными критериями ЖДА, отличающими ее от других вариантов анемии, являются гипохромия эритроцитов, уменьшение MCH, снижение концентрации сывороточного железа (СЖ) до значений менее 15 нг/мл, тенденция к лейкопении, увеличение СОЭ [15].
В отсутствие значимого снижения показателя СЖ «золотым стандартом» диагностики ЖДА считают снижение уровня ферритина в сыворотке крови до значений менее 15 мкг/л независимо от концентрации гемоглобина [8]. Однако диапазон референсных значений ферритина (10–90 мкг/л) свидетельствует о том, что на его концентрацию влияют воспалительные и аутоиммунные факторы, что отрицает его значимость только как индикатора запасов железа в организме [16]. Поэтому при АХЗ допустима вариабельность уровня ферритина от нормального до повышенного [17].
Применение других маркеров оценки запасов железа в организме — трансферрина, его растворимого рецептора, гепсидина и др. — в широкой практике не распространено, однако признается, что они имеют диагностическую ценность при воспалительных процессах в организме на фоне анемии [8, 18].
Сочетание ДЖ с хроническим воспалением, затрудняющим оценку феррокинетики, вносит весомый вклад в увеличение частоты акушерских и перинатальных осложнений. Необоснованное назначение препаратов железа при АХЗ (инфект-анемии) приводит к конкуренции за микроэлемент между клетками патогенов и хозяина. Именно поэтому эффективное снижение частоты неблагоприятных исходов беременности при анемии связывают с дифференцированной тактикой ведения в зависимости от генеза заболевания.
Цель исследования: оценить влияние особенностей феррокинетики и цитокинового профиля сыворотки крови на исходы беременности в зависимости от генеза анемии.
МАТЕРИАЛЫ И МЕТОДЫ
Контингент исследования составили беременные с ЖДА (n = 34) и АХЗ (инфект-анемией) (n = 28), обратившиеся в клинику кафедры акушерства и гинекологии с курсом перинатологии Дагестанского государственного медицинского университета (родильный дом № 2 г. Махачкалы, заведующая кафедрой — д. м. н., профессор Хашаева Т.Х.) для обследования и лечения. Беременные без анемии представляли группу контроля (n = 34).
Критерии включения:
• одноплодная прогрессирующая беременность;
• указание на наличие анемии до планирования беременности;
• информированное согласие женщины на использование биологического материала в научных целях.
Группы с анемией выделяли на основании рекомендуемых критериев: с ЖДА — по уровням ферритина и СЖ; с АХЗ — по уровням ферритина и CРБ. Принадлежность к группе с высоким инфекционным риском определяли по высокой соматической и гинекологической заболеваемости, подтвержденной в дальнейшем лабораторными данными (CРБ, лейкоцитарная формула).
Методы исследования включали проведение общего анализа крови, в ходе которого, помимо традиционных показателей (эритроциты, гемоглобин, тромбоциты, лейкоциты, лимфоциты, моноциты, СОЭ), анализировали MCV, MCH, уровни СЖ, CРБ (с целью подтверждения активности воспалительного процесса в организме), ферритина. Концентрацию ферритина определяли с помощью тест-системы «ИФА-ферритин» (г. Санкт-Петербург).
Оценивали цитокиновый профиль в сыворотке крови у беременных с анемией различного генеза (уровни IL-1β, -4, -8, -10, TNF-α, IFN-γ) методом ИФА.
Терапию железосодержащими препаратами (двухвалентное железо в дозе 100–300 мг/сут, сульфат железа + аскорбиновая кислота) дополняли сапплементацией фолатами (400–800 мкг/сут), витаминами и микроэлементами, диетой (полноценный белок, олигопептиды). Коррекция инфект-анемии достигалась лечением бактериальных вагинозов, ИППП.
Статистическая обработка полученных результатов выполнена при помощи прикладной программы Statistica 10.0 (StatSoft Inc., CША). Проверку выборки на соответствие нормальному распределению проводили с применением критерия Шапиро — Уилка. Методы описательной (дескриптивной) статистики включали оценку среднего арифметического (М) и средней ошибки среднего значения (m) для признаков, имевших непрерывное распределение, определение частоты признаков с дискретными значениями. Для выявления различий признаков с непрерывным распределением применяли t-критерий Стьюдента. Анализ межгрупповых различий по качественным признакам проводили с использованием критерия хи-квадрат (χ2), при числе наблюдений менее пяти — точного двустороннего теста Фишера. Рассчитывали отношение шансов (odds ratio, OR), 95%-й доверительный интервал (ДИ). Уровень значимости (р) при проверке статистических гипотез принимали равным 0,05.
РЕЗУЛЬТАТЫ
Представления о неблагоприятном влиянии анемии на развитие плода и дальнейшее здоровье ребенка определили интерес к клинико-анамнестическим характеристикам групп беременных с ЖДА (n = 34; 54,8%) и инфект-анемией (n = 28; 45,2%) на фоне хронического воспалительного процесса.
Среди беременных с инфект-анемией возрастная подгруппа 18–24 лет оказалась втрое больше, чем среди женщин с ЖДА (35,7% и 11,8% соответственно; χ2 = 5,0; p = 0,025). Доля женщин в возрасте 25–30 лет в обеих группах составила в среднем 48,2%. Беременные в возрасте от 31 года до 35 лет и 36–40 лет в группе с истинным ДЖ встречались в 2 и 4 раза чаще, чем с инфект-анемией, но различия не имели статистической значимости: 23,5% против 11,8% (p = 0,08) и 14,7% против 3,6% (p = 0,14) соответственно.
Принадлежность беременных с инфект-анемией к группе с высоким инфекционным риском определяло наличие у них болезней органов пищеварения в 1,8 раза чаще, чем у женщин с ЖДА (57,1% и 32,3% соответственно; χ2 = 4,6; p = 0,033), болезней мочевыделительной системы — в 4,1 раза чаще (60,7% и 14,7%; χ2 = 4,6; p = 0,001), двух и более самопроизвольных выкидышей — в 3,0 раза чаще (35,7% и 11,8%; χ2 = 5,0; p = 0,025). Бактериальные вагинозы имели 71,4% беременных с АХЗ и 47,0% — с ЖДА (χ2 = 5,6; p = 0,02), вагиниты — 57,1% и 32,3% женщин соответственно (χ2 = 6,4; p = 0,01). В группе с инфект-анемией внутриматочные вмешательства выполнялись вдвое чаще, чем при ЖДА (60,7% против 29,4%; χ2 = 6,1; p = 0,01), и отмечалась более низкая частота лечебно-восстановительных мероприятий после опорожнения матки по поводу репродуктивных потерь (32,1% против 47,0%; χ2 = 6,2; p = 0,013).
Проявления сидеропенического синдрома (изменения кожных и слизистых покровов, вкусовых и обонятельных ощущений) в обеих группах отмечали со II триместра беременности, во второй половине гестации присоединилась симптоматика гипоксии: снижение работоспособности, гипотония, слабость, одышка.
При сравнении гематологических параметров в группе с ЖДА выявлено более значительное снижение показателей гемоглобина, эритроцитов, MCV, MCH, чем у беременных с инфект-анемией (табл. 1).
Таблица 1
Гематологические параметры беременных с анемией различного генеза (M ± m)
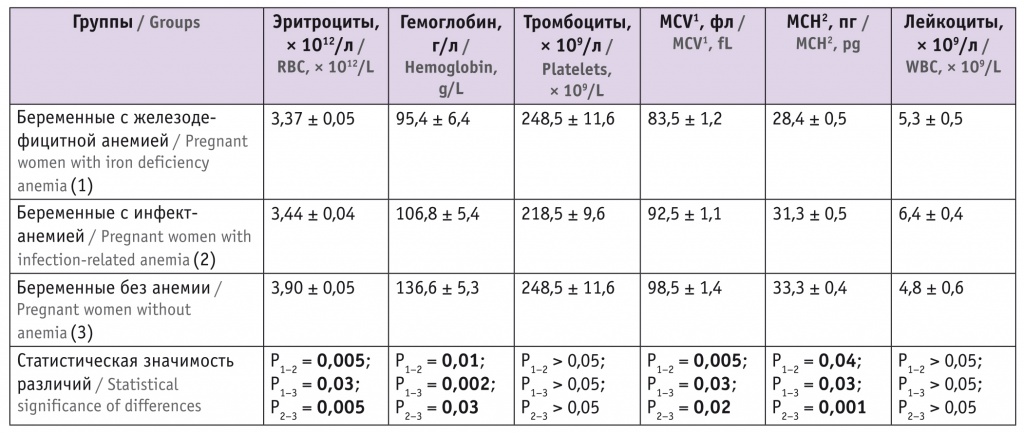
1 Средний объем эритроцитов.
2 Среднее содержание гемоглобина в одном эритроците.
По содержанию лейкоцитов и тромбоцитов группы с анемией не имели статистически значимых различий с контрольной группой.
Уровень белка у беременных с ЖДА и инфект-анемией составил 70,6 ± 4,2 и 76,4 ± 5,3 г/л соответственно (p < 0,05). Содержание СЖ оказалось сниженным при ЖДА (7,8 ± 2,6 мкмоль/л) и, в меньшей степени, при инфект-анемии (10,4 ± 2,4 мкмоль/л; p < 0,05).
Результаты исследований гемограмм и биохимических маркеров беременных с анемией различного генеза представлены на рисунке.
Рис. Гематологические параметры беременных с анемией различного генеза, %
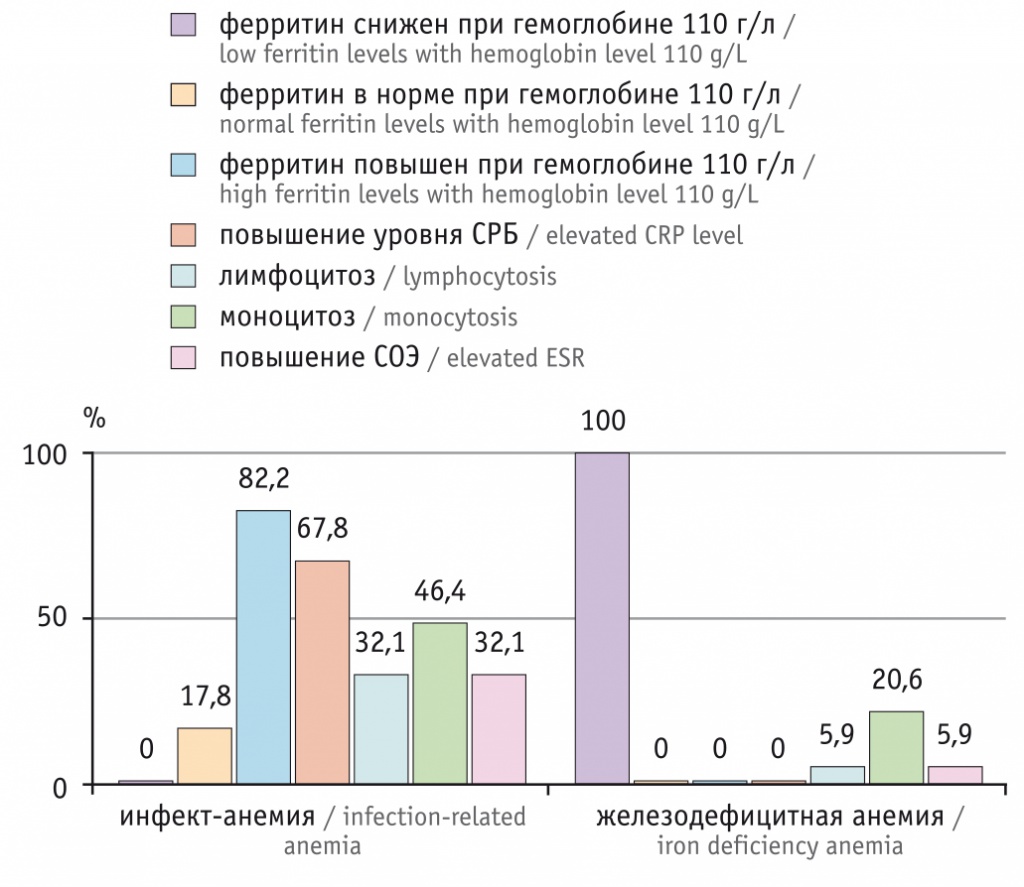
Содержание ферритина в выборке с инфект-анемией варьировало: у 17,8% женщин было нормальным, у 82,2% — повышенным (при гемоглобине 110 г/л). Лечение железосодержащими препаратами при инфект-анемии требуется только после ликвидации причины перераспределения железа и при подтверждении низкого уровня СЖ. О необходимости противовоспалительной и антиоксидантной терапии у беременных с инфект-анемией свидетельствовали повышение уровня CРБ (у 67,8% женщин) и СОЭ (у 32,1%), моноцитоз (у 46,4%) и лимфоцитоз (у 32,1%).
Маркером истинного ДЖ являлся пониженный уровень ферритина (у 100,0% женщин) при низкой частоте воспалительных заболеваний вирусного генеза (моноцитоз обнаружен у каждой пятой женщины, повышение СОЭ — у 5,9%, что в 5,4 раза реже, чем в группе с инфект-анемией).
Исследование цитокинового статуса беременных с анемией различного генеза показало статистически значимые различия между беременными с инфект-анемией и женщинами контрольной группы (табл. 2).
Таблица 2
Особенности цитокинового профиля беременных с анемией различного генеза (M ± m), пг/мл
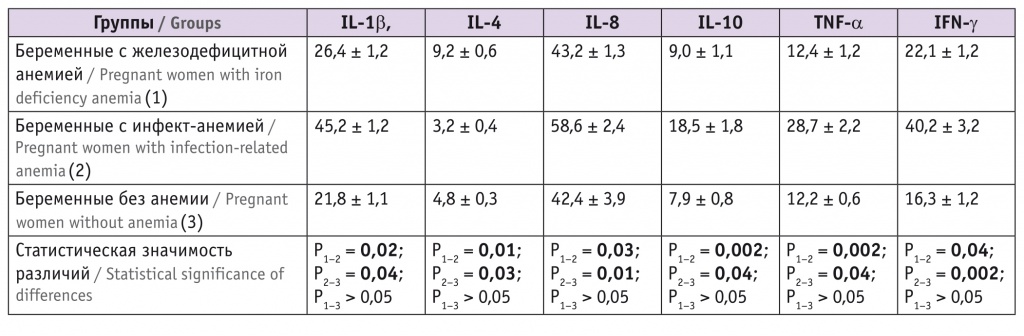 Выявлены повышенные значения провоспалительных цитокинов в выборке с инфект-анемией в сравнении с ЖДА. Содержание белка острой фазы IL-1β у беременных с АХЗ оказалось выше в 1,7 раза, IL-8 — в 1,4 раза, IFN-γ — в 1,8 раза, IL-10 и TNF-α — в 2,0 и 2,3 раза соответственно (p < 0,05). Уровень IL-4 у беременных с ЖДА превышал таковой в группе с инфект-анемией в 2,9 раза (p < 0,05). Средние показатели цитокинового профиля беременных с ЖДА и физиологической беременностью (ФБ) оказались сопоставимыми (p > 0,05).
Выявлены повышенные значения провоспалительных цитокинов в выборке с инфект-анемией в сравнении с ЖДА. Содержание белка острой фазы IL-1β у беременных с АХЗ оказалось выше в 1,7 раза, IL-8 — в 1,4 раза, IFN-γ — в 1,8 раза, IL-10 и TNF-α — в 2,0 и 2,3 раза соответственно (p < 0,05). Уровень IL-4 у беременных с ЖДА превышал таковой в группе с инфект-анемией в 2,9 раза (p < 0,05). Средние показатели цитокинового профиля беременных с ЖДА и физиологической беременностью (ФБ) оказались сопоставимыми (p > 0,05).
Признаки ПН встречались у всех беременных выборки с инфект-анемией и в 1,6 раза реже в отсутствие воспалительной составляющей (100,0% против 63,8%). Роль инфект-анемии в генезе осложнений беременности подтверждается тем, что в этой группе в сравнении с женщинами с ЖДА рецидивирующие вирусные инфекции наблюдались в 2 раза чаще (OR = 2,9; 95%-й ДИ: 1,7–4,8), частота преждевременного созревания плаценты была выше в 2 раза (OR = 2,1; 95%-й ДИ: 1,1–3,9), признаков внутриутробных инфекций — в 3 раза (OR = 3,5; 95%-й ДИ: 1,0–12,1), неблагоприятных перинатальных исходов — в 1,5 раза (OR = 2,4; 95%-й ДИ: 1,4–3,9).
Показатели родоразрешения в группах с анемией статистически значимо не различались: частота срочных родов составила 82,3%, преждевременных — 17,7%, методом кесарева сечения — 12,9%.
Причиной более неблагоприятного влияния инфект-анемии на здоровье новорожденных считают значительное снижение адаптационных ресурсов плаценты на фоне выраженной смешанной (гемической, циркуляторной и тканевой) гипоксии, особенно при отсроченной медикаментозной коррекции ПН или неадекватности лечения генезу заболевания.
Новорожденные от матерей с АХЗ отличались несколько меньшей массой тела (2850 ± 140 г против 2970 ± 280 г в группе с ЖДА), межгрупповые различия не имели статистической значимости (p = 0,07).
Доля новорожденных, нуждавшихся в переводе в отделение реанимации и интенсивной терапии, у женщин с анемией в целом составила 16,1%, в группе с АХЗ она была в 2,8 раза выше, чем с ЖДА (25,0% против 8,8%; p > 0,05). Перевод на второй этап выхаживания потребовался 17,7% новорожденных групп с анемией против 5,9% при ФБ.
В группе с инфект-анемией в выхаживании нуждалось несколько большее количество детей, чем при ЖДА, но различие не имело статистической значимости (25,0% и 11,8% соответственно; p > 0,05).
Снижение компенсаторных ресурсов в группе с инфект-анемией объясняло бо́льшую, чем у женщин с ЖДА, заболеваемость новорожденных: в 2,1 раза более высокую частоту гипотрофии (42,8% против 20,6%; χ2 = 5,9; p = 0,015) и в 3,3 раза — инфекционно-воспалительных заболеваний — длительного заживления пупочной ранки, конъюнктивита, везикулеза (28,6% против 8,8%; χ2 = 4,1; p = 0,04). Признаки морфофункциональной незрелости выявлены практически у половины новорожденных в группе с АХЗ и у каждого шестого — в группе с ЖДА (p = 0,06).
Гипоксически-ишемическое поражение ЦНС новорожденных как следствие гемодинамических нарушений в системе «мать — плацента — плод» и недоношенность новорожденных в 1,8 раза чаще отмечали в группе с инфект-анемией, однако в обоих случаях отличия от беременных с ЖДА не имели статистической значимости: 32,1% против 17,6% (p = 0,2) и 10,7% против 5,9% (p = 0,5) соответственно.
ОБСУЖДЕНИЕ
Причины неудовлетворительных исходов гестации у женщин с анемией представляются преодолимыми за счет совершенствования лечебно-диагностических подходов. Очевидно, что оптимальным является прегравидарное оздоровление женщин с анемией, поскольку даже при высоких компенсаторных ресурсах плаценты прогрессирование беременности в условиях ангиопатии сосудов матки определяет аномальный тип ее развития [1, 10]. Поэтому нельзя согласиться с мнением об отсутствии предикторной значимости гематологических и биохимических индексов в отношении развития плацентарной дисфункции или потерь беременности. Невосполненный к моменту беременности ДЖ угрожает развитием неблагоприятных исходов для матери и плода, а сокращение рисков достигается при понимании различий в генезе анемии и адекватной лечебно-диагностической тактике [19, 20].
Совокупность тестов, позволяющих диагностировать анемию, подтвердила необоснованность ориентации при ее выявлении исключительно на показатели гемоглобина и СЖ: в выборке беременных с ЖДА наряду со снижением MCV и MCH критерием истинного ДЖ выступал пониженный уровень ферритина [21]. Наши заключения соответствуют данным об анемии, выявленным при MCV менее 80 фл, распределении эритроцитов по объему более 15,0%, концентрации железа менее 40 мкг/дл, ферритина менее 12 нг/мл наряду с высоким средним уровнем лейкоцитов [22]. Низкий гемоглобин (не ниже 100 г/л) в отсутствие других доказательств анемии не является индикатором потребности в ферротерапии [17].
Следует указать на необходимость расширения объема обследования у беременных с высоким инфекционным риском, поскольку неверное заключение о генезе анемии определяет стойкую резистентность к традиционной терапии железосодержащими препаратами.
Вариабельность уровня ферритина у беременных с инфект-анемией, эталонным маркером которой является повышенное содержание CРБ, связывают с перераспределением железа при хроническом воспалительном процессе [23]. Эффективность выявления очагов воспаления в организме возрастает при исследовании уровней цитокинов, информативность которых доказана с позиций прогнозирования гестационных осложнений — ПН, недонашивания [[24]. Повышенную экспрессию провоспалительных цитокинов следует считать ключевым звеном патогенеза АХЗ ввиду потенцирования нарушений захвата железа эритроидными предшественниками, угнетения синтеза эритропоэтина [25].
Повреждающее влияние избытка TNF-α заключается в сокращении длительности жизни эритроцитов за счет стимуляции макрофагов. IFN-γ способствует депонированию СЖ в активированных макрофагах посредством стимуляции экспрессии ферритина [26].
Получено подтверждение стимуляции синтеза провоспалительных цитокинов (IL-1, IL-6, TNF-α) на фоне развития сопутствующей ДЖ гипоксии с формированием синдрома системного воспалительного ответа [27].
Доказано, что избыток провоспалительных цитокинов способствует ограничению инвазии цитотрофобласта, активации прокоагулянтного звена гемостаза с возникновением тромбозов, инфарктов и отслойки трофобласта / «ранней» плаценты, вплоть до потерь беременности [28].
Нарушения иммуногенеза с дисбалансом цитокинов в условиях хронического воспалительного процесса и инфект-анемии определяли кризис ангиогенеза плаценты на фоне метаболических сдвигов, некорригируемых на этапе планирования беременности. Нарушение молекулярных механизмов биосинтеза белка в плаценте в выборке с инфект-анемией определялось не только дефицитом СЖ, но и маркерами инфекционно-воспалительного процесса, истощающего запасы сывороточных протеинов.
Результаты нашего исследования подтверждают отрицательное влияние анемии различного генеза на состояние плода и новорожденного вследствие как изолированного нарушения обмена железа, так и истощения его запасов наряду с активацией иммунных факторов [29]. Высокая частота гестационных осложнений и неблагоприятных перинатальных исходов, детерминированная молекулярно-клеточным стрессом в условиях хронического воспаления и ДЖ, убеждает в значимости рационального ведения беременных с ранних сроков гестации [30].
Таким образом, микроокружение эмбриона на фоне анемии любого генеза несостоятельно в отсутствие прегравидарного оздоровления; без профилактики ранней ПН в дальнейшем нарушается активность фетоплацентарного комплекса.
Совершенствование лечебно-диагностических подходов у беременных с анемией предполагает комплексное микробиологическое обследование в группе высокого инфекционного риска (с внутриматочными вмешательствами и заболеваниями мочеполового тракта в анамнезе) с целью уточнения наличия вирусных и бактериальных инфекций латентного и субклинического течения. Лечение ИППП, воспалительных процессов органов малого таза и экстрагенитальной сферы на прегравидарном этапе не только способствует сохранению репродуктивной функции, но и снижает риск развития инфект-анемии и, соответственно, неблагоприятных исходов беременности. Вовлеченность в обмен железа ключевых медиаторов воспаления указывает на целесообразность исследования цитокинового профиля в группах женщин с высоким инфекционным риском.
ЗАКЛЮЧЕНИЕ
При железодефицитной анемии в организме беременных обнаружено сниженное содержание депонированного железа, сывороточного железа (СЖ), рутинных гематологических показателей обмена железа (среднего объема эритроцитов и среднего содержания гемоглобина в эритроците); анемия хронических заболеваний при снижении уровня СЖ характеризовалась нормальными или повышенными значениями острофазового белка ферритина и CРБ.
Комплексное биохимическое и иммунологическое исследование позволяет утверждать, что предсуществующая анемия любого генеза оказывает системное отрицательное влияние на течение беременности.
Необходимы выявление и оздоровление женщин с анемией любого генеза на прегравидарном этапе, ранняя профилактика акушерских осложнений как стратегия снижения перинатальной заболеваемости в Республике Дагестан.
Поступила: 09.01.2020
Принята к публикации: 24.03.2020








