ВВЕДЕНИЕ
Эндометриоз — хроническое воспалительное гормонозависимое гинекологическое заболевание доброкачественного течения, характеризующееся наличием ткани, подобной эндометрию, за пределами полости матки. Эндометриоидные очаги в большинстве случаев обнаруживаются на брюшине малого таза, яичниках и маточно-крестцовых связках, в ректовагинальной перегородке и пузырно-маточной складке, реже в кишечнике, диафрагме, пупке, перикарде и плевре. У некоторых женщин эндометриоз может протекать бессимптомно, однако зачастую это заболевание становится причиной бесплодия или различных вариантов болевого синдрома, таких как дисменорея, диспареуния, хроническая тазовая боль (ХТБ)[1].
Болевой синдром является одним из самых частых клинических проявлений эндометриоза и крайне негативно влияет на качество жизни, сексуальную функцию, эффективность работы и социальную жизнь женщины. Хирургическое удаление очагов эндометриоза значительно уменьшает болевой синдром[2], однако может быть связано с интра- и постоперационными осложнениями и снижением овариального резерва. Кроме того, после оперативного лечения ассоциированного с эндометриозом болевого синдрома наблюдается значительная частота рецидивов[3]. Таким образом, ключевую роль в долгосрочном лечении и предупреждении рецидивов эндометриоза играет медикаментозная терапия[4, 5].
Ряд авторов считает, что современные гормональные методы лечения практически не повышают частоту наступления беременности при ассоциированном с эндометриозом бесплодии и направлены преимущественно на уменьшение болевого синдрома[6]1. При этом в период, когда пациентки прекращают гормональную терапию заболевания в связи с побочными эффектами или для реализации репродуктивной функции, боли могут возобновиться[6]2. Общепризнано, что эстрогены имеют первостепенное значение в развитии и прогрессировании эндометриоза. Большинство гормональных препаратов, используемых в настоящее время для лечения боли, связанной с эндометриозом, в первую очередь оказывают влияние на подавление секреции эстрадиола яичниками, модулируя гипоэстрогенное состояние[6]. Гормональная терапия первой линии, используемая для лечения ассоциированного с эндометриозом болевого синдрома, сегодня представлена прогестагенами и агонистами гонадотропин-рилизинг-гормона3.
Однако после первоначального описания предполагаемого патогенеза эндометриоза, сделанного J.A. Sampson[7], знания о молекулярных путях развития заболевания значительно расширились. На основании результатов молекулярных исследований для его лечения было протестировано (in vitro и на животных моделях хирургически индуцированного экспериментального эндометриоза) несколько новых лекарственных средств[8].
Одним из этих средств стал бигуанид метформин. Предполагаемый механизм лечебного действия метформина при эндометриозе заключается в снижении активности фермента ароматазы и подавлении пролиферации железистого компонента эндометрия[9]. Поступление холестерина в митохондрии контролируется стероидогенным острым регуляторным белком (англ. Steroidogenic Acute Regulatory protein, StAR), уровень которого в стромальных клетках эндометриоидных гетеротопий в 264 раза выше, чем в эутопическом эндометрии[10]. В литературе представлены данные о супрессивном влиянии метформина на продукцию StAR, регулирующего биосинтез эстрогенов[10, 11]. Содержание эстрадиола, циркулирующего в крови, снижается в ответ на повышение уровня глобулина, связывающего половые гормоны, и это приводит к уменьшению очагов эндометриоза[12].
Кроме того, установлено, что метформин оказывает прямое влияние на стероидогенез в ткани яичников, подавляя выработку ФСГ, прогестерона и эстрадиола в гранулезных клетках[13]. Таким образом, метформин может подавлять эндометриоидные гетеротопии за счет ингибирования как овариальной, так и локальной продукции эстрогенов. При использовании метформина зафиксировано увеличение количества рецепторов к прогестерону в клетках карциномы эндометрия[14].
Исходя из известных механизмов действия метформина на процессы стероидогенеза, воспаления и пролиферации, которые играют существенную роль в патогенезе эндометриоза, можно предположить, что данный бигуанид перспективен для патогенетического лечения эндометриоза.
Ранее нами на основании экспериментальной модели эндометриоза на крысах было продемонстрировано уменьшение размеров (61%) или полная резорбция (39%) эндометриоидных имплантатов на фоне применения метформина, причем его эффективность была сопоставима с эффективностью диеногеста — классического прогестагена для лечения эндометриоза, который в настоящее время рассматривается в качестве первой линии терапии заболевания[15].
Цель исследования: оценить клиническую эффективность метформина в комбинированной и монотерапии наружного генитального эндометриоза (НГЭ).
МАТЕРИАЛЫ И МЕТОДЫ
Открытое проспективное рандомизированное неконтролируемое исследование в параллельных группах проведено в центре «Диагностика и лечение эндометриоза» ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта» (директор НИИ АГиР им. Д.О. Отта — член-корреспондент РАН, д. м. н., профессор И.Ю. Коган) в 2017–2018 гг. Набор пациенток осуществлялся в течение 1,5 года, общая продолжительность работы составила 2 года.
Дизайном исследования предусматривалось сравнение экспериментального лечения ассоциированного с эндометриозом болевого синдрома метформином в дозе 1500 мг/день
«вне инструкции» со стандартной гормональной терапией диеногестом в дозе 2 мг/день, а также схем комбинированного применения стандартной гормональной терапии диеногестом в дозе 2 мг/день с метформином в дозах 750 и 1500 мг/день. Нулевая гипотеза заключалась в утверждении, что использование метформина в терапии ассоциированного с эндометриозом болевого синдрома не способствует изменению частоты и интенсивности дисменореи, диспареунии и ХТБ.
В исследование были отобраны 146 женщин с ассоциированным с эндометриозом болевым синдромом.
Критериями включения являлись:
– подписанное и датированное информированное согласие на применение метформина «вне инструкции» для терапии НГЭ;
– возраст от 18 до 45 лет;
– регулярный менструальный цикл;
– диагноз НГЭ, установленный во время органосохраняющей операции, выполненной лапароскопическим доступом, с последующим гистологическим подтверждением;
– наличие ассоциированного с эндометриозом болевого синдрома, документально подтвержденное регистрацией одного или нескольких симптомов: дисменореи; болей в области малого таза, не связанных с менструальным циклом; диспареунии.
В исследование не включались женщины с ожирением, миомой матки, синдромом поликистозных яичников, сахарным диабетом, гипер- или гипогонадотропной недостаточностью яичников, гиперчувствительностью к любому компоненту используемых препаратов, нарушением функции почек или печени, хроническими соматическими заболеваниями в стадии декомпенсации.
Из 146 участниц исследования были сформированы четыре группы:
– в группе 1 (n = 32; 21,9%) применяли стандартную терапию диеногестом в дозе 2 мг/день;
– группа 2 (n = 61; 41,8%) получала комбинированную терапию в составе 2 мг диеногеста и 1500 мг метформина ежедневно;
– в группу 3 (n = 29; 19,9%) входили пациентки с дефицитом массы тела или отказавшиеся от прохождения перорального глюкозотолерантного теста, которым была назначена комбинированная терапия из 2 мг диеногеста и 750 мг метформина ежедневно;
– к группе 4 (n = 24; 16,4%) относились пациентки с противопоказаниями к назначению гормономодулирующей терапии, планировавшие беременность или воздерживавшиеся от приема гормональных препаратов, у которых проводилась монотерапия метформином в дозе 1500 мг/день.
Распределение женщин в группы 1 и 2 происходило случайным образом. Для рандомизации использовался блочный метод.
Все препараты назначались перорально 1 раз в день. Для уменьшения побочных эффектов метформин в группах 2 и 4 вводился с постепенной титрацией: в дозе 750 мг/день в течение 1-й недели с последующим переходом на 1500 мг/день. Применение терапии в группах пациенток, получавших диеногест или комбинацию диеногеста и метформина, было рекомендовано с 5-го дня менструального цикла. Продолжительность лечения во всех группах составила 6 месяцев.
Обследование включало опрос, сбор акушерско-гинекологического и соматического анамнеза пациенток. В ходе опроса особое внимание уделялось оценке интенсивности болевого синдрома по визуально-аналоговой шкале (ВАШ). Всем пациенткам проводили стандартное физикальное и специальное гинекологическое обследование.
В качестве основного исхода оценивалась динамика дисменореи, диспареунии и ХТБ у больных НГЭ по ВАШ с выделением двух контрольных точек — на этапе включения в исследование и через 6 месяцев терапии.
Для статистического анализа данных было использовано программное обеспечение Jamovi с открытым исходным кодом (Сидней, Австралия). Проверку нормальности распределения проводили с помощью критерия Шапиро — Уилка. Описание количественных данных с нормальным распределением выполнено с применением среднего значения (M) и стандартного отклонения (SD), данные с распределением, отличавшимся от нормального, описаны медианой (Me) и квартилями (Q1; Q3). Для сравнения количественных данных между группами использованы t-критерий Стьюдента и критерий Манна — Уитни, для анализа номинальных данных — критерий хи-квадрат (χ2) Пирсона с определением отношения шансов (OR) и 95%-ного доверительного интервала (ДИ). Различия считались статистически значимыми при p < 0,05.
Исследование одобрено локальным этическим комитетом ФГБНУ «НИИ АГиР им. Д.О. Отта» (протокол № 80 от 11.10.2016).
РЕЗУЛЬТАТЫ
Клинические характеристики участниц исследования
Возраст включенных в исследование женщин с НГЭ (n = 146) составлял 31,3 ± 6,4 года (от 22 до 44 лет). Все пациентки имели ассоциированный с эндометриозом болевой синдром. Наиболее распространенной являлась дисменорея, отмечавшаяся у 137 (93,8%) больных НГЭ, ее выраженность составляла 6 (4; 8) баллов; 82 пациентки (56,2%) предъявляли жалобы на диспареунию выраженностью 4 (0; 6) балла; 61 (41,8%) — на ХТБ выраженностью 2 (0; 5) балла.
У большинства (n = 133; 91,1%) пациенток ИМТ находился в пределах нормальных значений, у 6 (4,1%) был отмечен избыток массы тела, у 7 (4,8%) — дефицит массы тела. Средний показатель ИМТ составил 22,49 ± 3,26 кг/м2.
Средний возраст наступления менархе — 12,9 ± 3,8 года (от 10 до 16 лет). Средняя продолжительность менструального цикла — 26,3 ± 4,4 дня (от 20 до 38 дней). Регулярный менструальный цикл отмечен у 124 (84,9%) женщин. Среди нарушений менструального цикла ведущими были аномальные маточные кровотечения по типу перименструальных кровянистых выделений (n = 77; 52,7%). Отмечались также олигоменорея (n = 44; 30,1%), межменструальные мажущие кровянистые выделения (n = 25; 17,1%), обильные менструальные кровотечения (n = 7; 4,8%).
Основные результаты исследования
После окончания курса лечения частота встречаемости исследуемых проявлений болевого синдрома — дисменореи, диспареунии, ХТБ — статистически значимо уменьшилась во всех группах (p < 0,001) (рис.).
Рис. Изменение частоты встречаемости болевого синдрома на фоне различных видов медикаментозной терапии, %
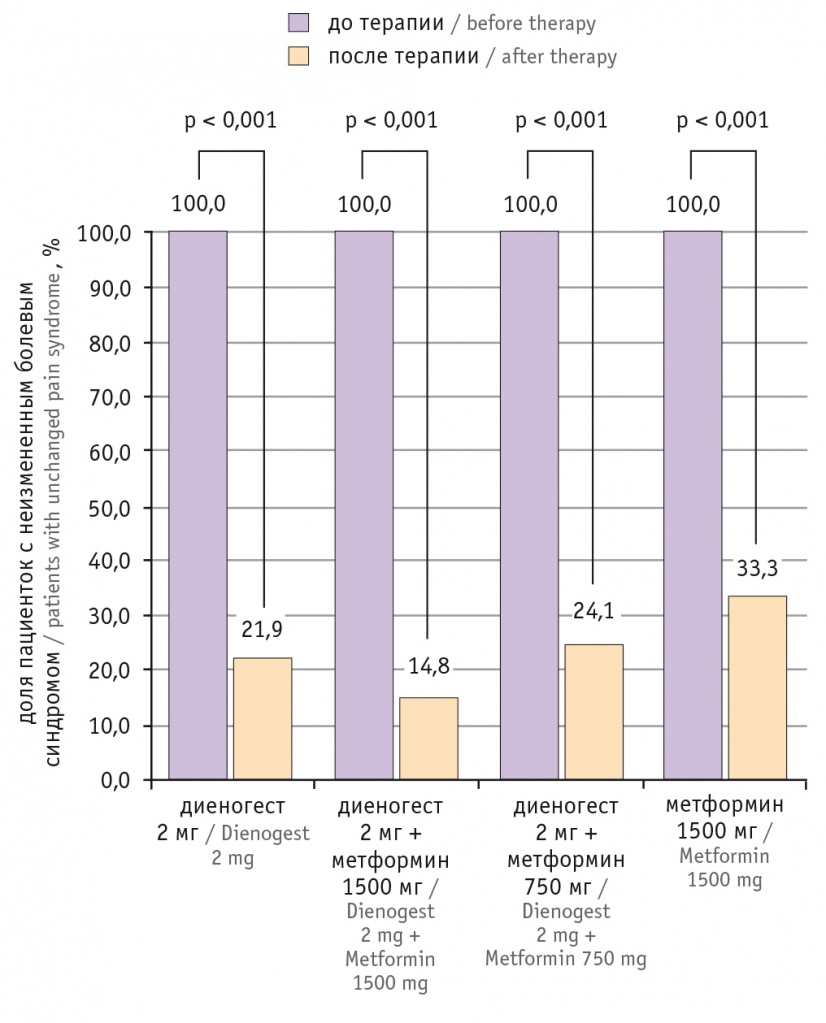
При применении комбинации 2 мг диеногеста с 1500 мг метформина (группа 2) у 85,2% (52/61) больных отмечено уменьшение болевого синдрома: 24 пациентки перестали предъявлять жалобы на боли; у остальных выраженность дисменореи по ВАШ снизилась в 2,6 раза, диспареунии — в 1,3 раза, ХТБ — в 2,5 раза. Применение комбинации 2 мг диеногеста с 750 мг метформина (группа 3) характеризовалось уменьшением болевого синдрома у 75,9% (22/29) больных с полным исчезновением боли у 17 пациенток и ослаблением у 5 женщин, среди которых выраженность дисменореи снизилась в 2,0 раза, диспареунии — в 2,9 раза, ХТБ — в 1,6 раза. В группах пациенток, получавших монотерапию диеногестом в дозе 2 мг/день (группа 1) или метформином в дозе 1500 мг/день (группа 4), болевой синдром уменьшился у 78,1% (25/32) и 66,7% (16/24) женщин соответственно. Болевой синдром в группе 1 перестал беспокоить 19 пациенток, у остальных выраженность дисменореи снизилась в 2,4 раза, диспареунии — в 3,3 раза, ХТБ — в 1,5 раза. В группе 4 болевой синдром исчез у 9 пациенток, у остальных выраженность дисменореи снизилась в 1,8 раза, диспареунии — в 1,5 раза, ХТБ — в 1,5 раза (см. рис., табл.).
Таблица
Динамика болевого синдрома у больных наружным генитальным эндометриозом на фоне различных видов медикаментозной терапии, баллы по визуально-аналоговой шкале, Me (Q1; Q3)
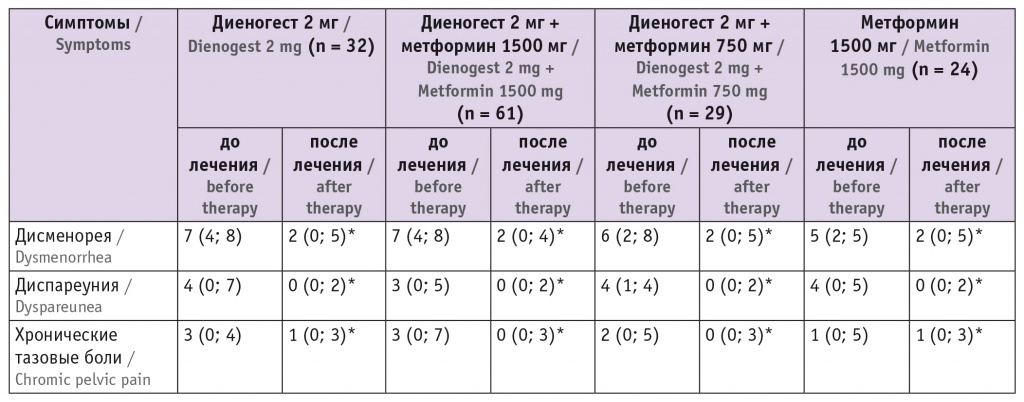
Примечание. Знаком (*) отмечены статистически значимые различия с исходными данными (p < 0,05).
При анализе исходов с помощью критерия χ2 Пирсона выявлены статистически значимые улучшения у пациенток, получавших комбинированную терапию в составе 2 мг диеногеста и 1500 мг метформина (группа 2), по сравнению с пациентками, получавшими только диеногест в дозе 2 мг/день (группа 1). Уменьшение дисменореи в группе 2 наблюдалось чаще (OR = 2,87; 95%-ный ДИ: 1,07–7,66; p = 0,031), а снижение интенсивности ХТБ было более выраженным, чем при монотерапии диеногестом (p = 0,027). Однако шансы и степень уменьшения диспареунии в этих группах не имели статистически значимых различий (χ2 = 0,03; p = 0,858).
Статистически значимых отличий исходов лечения в группах 3, 4 от исходов монотерапии диеногестом обнаружено не было, однако небольшой объем выборки не позволяет сделать окончательный вывод о сопоставимой эффективности этих схем.
Нежелательные явления
На фоне лечения диеногестом в дозе 2 мг/день у 37,5% (n = 12) пациенток побочных эффектов не возникло, 59,4% (n = 19) женщин отмечали нерегулярные мажущие кровянистые выделения, 12,5% (n = 4) предъявляли жалобы на мастодинию, у 3,1% (n = 1) появились приливы. При проведении терапии у 12,5% (n = 4) больных были обнаружены функциональные образования яичников размерами от 20 до 35 мм. В одном случае пациентка прекратила прием диеногеста в связи с появлением аллергической реакции.
На фоне сочетанного применения 2 мг диеногеста с 1500 мг метформина у 45,9% (n = 28) больных побочных эффектов не возникло, 34,4% (n = 21) женщин отмечали нерегулярные мажущие кровянистые выделения, 8,2% (n = 5) — мастодинию, 6,6% (n = 4) — появление приливов. У 8,2% (n = 5) пациенток при динамическом наблюдении в течение лечения были обнаружены функциональные кисты яичников размерами от 30 до 42 мм.
В группе, получавшей комбинированную терапию из 2 мг диеногеста и 750 мг метформина, у 17,2% (n = 5) пациенток побочных эффектов не возникло, нарушения менструального цикла по типу нерегулярных мажущих кровянистых выделений отмечали 65,5% (n = 19) женщин, мастодинию — 17,2% (n = 5), у 10,3% (n = 3) пациенток при проведении УЗИ органов малого таза были обнаружены функциональные образования яичников размерами до 40 мм.
Среди всех пациенток, получавших метформин в режиме монотерапии или в комбинации с диеногестом (группы 2, 3, 4), 21,1% (24/114) женщин отмечали эпизоды тошноты, металлического привкуса во рту, диспепсических явлений в начале курса лечения, однако данные побочные явления носили транзиторный характер и не явились основанием для отмены терапии.
ОБСУЖДЕНИЕ
Результаты настоящего исследования демонстрируют статистически значимое уменьшение частоты и выраженности ассоциированного с эндометриозом болевого синдрома на фоне терапии метформином. Высокая эффективность препарата, вероятно, обусловлена его антипролиферативным и противовоспалительным эффектом, влиянием на активность овариальной ароматазы и стероидные половые гормоны.
Комбинированное применение 2 мг диеногеста и 1500 мг метформина у больных НГЭ сопровождалось статистически значимым уменьшением частоты и интенсивности болевого синдрома. По сравнению с шестимесячным курсом лечения диеногестом в дозе 2 мг/день, сочетанная терапия с включением 1500 мг метформина характеризовалась более частым уменьшением выраженности дисменореи (OR = 2,87; 95%-ный ДИ: 1,07–7,66; p = 0,031) и более выраженным снижением интенсивности ХТБ (p = 0,027).
Немногочисленные литературные данные также подтверждают перспективность применения метформина в лечении эндометриоза как на экспериментальных моделях[16, 17], так и в клинических исследованиях[18, 19].
Нами впервые разработаны персонифицированные схемы комбинированного применения диеногеста с метформином в различных дозировках. Комбинация прогестагена с 1500 мг метформина в день продемонстрировала более высокую эффективность по сравнению со стандартной гормономодулирующей терапией диеногестом в дозе 2 мг/день.
78,9% (90/114) пациенток отметили удовлетворительную переносимость метформина, на фоне его использования не было зафиксировано серьезных побочных эффектов, что подтверждает безопасность использования препарата.
Период наблюдения не позволяет сделать выводы о влиянии метформина на рецидивы эндометриоза. Необходимо проведение дальнейших исследований с увеличением длительности использования препарата для уточнения данных о его эффективности и безопасности.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют об обоснованности применения метформина в комбинированной терапии ассоциированного с эндометриозом болевого синдрома. Наиболее эффективно сочетанное использование 1500 мг метформина с 2 мг диеногеста 1 раз в день. При наличии противопоказаний к приему гормональных препаратов может применяться монотерапия метформином в дозе 1500 мг/день, которая также характеризуется статистически значимым уменьшением выраженности болевого синдрома у больных генитальным эндометриозом. В случаях плохой переносимости 1500 мг метформина, дефицита массы тела или отказа от проведения глюкозотолерантного теста возможно использование 750 мг метформина в комбинации с 2 мг диеногеста 1 раз в день.
Перспективным направлением является персонализированная патогенетически обоснованная терапия генитального эндометриоза с индивидуальным подбором комбинации препаратов и дозы метформина.
Поступила: 12.03.2021
Принята к публикации: 31.03.2021
________
1 Endometriosis: diagnosis and management. NICE Guideline [NG73]. Published: Sept. 6, 2017. URL: https://www.nice.org.uk/guidance/ng73 (дата обращения — 01.03.2021).
2 Там же.
3 Эндометриоз: Клинические рекомендации МЗ РФ. URL: https://roag-portal.ru/recommendations_gynecology (дата обращения — 01.03.2021).








