ВВЕДЕНИЕ
Влияние эндометриоза на фертильность широко обсуждается в научной литературе, так как почти 50% женщин, страдающих этим заболеванием, бесплодны[1–3]. Одной из причин, вызывающих бесплодие при эндометриозе, считается имплантационная несостоятельность эндометрия, лежащая в основе нарушений его рецептивности.
Рецептивность эндометрия — это комплекс его структурно-функциональных параметров с четкими временны’ми и пространственными константами, характеризующими его способность к имплантации и вынашиванию беременности[4]. Подсчитано, что нарушения рецептивности эндометрия являются причиной ~40% неудач при имплантации эуплоидных эмбрионов[5]. Считается, что две трети таких неудач обусловлены эндометриальным фактором и лишь одна треть — эмбриональным[6]. Подтверждением служат исследования биоптатов этой уникальной ткани в период предполагаемого окна имплантации, соответствующего максимальной рецептивности эндометрия. В биоптатах выявлена аберрантная экспрессия таких маркеров рецептивности, как рецепторы прогестерона и эстрогенов, интегрины, фактор, ингибирующий лейкемию (LIF), гликоделин A (GdA), остеопонтин (OPN), рецептор лизофосфатидной кислоты 3 (LPA3), HOXA10 и др.[7].
Следует отметить, что существует и ряд контраверсионных убеждений, основанных на выводах клинических исследований, демонстрирующих большее влияние эмбрионального и овариального факторов при неудачах преодоления эндометриоз-ассоциированного бесплодия, опровергающих наличие функциональных изменений эутопического эндометрия при наружном генитальном эндометриозе (НГЭ)[6, 8, 9].
С учетом противоречивости и актуальности данной темы необходимы дальнейшие исследования, в первую очередь посвященные изучению патогенеза нарушений имплантационной несостоятельности эндометрия у женщин, страдающих бесплодием на фоне НГЭ.
Цель исследования: расширить представления о патогенезе имплантационной несостоятельности эндометрия у женщин с эндометриоз-ассоциированным бесплодием.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящее исследование включены 65 женщин в возрасте от 29 до 40 лет (средний возраст составил 35 ± 4,2 года) с морфологически верифицированным НГЭ (МКБ-10: N80.1, 80.3, 80.4). Исследование проведено на клинических базах кафедры акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН в 2019–2020 гг.
Основную группу составили 32 пациентки с НГЭ и бесплодием (МКБ-10: N97.8, средняя продолжительность бесплодия — 4,5 ± 0,8 года), имевшие de facto в анамнезе 2 и более безуспешные попытки переноса одного эмбриона хорошего качества в полость матки при проведении программ ВРТ. В группу сравнения вошли 33 пациентки с НГЭ, реализовавшие свою репродуктивную функцию не более 3 лет назад от момента исследования и не имевшие в анамнезе бесплодия, которые обратились для хирургического лечения тазовой боли, ассоциированной с НГЭ.
Группу морфологического контроля составили 13 фертильных женщин, имевших в анамнезе 2 и более родов доношенными здоровыми детьми и лапароскопическое вмешательство по поводу цистаденомы яичника, в ходе которого НГЭ обнаружен не был, давшие добровольное информированное согласие на участие в исследовании.
Материалом исследования являлись биоптаты эндометрия, полученные путем пайпель-биопсии на 5–7-й день после пика концентрации ЛГ в крови в период предполагаемого окна имплантации.
Полученный материал после гистологической проводки в автоматическом гистопроцессоре Leica ASP 30 заливали в парафин на станции Leica EG 1150 (Германия). Гистологические срезы толщиной 4 микрометра окрашивали гематоксилином и эозином в автоматической станции Leica ST 5010.
Микроскопическое исследование осуществлялось на триокулярном микроскопе Leica DMLB (окуляры с 10-кратным увеличением) с использованием цифровой камеры Leica DFC 420 (Германия). В полученных микропрепаратах проводилась патоморфологическая оценка состояния эндометрия, и при отсутствии патологических процессов биоптат включали в исследование.
Иммуногистохимическое исследование биоптатов эндометрия осуществлялось с использованием двухэтапного стрептавидин-биотин-пероксидазного метода с демаскировкой антигена и применением стандартных наборов моноклональных и поликлональных антител фирм Ventana, Cell Marque и Diagnostic BioSystems (США). Иммуногистохимическое окрашивание производилось в иммуностейнере Ventana BenchMark Ultra IHdSH (США) на парафиновых срезах по стандартной методике с предварительной демаскировкой антигенов в СВЧ-печи с использованием соответствующих антител к стероидным рецепторам, HOXA10, GATA2, GATA6, SF-1.
Обработку данных выполняли с помощью электронных таблиц Microsoft Excel и пакета прикладных программ IBM SPSS Statistics 26. Распределение количественных (параметрических) переменных на нормальность проверяли при помощи критерия Шапиро — Уилка с дополнительной оценкой асимметрии, эксцесса и гистограмм. При распределении, отличном от нормального, значения количественных переменных выражали в виде медианы (Ме) и межквартильного интервала (Q1–Q3).
Межгрупповые различия изучали с помощью критерия Стьюдента, U-критерия Манна — Уитни (для количественных переменных при отличном от нормального распределении и для непараметрических переменных). Связь между переменными оценивали с применением критерия ранговых знаков Вилкоксона. Нулевую гипотезу отвергали при уровне значимости p < 0,05.
РЕЗУЛЬТАТЫ
Эутопический эндометрий в период окна имплантации у пациенток с эндометриоз-ассоциированным бесплодием продемонстрировал аберрантную экспрессию исследуемых маркеров (табл.).
Таблица
Результаты иммуногистохимического исследования эутопического эндометрия женщин с эндометриоз-ассоциированным бесплодием, фертильных женщин с наружным генитальным эндометриозом и без него
* Отличия от группы морфологического контроля статистически значимы (р < 0,05).
** Отличия от группы сравнения статистически значимы (р < 0,05).
При сравнении пациенток с эндометриоз-ассоциированным бесплодием и фертильных женщин с НГЭ мы отметили в строме у бесплодных женщин повышение экспрессии GATA2 в 1,6 раза, GATA6 — в 1,7 раза, SF-1 — в 1,5 раза и снижение экспрессии HOXA10 в 2,9 раза (во всех случаях р < 0,05), что может свидетельствовать о нарушении локального гормонального баланса эндометрия из-за аберрантной экспрессии факторов, участвующих в его поддержании (GATA2, GATA6 и SF-1), и об уменьшении имплантационного потенциала эндометрия вследствие сниженной экспрессии HOXA10.
При сравнении фертильных женщин с НГЭ и без НГЭ мы выявили статистически значимое (р < 0,05) повышение экспрессии GATA2 в строме (в 1,6 раза) и в железах (в 1,8 раза). Согласно данным литературы, активация GATA2 необходима для содействия передачи сигналов прогестерона в строме эндометрия, что и наблюдалось в обеих группах[10]. По остальным параметрам значимых различий не было, что говорит о состоятельности имплантационного потенциала эндометрия у фертильных женщин как с НГЭ, так и без него.
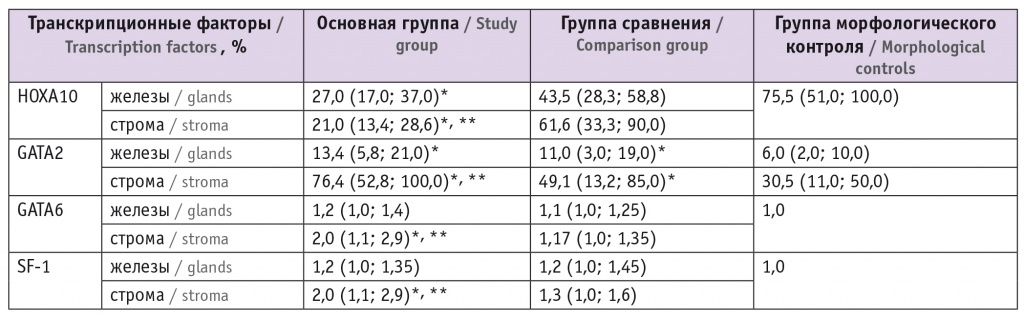
При сравнении пациенток с эндометриоз-ассоциированным бесплодием и фертильных женщин без НГЭ мы отметили статистически значимые (р < 0,05) повышение экспрессии GATA2 в строме (в 2,5 раза) и в железах (в 2,2 раза), GATA6 и SF-1 в строме (в обоих случаях в 2 раза) и снижение экспрессии HOXA10 как в строме (в 3,6 раза), так и в железах (в 2,8 раза) (рис. 1–4).
Рис. 1. Сравнительная характеристика экспрессии HOXA10. Иммуногистохимическое окрашивание антителами к HOXA10.
Примечание. Здесь и в рисунках 2–4: размер масштабной шкалы — 200 микрометров; А — основная группа, В — группа сравнения, С — группа морфологического контроля
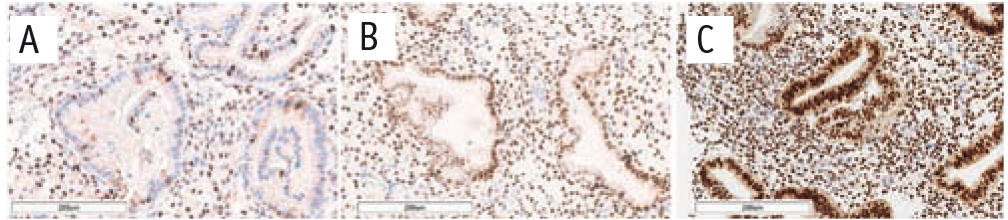
Рис. 2. Сравнительная характеристика экспрессии GATA2. Иммуногистохимическое окрашивание антителами к GATA2
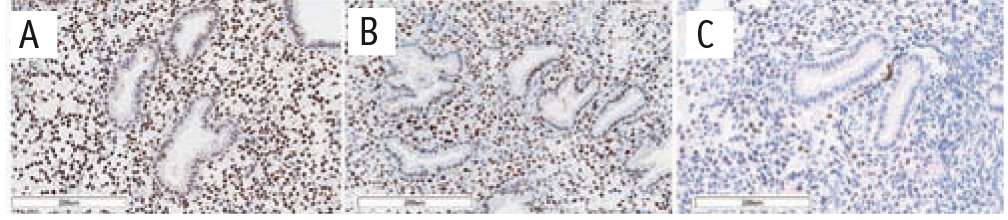
Рис. 3. Сравнительная характеристика экспрессии GATA6. Иммуногистохимическое окрашивание антителами к GATA6
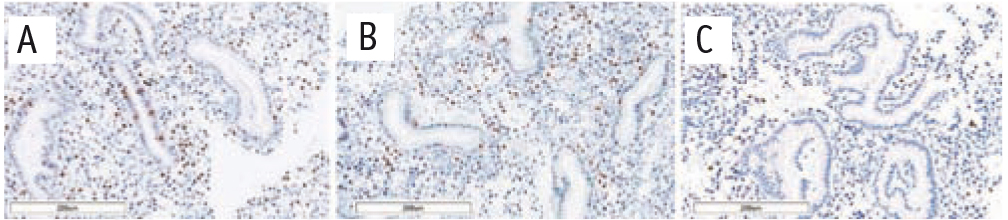
Рис. 4. Сравнительная характеристика экспрессии SF-1. Иммуногистохимическое окрашивание антителами к SF-1
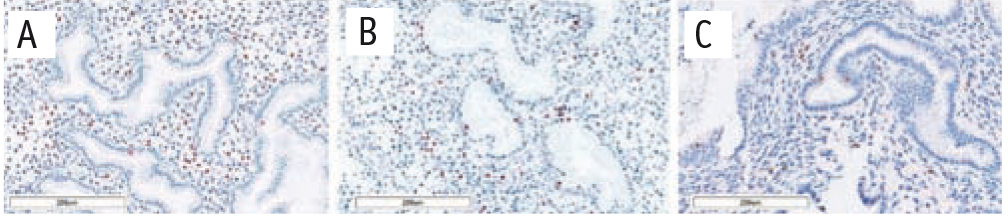
Полученные данные свидетельствуют о нарушениях в эутопическом эндометрии у женщин с эндометриоз-ассоциированным бесплодием, в первую очередь за счет более выраженного снижения имплантационного потенциала эндометрия, на что указывает уменьшение экспрессии HOXA10 не только в стромальном компартменте, но и в железистом, наряду с аберрантной экспрессией транскрипционных факторов GATA6 и SF-1, участвующих в стероидогенезе, и GATA2, являющегося регулятором прогестерон-зависимого сигнального пути и децидуализации. Их чрезмерная активация наблюдается именно при НГЭ и, по нашему мнению, вносит вклад в реализацию нарушений стероидного профиля эндометрия, а значит, ухудшает его восприимчивость к имплантации бластоцисты.
Стоит отметить, что в доступной литературе на момент нашего исследования не обнаружено ни одной работы, в которой методом иммуногистохимии изучали бы экспрессию GATA2, GATA6 и SF-1 в эутопическом эндометрии женщин с эндометриоз-ассоциированным бесплодием. Существуют единичные работы, посвященные оценке экспрессии данных транскрипционных факторов при эндометриозе, но преимущественно в клетках эктопического эндометрия, без уточнения наличия или отсутствия бесплодия[11–13].
ОБСУЖДЕНИЕ
Переход эндометрия в период окна имплантации в максимально восприимчивое состояние — результат взаимодействия в первую очередь эстрогена и прогестерона, являющихся «вершиной айсберга» сложных сигнальных каскадов, участие в которых принимают различные факторы роста и транскрипции, цитокины и многие другие биологически активные вещества.
В некоторых исследованиях показано, что молекулярная дезрегуляция, приводящая к нарушению рецептивности эндометрия за счет аберрантной экспрессии прогестероновых и эстрогеновых рецепторов, негативно влияет на фертильность женщин с НГЭ[14, 15]. Накапливается все больше данных, свидетельствующих об изменении преимущественно функциональных характеристик эутопического эндометрия при эндометриоз-ассоциированном бесплодии.
Предполагают, что очаги эндометриоза способны активировать пути передачи сигналов через эпигенетическую модуляцию экспрессии генов в эутопическом эндометрии, вызывая локальный гиперэстрогенизм и эстроген-индуцированное воспаление, препятствующие осуществлению ключевых функций главного гормона беременности — прогестерона[16, 17].
В ряде зарубежных работ продемонстрирована высокая специфичность для эндометриоза таких транскрипционных факторов, как GATA2, GATA6, SF-1, а для оценки рецептивности эндометрия — НОХА10[11–13, 18]. При подробном изучении механизмов, описанных в небольшом количестве исследований, мы обнаружили связь данных факторов в едином патогенезе, заключающемся в формировании резистентности к прогестерону.
Так, транскрипционные факторы GATA6 и SF-1 являются участниками стероидогенеза, а их повышенная экспрессия при НГЭ вызывает нарушения локального гормонального баланса за счет индукции эстроген-зависимых провоспалительных каскадов, изменяющих стероидный фон эндометрия, необходимый для успешной имплантации, в период его максимальной восприимчивости к бластоцисте. В свою очередь, GATA2, будучи одним из транскрипционных факторов, регулирующих прогестерон-зависимый сигнальный путь имплантационной состоятельности эндометрия, характеризует прогестерон-устойчивое состояние рецепторов, но его высокая экспрессия, специфичная для эндометриоз-ассоциированного бесплодия, дезрегулирует данный путь.
Снижение экспрессии HOXA10, вызванное нарушениями регуляции сигнальных путей стероидных гормонов, отражает уменьшение имплантационного потенциала эндометрия при эндометриоз-ассоциированном бесплодии.
Таким образом, перечисленные маркеры могут быть использованы для иммуногистохимической оценки имплантационной несостоятельности эндометрия у женщин с НГЭ и бесплодием.
ЗАКЛЮЧЕНИЕ
В эутопическом эндометрии женщин с наружным генитальным эндометриозом (НГЭ) и неудачными попытками имплантации наблюдаются функциональные нарушения, являющиеся результатом дезрегуляции стероидных рецепторов на фоне аномальной экспрессии транскрипционных факторов, специфичных для НГЭ, которая отражает нарушения имплантационного потенциала эндометрия, что клинически детерминируется неудачами имплантации.
Поступила: 27.03.2021
Принята к публикации: 02.06.2021








