ВВЕДЕНИЕ
Перипартальная кардиомиопатия (ПКМП) — идиопатическое заболевание миокарда, потенциально жизнеугрожающее состояние, проявляющееся сердечной недостаточностью со сниженной фракцией выброса левого желудочка менее 45% в III триместре беременности или в течение нескольких месяцев послеродового периода[1, 2].
ПКМП встречается с частотой 0,1%, или 1 случай на 1000–4000 беременностей. Несмотря на редкость данного заболевания, летальность по-прежнему остается высокой: в течение двух лет она может достигать 16%, пяти лет — 7–20%[3, 4].
ПКМП встречается во всем мире, большинство эпидемиологических данных поступает из США, Южной Африки, Нигерии и Гаити[5]. ПКМП связана с повышенным риском заболеваемости и смертности у матери и плода. Физиологические изменения, происходящие во время беременности, увеличивают риск развития сердечной недостаточности, особенно у женщин с кардиомиопатией в анамнезе. Во время беременности наблюдаются снижение системного сопротивления сосудов, а также увеличение задержки натрия и воды, что приводит к последующему возрастанию объема крови и сердечного выброса[6, 7].
Клинические проявления ПКМП развиваются стремительно и могут приводить к различным исходам: возможны как полное выздоровление, так и развитие стойкой дисфункции миокарда и сердечной недостаточности, а также быстрое ухудшение состояния, приводящее к острой необходимости временной или длительной механической поддержки кровообращения и трансплантации сердца[5, 8]. На сегодняшний день остаются не до конца изученными причины возникновения и факторы риска развития ПКМП.
Цель исследования: оценка факторов риска развития ПКМП на основании данных анамнеза, наследственной предрасположенности и особенностей течения настоящей беременности.
МАТЕРИАЛЫ И МЕТОДЫ
Для выполнения поставленной задачи проведен ретроспективный анализ историй беременности и родов 13 пациенток ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России за период 2012–2019 гг. с подтвержденным диагнозом ПКМП.
ПКМП является диагнозом исключения: он был установлен после исключения у пациенток всех других возможных причин снижения сократительной способности миокарда левого желудочка, таких как инфаркт миокарда, миокардит, тромбоэмболия легочной артерии, идиопатическая дилатационная кардиомиопатия и т. д.
Для постановки диагноза и дифференциальной диагностики применялись общеклинические (изучение жалоб и анамнеза, объективное и акушерское обследование), а также лабораторные и инструментальные методы исследования.
В рамках дифференциальной диагностики в центральной клинико-диагностической лаборатории перинатального центра ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России под руководством Е.Ю. Васильевой выполнялась оценка уровней тропонина I (хемилюминесцентный иммуноанализ на микрочастицах) и креатинфосфокиназы-МВ (иммуноингибирование), N-концевого пропептида натриуретического гормона В-типа (электрохемилюминесцентный иммуноанализ на микрочастицах), электролитов (непрямой ион-селективный электрод).
Инструментальные методы исследования включали трансторакальную эхокардиографию сердца, которая производилась в научно-исследовательском отделе физиологии кровообращения ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России под руководством А.В. Козленка с помощью ультразвукового сканера Philips iU22 xMatrix. УЗИ фетоплацентарного комплекса осуществлялось под руководством Ф.А. Овсянникова, к. м. н., врача отделения функциональной диагностики перинатального центра ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, на устройствах Voluson E6 (Австрия) и Philips iU22 (Нидерланды), снабженных блоком цветового доплеровского картирования, объемным и конвексным датчиком с частотой 3,5–5 МГц. Диагностические исследования проводились в В- и М-режимах.
РЕЗУЛЬТАТЫ
Возраст обследуемых пациенток варьировал от 19 до 46 лет, средний возраст составил 33 года. ИМТ установился от 20,07 до 49,0 кг/м2, среднее значение — 31,48 кг/м2, при этом нормальную массу тела имели 2 участницы, избыточную — 4, ожирение I степени — 3, ожирение II степени — 2, ожирение III степени — 2. Курение в анамнезе обнаружилось у 2 (15,4%) женщин.
До беременности, во время или после которой был поставлен диагноз ПКМП, у кардиолога наблюдались 2 пациентки, у которых в предыдущую беременность также устанавливали диагноз ПКМП. Наследственность по сердечно-сосудистой патологии была отягощена у 8 (61,5%) беременных: у 6 (46,2%) — по отцовской линии и у 4 (30,8%) — по материнской. У 7,7% наследственность была отягощена по приобретенной патологии клапанов сердца, у 7,7% — по врожденным порокам сердца, у 38,4% — по гипертонической болезни, у 15,4% — по ИБС и острому инфаркту миокарда, у 7,7% — по внезапной сердечной смерти до 55 лет, у 7,7% — по нарушениям сердечного ритма, у 15,4% — по острым нарушениям мозгового кровообращения.
У 3 (23,1%) обследуемых установлена наследственная предрасположенность к развитию тромбофилических состояний. Пациентка М. являлась носительницей генов полиморфизма F13, MTHFR 677, 1298, MTR, MTRR, а также гипергомоцистеинемии, по поводу которой она получала лечение высокими дозами фолиевой кислоты. У пациентки Ч. диагностирована гомозиготная мутация гена протромбина G20210A. У беременной Ш. обнаруживались клинически незначимые полиморфизмы фолатного цикла и системы фибринолиза.
Возраст на момент начала менструаций варьировал от 10 до 16 лет, в среднем составлял 12,5 года. У 11 (84,6%) пациенток менструации установились сразу. Продолжительность менструаций колебалась от 2 до 8 дней, в среднем — 5 суток. Длительность менструального цикла варьировала от 14 до 60 дней и в среднем составляла 29,5 дня. У 15,4% участниц менструации имели нерегулярный характер, болезненные менструации наблюдались у 23,1%, об обильных менструациях было известно у 7,7%.
При анализе анамнестических данных по гинекологическим заболеваниям обнаружено, что у 3 женщин имелась эктопия шейки матки, по поводу которой одной пациентке была проведена химическая коагуляция, двум — диатермоэксцизия. У 15,4% женщин в анамнезе был однократно перенесенный сальпингоофорит, у 7,7% он имел хронический характер. Множественная миома матки подтверждена у 15,4% обследуемых.
У 4 (30,8%) пациенток гинекологический анамнез отягощен однократно перенесенными ИППП (уреаплазмоз — 2 случая, микоплазмоз — 1, генитальный герпес — 1).
Бесплодие I в анамнезе отмечалось у 2 пациенток в среднем в течение 5–6 лет, у одной из них были проведены три протокола ЭКО + ИКСИ. Синдром поликистозных яичников отмечался у одной женщины, полип эндометрия — также у одной пациентки.
Обращает на себя внимание наличие в анамнезе частых ангин в детском возрасте и, как следствие, формирование хронического тонзиллита у 46,2% обследуемых, однако данные о развитии системных воспалительных заболеваний не получены.
Из анамнеза известно, что у 15,4% пациенток течение предыдущих беременностей осложнялось преэклампсией умеренной и тяжелой степени, у 15,4% — хронической АГ, у 15,4% — ХСН при диагнозе ПКМП, установленном в предыдущую беременность. К нарушениям ритма относились одиночная частая желудочковая экстрасистолия (7,7%), суправентрикулярная тахикардия с максимальной частотой желудочковых сокращений 240 в минуту (7,7%). У 8 (61,5%) женщин встречались отеки беременных.
Исходное систолическое АД до беременности варьировало от 90 до 160 мм рт. ст., диастолическое — от 50 до 100 мм рт. ст. У 2 (15,4%) участниц до беременности обнаруживалось стрессовое повышение АД более 140/90 мм рт. ст., пациентка Т. с диагнозом гипертонической болезни нерегулярно принимала ингибиторы АПФ.
Подавляющее большинство пациенток на момент постановки диагноза ПКМП являлись повторнобеременными (76,9%), 23,1% — первобеременными. При этом 6 (46,2%) женщин были первородящими, 7 (53,8%) — повторнородящими.
У 4 участниц предыдущие беременности окончились родоразрешением путем кесарева сечения, показаниями к которому стали преэклампсия тяжелой степени, слабость родовой деятельности, миопия высокой степени, преждевременные роды в 34 недели у пациентки с печеночной коликой (по одному случаю).
Течение беременности у пациенток с перипартальной кардиомиопатией
ОРВИ встречалась в I триместре у 4 (30,8%), во II триместре — у 1 (7,7%), в III триместре — тоже у 1 (7,7%) женщины. Течение ОРВИ в основном не сопровождалось повышением температуры тела свыше 37°С, но в двух случаях наблюдалось кратковременное появление одышки после перенесенной ОРВИ, данные о развитии миокардита не получены.
Угроза прерывания беременности зафиксирована в I триместре у 4 (30,8%) пациенток, во II триместре — у 3 (23,1%), в III — у 1 (7,7%).
Во время настоящей беременности в I триместре АД повышалось у одной обследуемой, во II триместре — у шести, в III триместре — у двух. У этих пациенток систолическое АД во II триместре варьировало от 140 до 170 мм рт. ст., диастолическое — от 63 до 90 мм рт. ст. В III триместре систолическое АД достигало у них 150 мм рт. ст., диастолическое колебалось от 90 до 100 мм рт. ст.
Отеки наблюдались у 8 (61,5%) женщин, в большинстве случаев отеки стоп, голеней, передней брюшной стенки, пальцев рук, одутловатость лица. Протеинурия диагностирована у 6 (46,2%) беременных, ее показатели варьировали от 0,3 до 4,0 г/л, в среднем составляли 1,6 г/л. Диагноз преэклампсии установлен у 5 (38,4%), гестационного СД — у 2 (15,4%) участниц.
Анемия легкой степени была у 5 (38,4%) женщин, в среднем уровень гемоглобина составлял 96 г/л. Анемия средней и тяжелой степени подтвердилась в 2 (15,4%) случаях, уровень гемоглобина — 88 г/л и 70 г/л соответственно. У пациентки Б. выявлена аутоиммунная гемолитическая, В12- и фолиеводефицитная анемия.
У 7 (53,8%) пациенток во II триместре наблюдалась одышка, в III триместре — у 8 (61,5%). При подробном опросе у 5 (38,4%) пациенток обнаружено снижение толерантности к физической нагрузке в I триместре, которое находилось в рамках физиологических изменений во время беременности у всех участниц, кроме двух с ХСН и ПКМП в анамнезе. Клинические проявления одышки имели различный характер: от ее возникновения при выраженной физической нагрузке (подъем по лестнице на 3 этаж) до появления симптомов в покое. Жалобы на «приступы сердцебиения» и «перебои в работе сердца» предъявляли 7 пациенток, при этом только у трех выявлены нарушения ритма (наджелудочковые и желудочковые).
Сроки и способы родоразрешения у пациенток с перипартальной кардиомиопатией
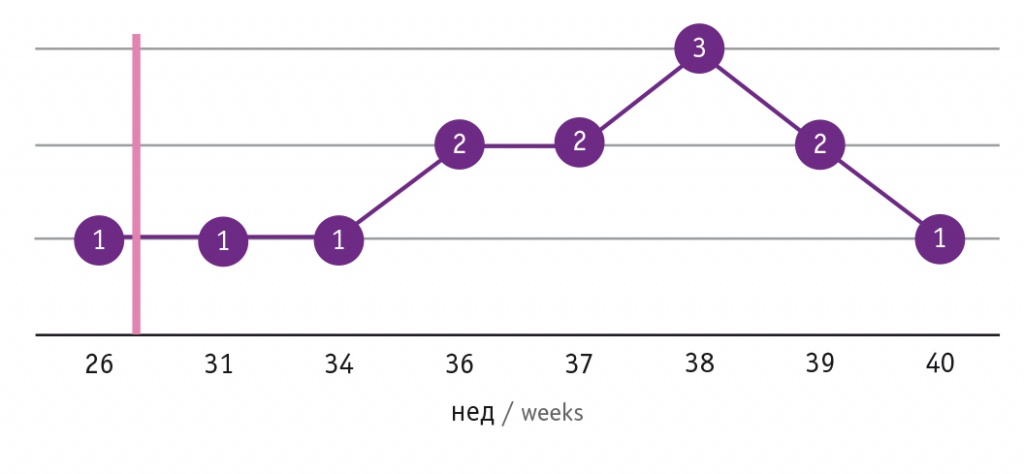
В доношенном сроке были родоразрешены 69,2% беременных (рис. 1), в недоношенном — 30,8%. В течение 24 часов с момента поступления родоразрешены 6 (46,2%) пациенток, от 3 до 12 суток — 7 (53,8%).
Рис. 1. Сроки родоразрешения беременных с перипартальной кардиомиопатией
Все участницы были родоразрешены путем кесарева сечения (табл.): экстренное кесарево сечение — 46,2% случаев, срочное — 7,7%, плановое — 46,2%.
Таблица
Показания к родоразрешению со стороны матери и плода, n (%)
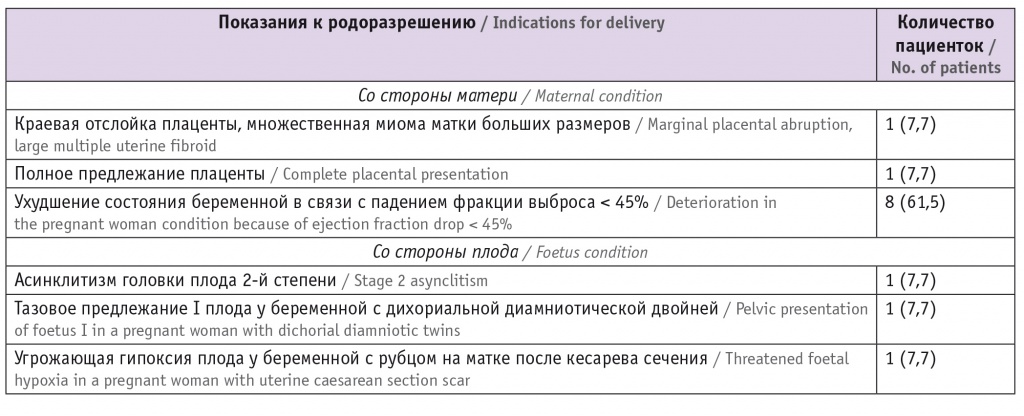
При оценке состояния плода у пациенток с ПКМП обращало на себя внимание наличие синдрома задержки развития плода и нарушения маточно-плацентарного кровотока (по 2 случая).
В 46,2% случаев оценка по шкале Апгар составила 8/9 баллов, 46,2% — 7/8 баллов, 7,7% — 6/7 баллов (у пациентки Б. вследствие преждевременного родоразрешения на сроке беременности 26 недель).
ОБСУЖДЕНИЕ
ПКМП является редкой патологией, и за последние 5 лет в отечественной литературе были опубликованы лишь отдельные клинические случаи. Оценка факторов риска ПКМП как во время беременности, так и после родов проведена в масштабном южнокорейском исследовании[9], в котором с использованием Национальной базы данных службы надзора и оценки медицинского страхования Южной Кореи были проанализированы 1 384 449 родов и обнаружены 795 случаев ПКМП.
Факторы риска включали:
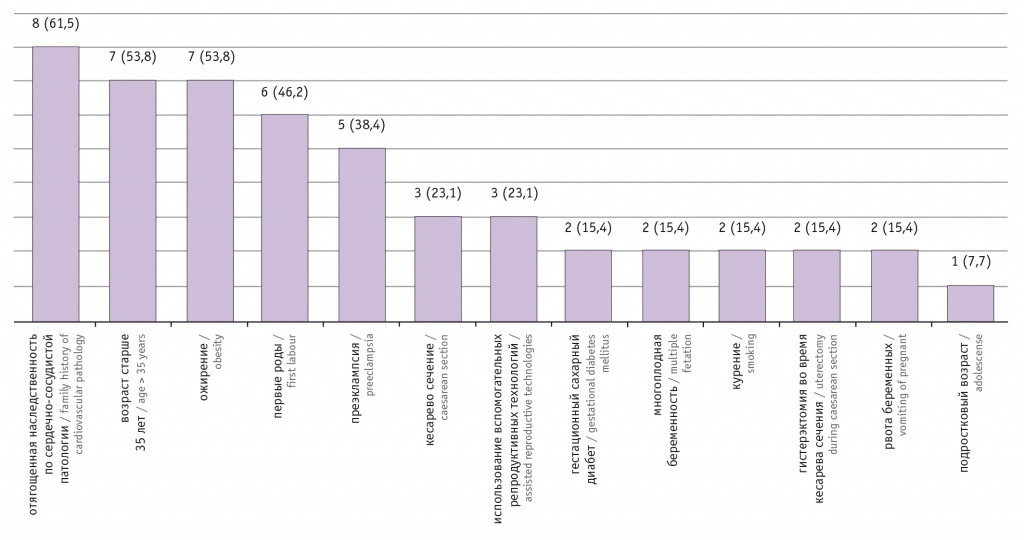
- возраст старше 35 лет (во время беременности ОР = 2,03, после родов ОР = 1,38), что согласуется с данными нашего исследования, т. к. 53,8% наших пациенток были старшего возраста (рис. 2);
- многоплодную беременность (во время беременности ОР = 3,85, после родов ОР = 1,75, в нашем исследовании — 15,4%);
- гестационный СД (во время беременности ОР = 1,63, после родов ОР = 1,92, по результатам нашего исследования — 15,4%);
- первые роды (во время беременности ОР = 1,14, после родов ОР = 1,29, в нашем исследовании — 46,2%).
Рис. 2. Факторы риска развития перипартальной кардиомиопатии у 13 пациенток из группы ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Минздрава России, n (%)
Несмотря на большой вклад родоразрешения путем кесарева сечения как фактора риска ПКМП в южнокорейском исследовании, а также на выбор данного способа родоразрешения в 100% случаев в нашей группе, у большинства наших пациенток ПКМП развилась на дородовом этапе (n = 10; 76,9%); таким образом, кесарево сечение можно считать фактором риска ПКМП лишь в 23,1% случаев, когда оно было выполнено по акушерским показаниям и клинические проявления ПКМП развились на 1–3-и сутки послеродового периода.
Фактором риска ПКМП считалась и гистерэктомия во время кесарева сечения (ОР = 8,23), что согласуется с данными нашего исследования, т .к. эта операция была выполнена у двух пациенток с клиническими проявлениями ПКМП в послеродовом периоде. Авторы южнокорейского исследования также определили как факторы риска отслойку плаценты и полное предлежание плаценты (ОР = 0,8), в нашей работе их было по одному случаю.
Кроме того, факторами риска исследователи сочли оперативное влагалищное родоразрешение (ОР = 1,49), индукцию родов (ОР = 0,98) и эмболизацию маточных артерий (ОР = 5,57), однако мы их охарактеризовать не можем, поскольку все наши пациентки были родоразрешены оперативным путем без использования рентгеноэндоваскулярных технологий.
Важным фактором риска, по результатам нашего исследования, является ожирение, выявленное у 53,8% женщин.
Кроме того, у 46,2% пациенток имелись частые ангины в анамнезе, и 46,2% пациенток перенесли ОРВИ в настоящую беременность, что следует учесть акушеру-гинекологу и кардиологу, к которому обращаются беременные, особенно с жалобами на симптомы сердечной недостаточности, для более тщательного проведения дифференциального диагноза.
По данным литературы, курение становится немаловажным фактором риска развития ПКМП[4, 10], и в нашей работе курение в анамнезе обнаружилось в 15,4% случаев.
Обращает на себя внимание также отягощенная наследственность по сердечно-сосудистой патологии у 61,5% участниц, что может говорить о наследственной предрасположенности к кардиальным заболеваниям.
Согласно южнокорейскому исследованию, одним из самых значимых факторов риска была преэклампсия, ОР которой во время беременности составил 8,88, после родов — 5,05, что коррелирует с данными нашего исследования, в котором преэклампсия имела место в 38,4% случаев. Преэклампсия является абсолютно закономерным фактором риска ПКМП, поскольку она связана с ПКМП едиными звеньями патогенеза[11, 12].
Согласно «гипотезе двух ударов»[2, 13], ангиогенный дисбаланс, проявляющийся в циркуляции антиангиогенных факторов, составляет основу «первого удара». В условиях повышения оксидативного стресса в миокарде гормон пролактин[14, 15] усиленно расщепляется на низкомолекулярные антиангиогенные фрагменты, которые запускают экспрессию микро-РНК146а в эндотелиальных клетках, оказывая таким образом антиангиогенное и проапоптическое действие.
Кроме того, у пациенток с ПКМП имеется дефицит мощнейшего регулятора ангиогенеза PGC-1a (коактиватор-1α γ-рецептора, активирующего пролиферацию пероксисом), вследствие чего клетки миокарда становятся чувствительнее прочих клеток к sFlt (растворимой FMS-подобной тирозинкиназе) и другим антиангиогенным субстанциям.
Важно упомянуть, что в «первый удар» значительный вклад вносят преэклампсия и многоплодная беременность. «Второй удар» — это неспособность миокарда, причина которой пока еще не установлена, противостоять данному антиангиогенному воздействию[2, 13].
Очень важна медикаментозная профилактика преэклампсии, которая была проведена лишь у одной больной, несмотря на то что у 15,4% пациенток она была диагностирована в предыдущую беременность, а у 38,4% — в настоящую. Необходимость профилактики низкими дозами ацетилсалициловой кислоты обусловлена едиными аспектами патогенеза ПКМП и преэклампсии.
В основном ПКМП имела благоприятные исходы: у 53,8% пациенток на фоне проводимой терапии фракция выброса восстановилась до значений более 45% в течение 6 месяцев послеродового периода. У пациентки Б. с прогрессивным снижением фракции выброса и клиникой сердечной недостаточности потребовалось применение механической поддержки кровообращения с последующим выполнением операции ортотопической трансплантации сердца. Обращает на себя внимание тот факт, что у данной больной диагноз ПКМП уже был установлен в обе предыдущие беременности, с момента последней прошел всего один год, настоящая беременность наступила еще в подростковом возрасте и осложнилась развитием преэклампсии во II триместре. Это позволяет сделать вывод, что в условиях верной оценки факторов риска, своевременной диагностики и правильной тактики ведения у большинства пациенток ПКМП имеет благоприятный исход.
ЗАКЛЮЧЕНИЕ
Перипартальная кардиомиопатия (ПКМП) является редкой патологией с малоизученной этиологией и высоким риском материнской смертности. Анализируя клинические случаи 13 пациенток, поступивших с диагнозом ПКМП в ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, мы обнаружили значительное количество факторов риска развития ПКМП, однако отчетливые доказательства преимущественного влияния какого-то определенного фактора не выявили. Важным является вывод о взаимосвязи ПКМП с преэклампсией, которая прослеживается как в нашем исследовании, так и у наших иностранных коллег, что дает возможную платформу для дальнейшего изучения этого феномена.
Поступила: 16.03.2021
Принята к публикации: 30.04.2021








