Фетальная терапия и хирургия — современные направления акушерства, стремительно развивающиеся в последние десятилетия. Формирование научно-практического подхода к плоду как к пациенту обусловлено необходимостью устранения во время беременности патологических состояний, вызывающих значительные или необратимые нарушения, угрожающие жизни ребенка до его рождения. В таких случаях оптимально лечение во время беременности.
Родоначальником этого направления принято считать американца Альберта Лилея. В 1963 году под контролем рентгеновского исследования он успешно осуществил внутриутробное переливание донорской крови плоду, страдающему анемией[1]. Активное развитие медицины плода началось в 1980-е годы благодаря стремительным успехам пренатальной диагностики. Применение современных методов эхографии, МРТ и генетических исследований позволяет диагностировать внутриутробную патологию, а также способствует пониманию ее патогенеза.
Для выполнения внутриутробных вмешательств Международным обществом фетальной медицины и хирургии разработаны следующие критерии:
- наличие точного диагноза и прогноза;
- отсутствие эффективных методов лечения заболевания после рождения;
- экспериментальные данные об эффективности и безопасности вмешательства.
Вмешательство может быть этиотропным либо паллиативным, направленным на устранение состояний, угрожающих жизни плода, при этом основное лечение откладывается до момента рождения.
Лечебные воздействия во время беременности можно разделить на медикаментозные и хирургические.
Терапия некоторых патологических состояний плода, таких как внутриутробная инфекция и нарушение ритма сердца, может быть медикаментозной. Лекарственные препараты могут попадать к плоду от матери через плаценту или вводиться непосредственно в амниотическую жидкость, внутримышечно или в вену пуповины. Нарушение ритма сердца плода — серьезная патология, которая приводит к кардиальной недостаточности и внутриутробной гибели. Медикаментозное лечение указанных состояний позволяет не только сохранить беременность, но и предотвратить возникновение тяжелых нарушений гемодинамики плода[2].
Для устранения ряда патологических состояний может потребоваться хирургическое вмешательство. В фетальной хирургии используют три основные технологии доступа: пункционные процедуры под контролем эхографии, малоинвазивные эндоскопические (фетоскопические) вмешательства и открытые операции (лапаротомию, гистеротомию).
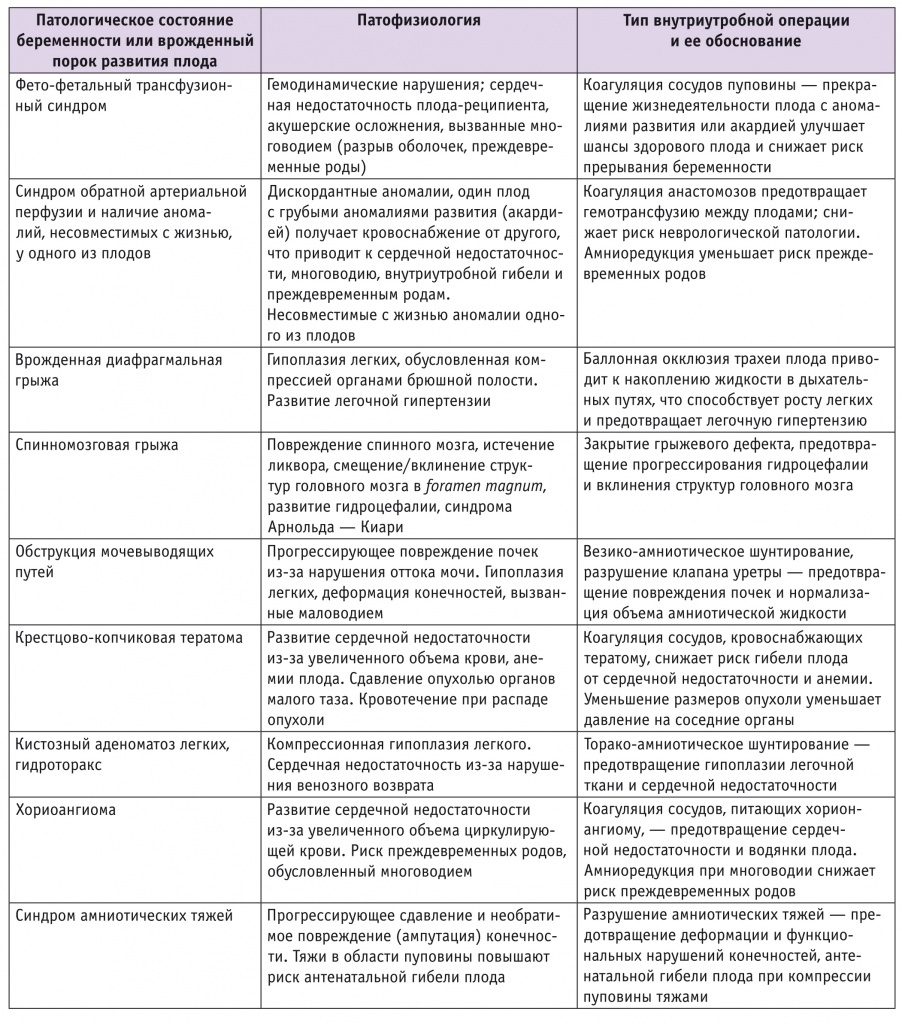
В таблице представлен перечень патологических состояний, при которых выполняются внутриутробные операции.
Таблица
Показания для внутриутробной хирургии плода
Более подробно в данной статье представлен опыт Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени академика В.И. Кулакова в проведении внутриутробных хирургических вмешательств.
ФЕТАЛЬНАЯ ХИРУРГИЯ ПРИ ОСЛОЖНЕНИЯХ МОНОХОРИАЛЬНОЙ МНОГОПЛОДНОЙ БЕРЕМЕННОСТИ
Монохориальная многоплодная беременность сопровождается высокой частотой неблагоприятных исходов из-за развития специфических осложнений, таких как фето-фетальный трансфузионный синдром (ФФТС), синдром обратной артериальной перфузии (СОАП), синдром анемии-полицитемии и синдром селективной задержки роста одного из плодов (ССЗРП)[3]. Некоторые из этих осложнений требуют внутриутробной коррекции.
ФФТС осложняет 10–15% монохориальных беременностей[4]. Данное патологическое состояние вызвано трансфузией крови между близнецами через несбалансированные артерио-венозные анастомозы общей плаценты. У плода-донора развиваются гиповолемия, олигурия, формируется маловодие, у плода-реципиента — гиперволемия, полиурия и многоводие. У последнего также под действием перегрузки объемом циркулирующей крови возникают кардиомиопатия, кардиомегалия, которые приводят к развитию сердечной недостаточности[5].
Пренатальная диагностика ФФТС не представляет сложностей и заключается в обнаружении маловодия у одного плода (максимальный вертикальный карман (МВК) околоплодных вод менее 2 см) и многоводия у другого (МВК более 8 см). Большинство случаев диагностируют между 16-й и 26-й неделями беременности. В настоящее время степень тяжести ФФТС оценивают по классификации, предложенной Рубеном Квинтеро[6], который описал прогрессирование патологических изменений, начиная с разницы в количестве амниотической жидкости, отсутствия наполнения мочевого пузыря у донора, нарушения фето-плацентарного кровотока и до отека плода-реципиента и гибели одного или обоих плодов.
ФФТС требует внутриутробной коррекции сразу после диагностики, так как при отсутствии лечения частота неблагоприятных исходов достигает 90%. В последние 20 лет во всем мире успешно выполняется внутриутробное лечение ФФТС; основные его методы:
- амниоредукция;
- селективный фетоцид;
- лазерная коагуляция сосудистых анастомозов плаценты.
Выбор тактики зависит от оснащенности медицинского учреждения, опыта персонала, срока гестации, стадии ФФТС, расположения плаценты.
Амниоредукция заключается в удалении избыточного количества околоплодных вод плода-реципиента и направлена в первую очередь на сохранение беременности. Может потребоваться многократное применение данной процедуры, так как причина развития ФФТС не устраняется.
Селективный фетоцид выполняют при III и IV стадиях ФФТС, в случае сочетания с ССЗРП, а также при врожденных аномалиях развития одного из плодов. Процедура заключается в коагуляции сосудов пуповины одного плода, может проводиться пункционным и фетоскопическими доступами.
Патогенетически обоснованным методом лечения ФФТС служит коагуляция плацентарных анастомозов, которая позволяет сделать плаценту «дихориальной». Операцию проводят начиная со II стадии, в сроке 16–26 недель беременности. Фетоскопическую лазерную коагуляцию выполняют трансабдоминально под внутривенной, местной или региональной анестезией. Троакар диаметром 2,3–3,3 мм под эхографическим контролем вводят в амниотическую полость плода-реципиента, затем вводят фетоскоп с проводником лазерной энергии (рис. 1). Коагуляцию осуществляют бесконтактно, процедуру завершают амниоредукцией до достижения нормального количества околоплодных вод (рис. 2). Эффективность проведенного лечения составляет 60–90%.
Рис. 1. Выполнение фетоскопии при фето-фетальном трансфузионном синдроме. Здесь и далее в статье иллюстрации авторов
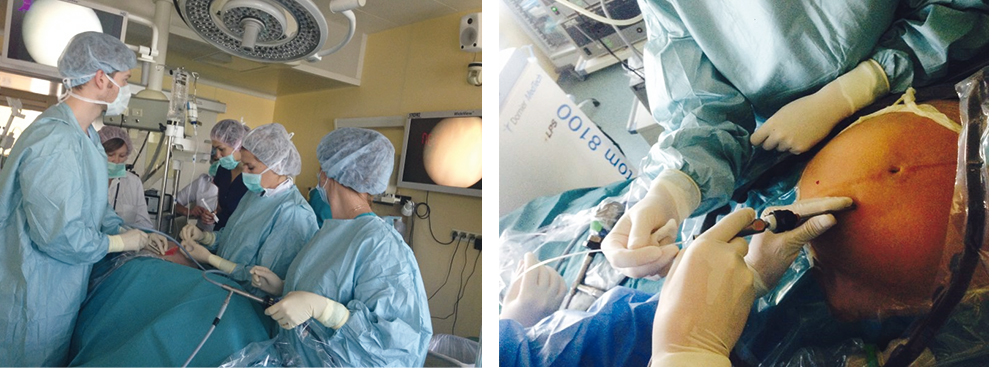
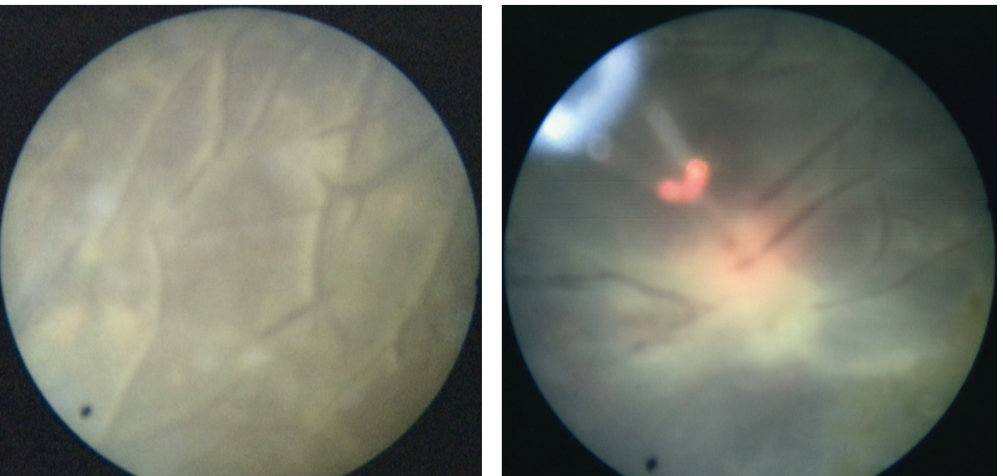
Рис. 2.Фетоскопия, лазерная коагуляция анастомозов плаценты
На базе ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» внутриутробное лечение ФФТС выполняется с 2009 года. В 147 случаях проведена фетоскопическая лазерная коагуляция анастомозов плаценты и в 54 случаях — серийные амниоредукции.
Согласно опубликованным данным и результатам нашего исследования, перинатальные исходы при лазерной коагуляции анастомозов значительно лучше, чем при амниоредукции[7, 8]. Средний срок родоразрешения после лазерной коагуляции составил 32,4 недели, в то время как после амниоредукции — 29,7 недели. Средняя выживаемость после лазерной коагуляции выше (78,3% против 61,4%); частота благоприятного исхода для обоих плодов составила 69,4%, только для одного плода — 88,9%. Необходимо отметить, что исход оперативного лечения ФФТС напрямую зависит от опыта врача, в связи с чем целесообразно оказывать данный вид помощи в специализированных клинических центрах.
СОАП — уникальное осложнение монохориальной многоплодной беременности, встречающееся в 1 случае на 35 тыс. родов[9]. Характеризуется наличием грубых пороков развития и отсутствием функционирующего сердца у одного плода (плод-акардиакус, или акардиальный плод), при этом его кровоснабжение обеспечивается за счет второго плода (плода-помпы). Неблагоприятный исход беременности, осложненной СОАП, наблюдается в 60–85% случаев[10]. Осложнения беременности при СОАП вызваны ростом плода с акардией вследствие его чрезмерного кровоснабжения плодом-помпой. Прогрессивно нарастающий объем крови в «общей» системе циркуляции приводит к развитию кардиомиопатии, сердечной недостаточности и в финале — к внутриутробной гибели плода-помпы. В свою очередь многоводие, возникающее из-за полиурии, приводит к преждевременному излитию околоплодных вод и преждевременным родам.
С целью улучшения перинатальных исходов беременности, осложненной СОАП, предпринимаются различные внутриутробные вмешательства, направленные на прекращение поступления крови к плоду с акардией.
На базе Центра проведено исследование эффективности внутриутробного лечения СОАП. Проанализированы 47 беременностей, осложненных данным синдромом[11]. Внутриутробное вмешательство было выполнено 28 беременным, 22 из них производилась интерстициальная лазерная коагуляция сосудов пуповины плода с акардией под контролем эхографии. Операция выполнялась под местным обезболиванием. Иглой 18G делали пункцию передней брюшной стенки, стенки матки и туловища плода с акардией. В режиме цветового доплеровского картирования (ЦДК) под контролем ультразвуковой навигации конец иглы подводился к месту вхождения пуповины в туловище акардиального плода, мандрен извлекался, в просвет иглы вводился 0,7 мм световод Nd: YAG лазерной установки (Dornier Medilas Fibertom 8100, Dornier MedTech, Германия). Проводилось несколько сессий коагуляции в режиме непрерывной волны с мощностью 50 Вт до прекращения регистрации кровотока в сосудах пуповины по данным ЦДК. В 6 случаях монохориальной моноамниотической многоплодной беременности осуществлялись лазерная коагуляция и пересечение пуповины акардиального плода под контролем фетоскопии.
Благоприятный исход беременности, осложненной СОАП, при выполненном внутриутробном лечении наблюдался в 78,6% (22 из 28) случаев, что статистически значимо чаще, чем у пациенток, которым внутриутробное лечение не проводилось, — 47,1% (8 из 17) (р = 0,0023). Частота преждевременных родов в этих двух группах также различалась и была выше при консервативном ведении — 16,7% против 4,5% соответственно. Таким образом, своевременная внутриутробная хирургическая коррекция СОАП способствует значительному снижению перинатальных потерь.
ФЕТАЛЬНАЯ ХИРУРГИЯ ПРИ ВРОЖДЕННЫХ ПОРОКАХ РАЗВИТИЯ ПЛОДА
В отличие от внутриутробного лечения осложнений монохориальной многоплодной беременности, успешно выполняющегося в ведущих национальных медицинских центрах, фетальные хирургические вмешательства по поводу врожденных пороков развития плода проводятся нечасто, и каждый из случаев уникален. Ниже представлены результаты оперативных вмешательств при некоторых врожденных аномалиях развития плода и редких осложнениях беременности, выполненных на базе Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова.
Врожденная кистозно-аденоматозная мальформация легкого
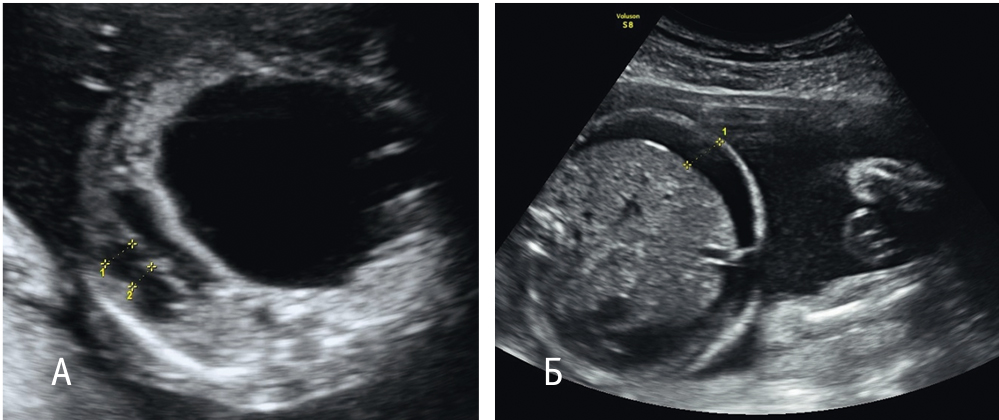
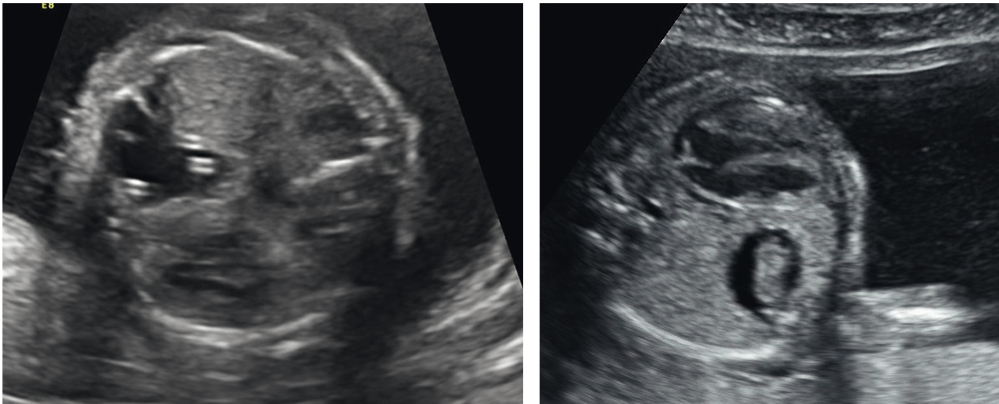
Порок развития терминальных бронхиол и легочной ткани возникает из-за диспластического процесса терминальных бронхиол и приводит к уменьшению количества альвеол. Если процесс захватывает достаточно обширное пространство, могут развиться гипоплазия легочной ткани и смещение средостения, что, в свою очередь, служит причиной водянки плода и многоводия (рис. 3).
Рис. 3. Кистозно-аденоматозная мальформация легкого: А — киста больших размеров, сдавливающая и смещающая средостение; Б — асцит
Хирургическое вмешательство заключается в уменьшении объема кистозной полости — ее можно пунктировать или выполнить торако-амниотическое шунтирование (рис. 4).
Рис. 4. Торако-амниотическое шунтирование при кистозно-аденоматозной мальформации легкого
Опубликованы также данные об эффективности применения стероидов при водянке плода, обусловленной кистозным аденоматозом[12]. Отмечался регресс водянки плода после курса терапии бетаметазоном, эффективность медикаментозного лечения необходимо установить до принятия решения об оперативном вмешательстве[13].
Менингомиелоцеле (Spina bifida), синдром Арнольда — Киари
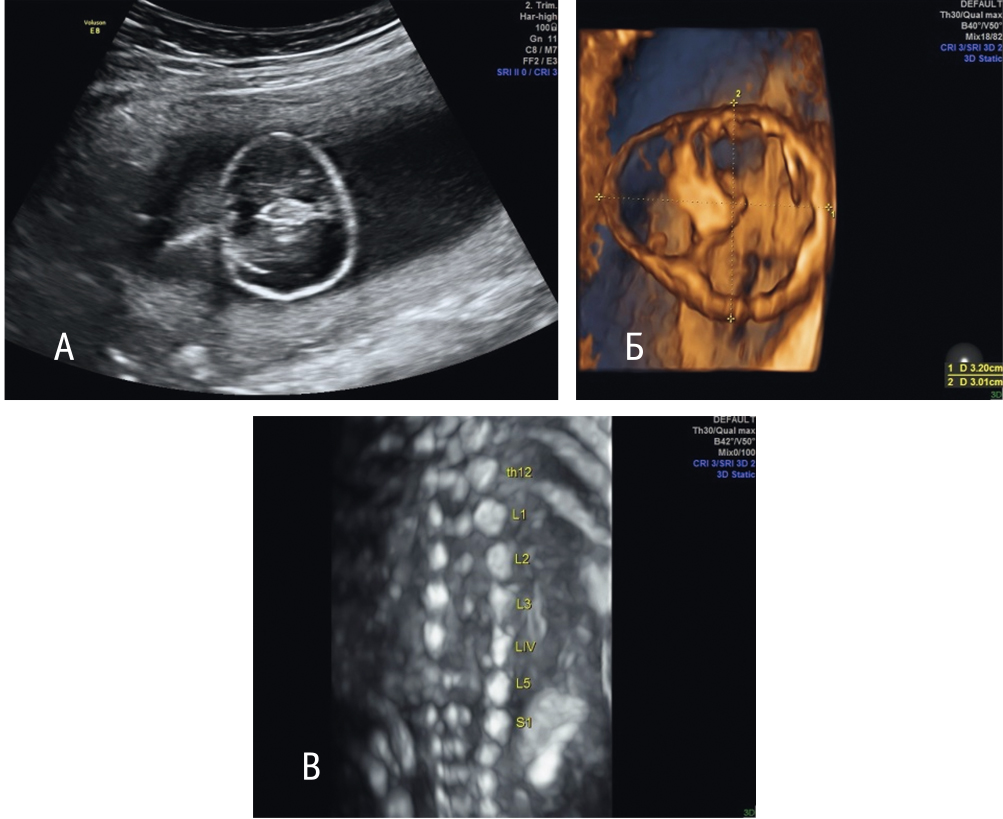
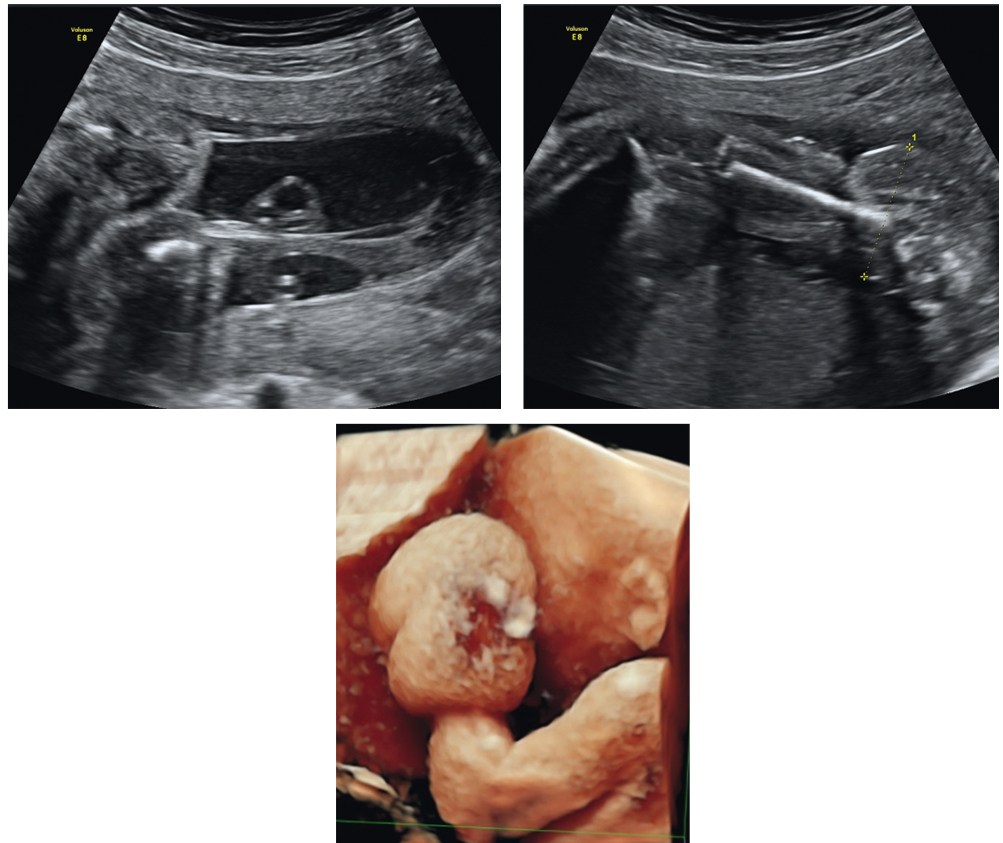
Менингомиелоцеле (Spina bifida) — врожденная аномалия развития спинного мозга плода, проявляющаяся нарушением закрытия спинномозгового канала. В результате формируется дефект (спинномозговая грыжа), сопровождающийся повреждением нервных корешков спинного мозга (рис. 5).
Рис. 5. Менингомиелоцеле: А — режим 2D; Б — режим 3D, поверхностная реконструкция; В — режим 3D, реконструкция скелета
При этом нарушается иннервация органов и конечностей, расположенных ниже уровня дефекта, что может проявляться слабостью и параличом ног, дисфункцией мочевого пузыря и кишечника. Кроме того, возникает повреждение головного мозга — аномалия Арнольда — Киари II типа, которая достаточно часто требует установки шунта в полости желудочков головного мозга для создания оттока спинномозговой жидкости и предотвращения прогрессирования гидроцефалии.
Пренатальное лечение заключается в хирургической коррекции дефекта спинномозгового канала, которая выполняется при помощи открытой фетальной хирургии, чревосечения, гистеротомии, ушивания дефекта спинномозгового канала плода. Хирургическая коррекция миеломенингоцеле у плода аналогична по технике вмешательству, производимому после рождения.
Основные преимущества внутриутробного лечения по сравнению с постнатальным — предотвращение дальнейшего воздействия амниотической жидкости на спинной мозг плода, устранение вклинения основания головного мозга и уменьшение вентрикуломегалии. Кроме того, внутриутробная коррекция миеломенингоцеле значимо снижает необходимость проведения вентрикулоперитонеального шунтирования ребенку, которое может стать причиной многих отдаленных осложнений.
К настоящему времени эффективность внутриматочного лечения Spina bifida изучена в рандомизированном исследовании MOMS (Management Of Myelomeningocele Study)[14]. Это исследование показало, что риск для беременной приемлем, несмотря на то что имеется вероятность разрыва матки, кровотечения и пареза кишечника. Преждевременные роды при сроке менее 30 недель происходят в 10–15% наблюдений, в некоторых случаях развивается маловодие. Ятрогенный риск внутриутробной гибели плода составляет 3–6%.
Специалистами НМИЦ АГП им. акад. В.И. Кулакова выполнена открытая хирургическая коррекция Spina bifida у плода пациентки Б., 28 лет. Во II триместре беременности при УЗИ выявлены миеломенингоцеле, синдром Арнольда — Киари II типа. В сроке беременности 22 недели 3 дня проведен трансабдоминальный амниоцентез — кариотип в норме. В 24 недели 3 дня произведены поперечное надлобковое чревосечение, утеротомия, внутриутробная коррекция менингомиелоцеле плода (рис. 6). Продолжительность операции составила 2 ч 23 мин. Послеоперационный период протекал без осложнений, проводились динамические УЗИ (рис. 7).
Рис. 6. Внутриутробная коррекция менингомиелоцеле: А — утеротомия; Б — ушивание миеломенингоцеле
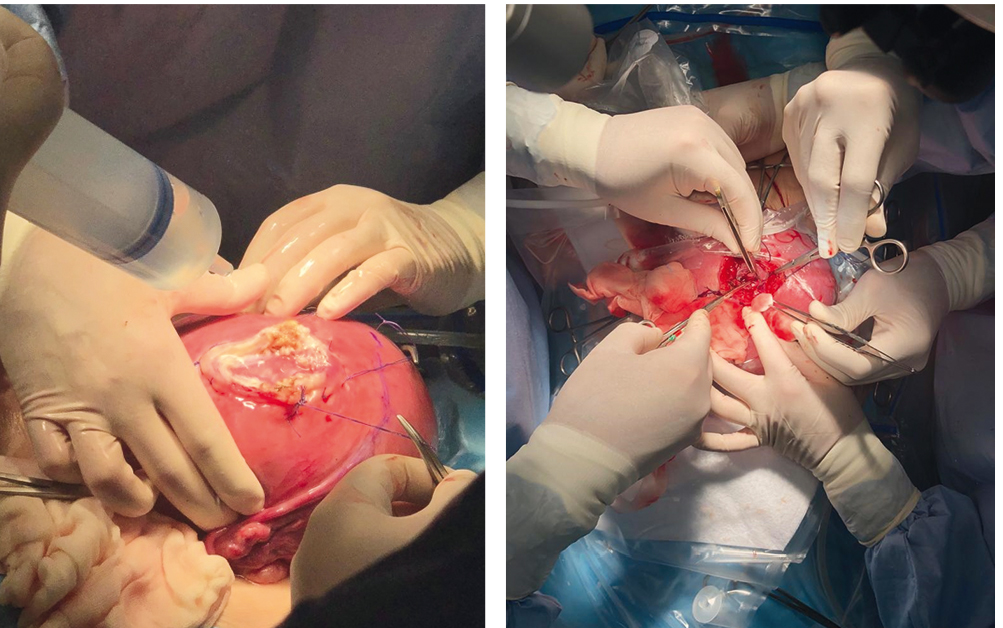
Рис. 7. Внутриутробная коррекция менингомиелоцеле — дефект ушит: А — режим 2D, Б — режим 3D, поверхностная реконструкция
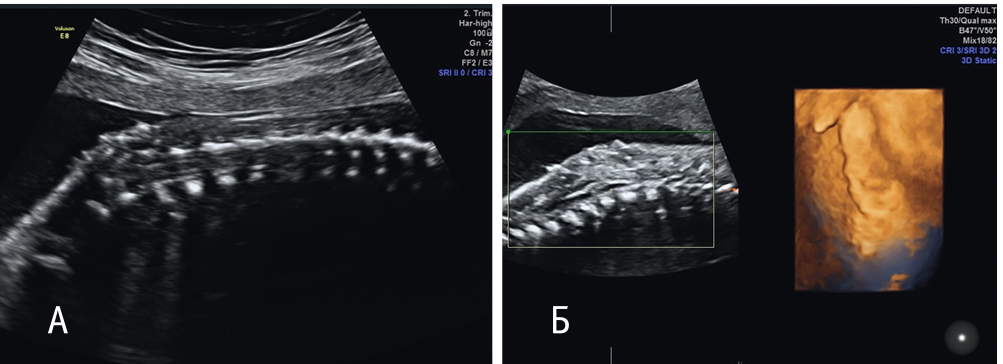
Через 10–11 недель после операции в сроке беременности 35 недель в связи с развитием регулярной родовой деятельности произведено кесарево сечение в экстренном порядке. Родилась живая недоношенная девочка массой 2270 г, длиной 47 см. Оценка по шкале Апгар — 8/9 баллов (рис. 8). Послеродовой период протекал без осложнений.
Рис. 8. Новорожденная, послеоперационный рубец без особенностей
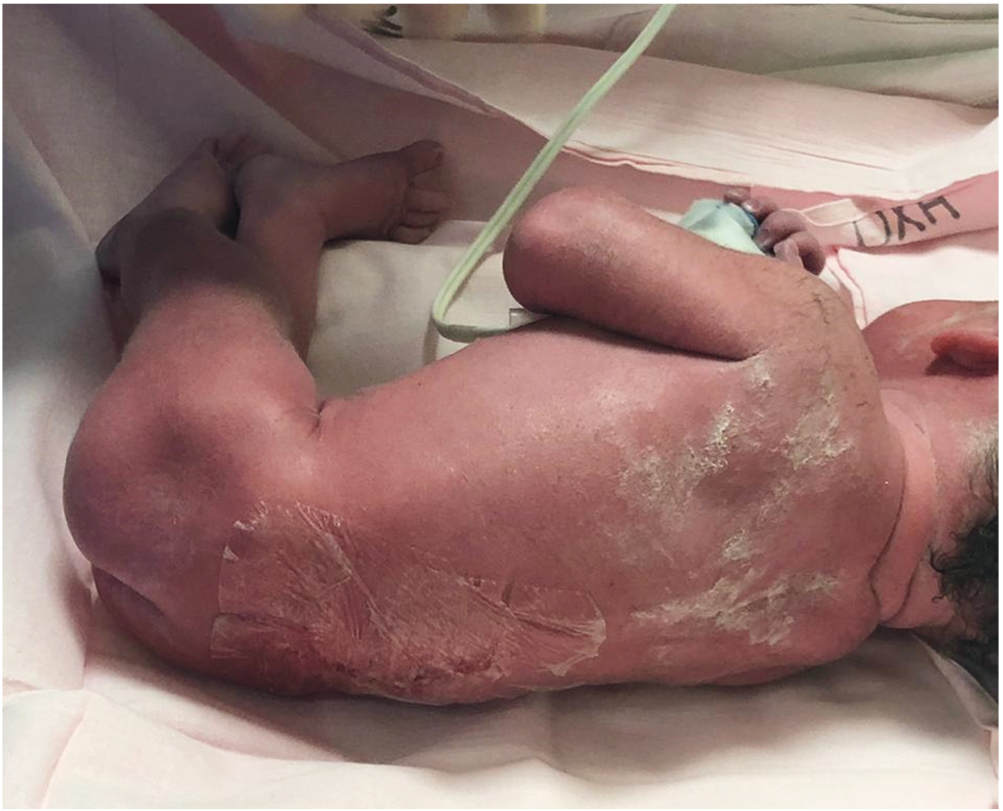
Ребенок наблюдался в отделении хирургии новорожденных с диагнозом: Врожденный порок развития спинного и головного мозга: Spina bifida поясничного отдела позвоночника (состояние после внутриутробной коррекции), асимметричная вентрикулодилатация D > S. Синдром двигательных нарушений: нижний парапарез, задержка формирования б/у рефлекторной деятельности со спинального уровня. Гемигипотрофия слева. Недоношенность 35 недель.
На 13-е сутки ребенок был выписан домой под наблюдение врача-педиатра и невролога.
Крестцово-копчиковая тератома
Крестцово-копчиковая тератома — наиболее часто встречающееся новообразование у новорожденных, при этом его легко диагностировать до родов. В большинстве случаев крестцово-копчиковая тератома не вызывает осложнений беременности, однако при ее значительных размерах и быстром росте у плода могут развиться анемия и тяжелая сердечная недостаточность, так как опухоль функционирует как большая артерио-венозная фистула. Наиболее распространенные последствия: многоводие, вызывающее преждевременные роды, водянка плода и внутриутробная гибель плода. У беременной может развиться зеркальный синдром.
Таким образом, в случае описанных выше осложнений может быть выполнено внутриутробное лечение, направленное на прекращение кровоснабжения опухоли. В нашем Центре методом выбора является интерстициальная лазерная коагуляция сосудов, питающих опухоль. Операция выполняется под непрерывным ультразвуковым контролем, методика та же, что и при коагуляции сосудов плода с акардией при СОАП. В случаях, когда данный вид вмешательства не может быть выполнен, оказывается паллиативная помощь: при многоводии — амниоредукция, при анемии у плода — гемотрансфузии.
В литературе приводятся единичные наблюдения применения малоинвазивной технологии с целью блокады кровотока в сосудах, питающих опухоль. Большинство клиницистов используют для этих целей лазер фетоскопическим доступом. Описано также применение термокоагуляции и радиочастотной аблации[15]. Альтернативой может стать эмболизация сосудов с использованием пункционного доступа, при этом возможно введение спирта [16], гистоакрила или спиралей для эмболизации[17]. Однако на сегодняшний день ни одна из процедур не является полностью безопасной.
Обструкция нижних отделов мочевыделительного тракта
Наиболее частой причиной низкой обструкции мочевыводящих путей бывает клапан задней уретры, возникающий в 1% всех беременностей у 1 : 8000–25 000 новорожденных[18]. Тонкая мембрана в задней уретре нарушает отток мочи из мочевого пузыря, это приводит к пузырно-мочеточниковому рефлюксу, дисфункции почек и в итоге — к почечной недостаточности (рис. 9).
Рис. 9. Увеличенный мочевой пузырь при клапане задней уретры
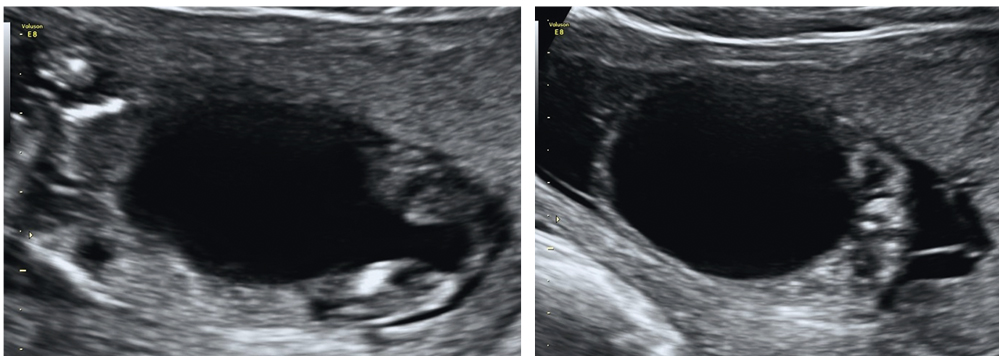
Цель внутриутробного лечения заключается в восстановлении оттока мочи из мочевого пузыря, сохранении функции почек, нормализации количества амниотической жидкости и предотвращении гипоплазии легких. Внутриутробное оперативное вмешательство может быть представлено серийными пункциями мочевого пузыря, шунтированием мочевого пузыря и лазерной аблацией клапана.
Пузырно-амниотическое шунтирование было впервые сделано в 1982 году[19]. Результаты данного вида лечения обобщены в метаанализе 16 исследований[20], показавшем, что выживаемость в отдаленные сроки составила 88%. В 75% исследований была информация о возможных осложнениях пузырно-амниотического шунтирования. В 2% случаев попытка дренирования мочевого пузыря не была успешной. При 28 из 206 успешных операций возникли осложнения, наиболее грозные из них — гибель плода, хориоамнионит, фистулы и ятрогенный гастрошизис. Редко возникала дислокация шунта мочевого пузыря, что приводило к развитию асцита. Тем не менее эффективность операций была высокой — нормальная функция почек наблюдалась у 73% выживших.
Следующий метод внутриутробной хирургической коррекции обструкции нижних отделов мочевыводящих путей — лазерная аблация клапана задней уретры фетоскопическим доступом (рис. 10).
Рис. 10. Фетоскопия, лазерная аблация клапана уретры
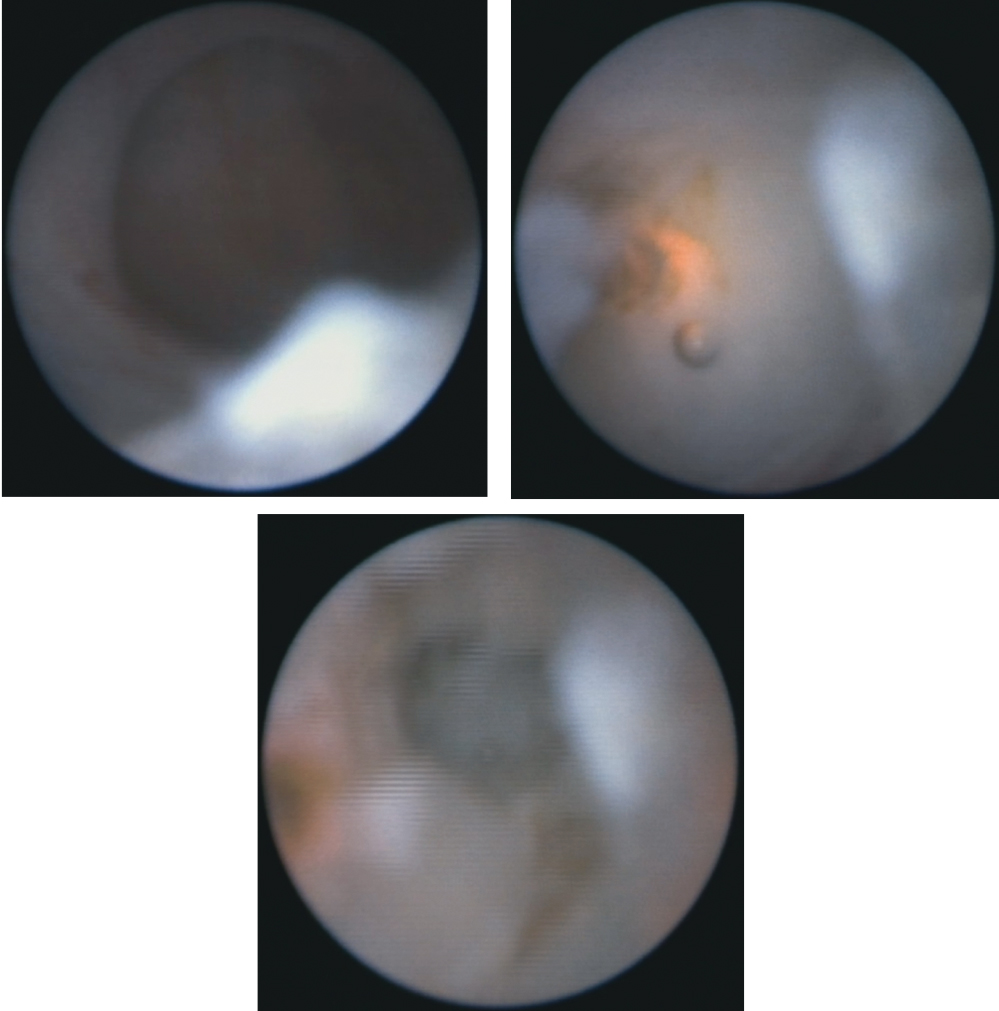
Фетоскопическая лазерная аблация клапана позволяет напрямую визуализировать место обструкции. Эта операция не требует постановки цистостомы и минимизирует такие осложнения, как окклюзия шунта, его смещение, асцит и гастрошизис. Однако возможны кровоизлияния в предстательную железу и повреждения сфинктера. Основными ограничениями данной операции являются определение группы пациентов, у которых она будет эффективной, и недостаточно подготовленная техническая база[21].
Не менее важны отдаленные результаты. В течение в среднем 5,8 года после операции из 20 мальчиков, перенесших внутриутробную операцию пузырно-амниотического шунтирования, у 45% отмечена нормальная функция почек, у 22% — умеренная дисфункция, 33% потребовались диализ и пересадка почек[22].
Оптимальный метод ведения пациентов с обструкцией нижних отделов мочевыводящих путей (хирургия разных видов или консервативное лечение) на сегодняшний день не найден. В любом случае родители должны быть предупреждены, что хирургия дает лишь временный эффект, ее цель — поддержание адекватного объема околоплодных вод. При этом проблема радикально не устраняется.
СИНДРОМ АМНИОТИЧЕСКИХ ТЯЖЕЙ
Синдром амниотических тяжей объединяет комплекс врожденных аномалий плода, варьирующих от небольших констрикционных кольцевых перетяжек и лимфатического отека конечностей до сочетанных множественных пороков развития, вызванных многочисленными тяжами, окутывающими различные отделы тела плода, приводщими нередко к нарушению их анатомической структуры (рис. 11).
Рис. 11. Амниотические тяжи. Режимы 2D и 3D
Данный синдром не относится к наследственным и возникает спорадически, частота встречаемости составляет 1 случай на 15 тыс. родов[23]. Осложнения, возникающие при синдроме амниотических тяжей, зависят от их локализации и степени вовлечения той или иной анатомической структуры плода, а в случае сдавления пуповины могут привести к антенатальной гибели.
В условиях развития фетальной хирургии появилась возможность рассечения перетяжек под контролем фетоскопии (рис. 12).
Рис. 12. Фетоскопия: рассечение амниотических тяжей
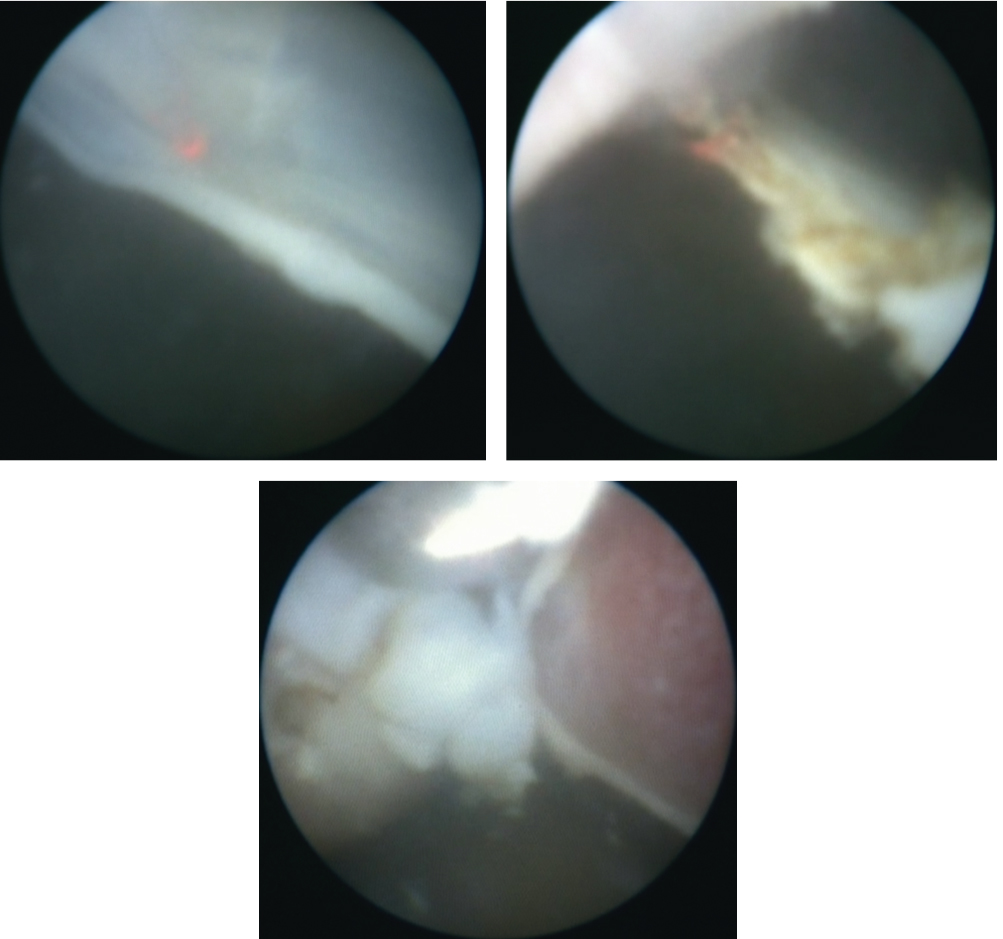
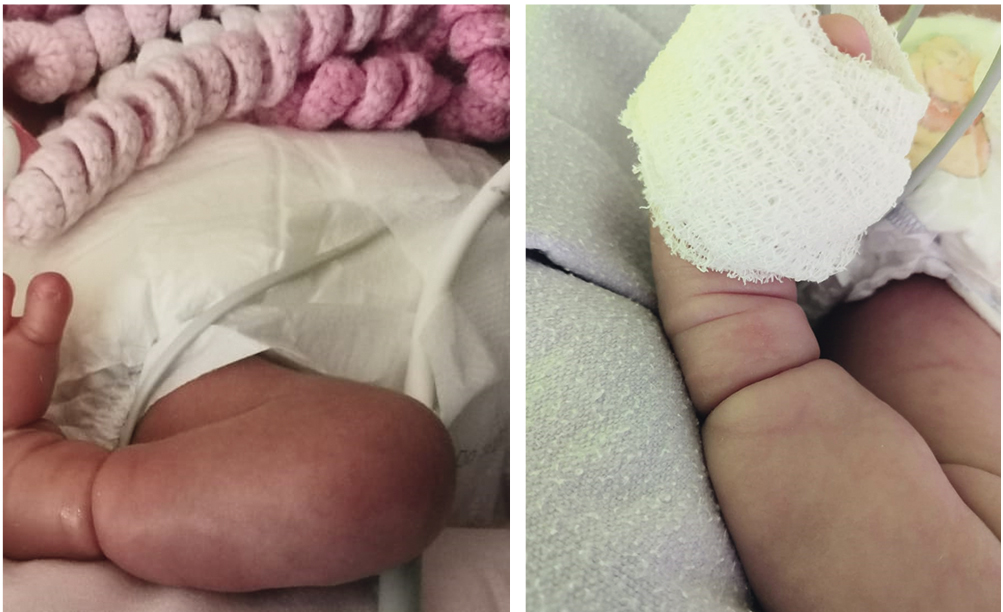
Успешное рассечение тяжей позволяет сохранить вовлеченную конечность (рис. 13).
Рис. 13. Странгуляционная борозда на конечности
ЗАКЛЮЧЕНИЕ
В ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России ежедневно проводятся телемедицинские консультации с региональными учреждениями России по вопросам оказания медицинской помощи беременным с вышеперечисленными состояниями, подлежащими хирургической коррекции на антенатальном этапе. Телемедицинские консультации позволяют в режиме on-line провести демонстрацию УЗИ, обсудить тактику ведения беременности, возможность и целесообразность проведения фетальных хирургических вмешательств. При транспортабельности беременной и наличии условий для проведения операции осуществляется вызов в Центр для госпитализации и выполнения фетального хирургического вмешательства.
В Центре еженедельно проводится перинатальный консилиум, в работе которого участвуют акушеры-гинекологи, неонатологи, неонатальные хирурги, врачи функциональной диагностики, медицинские генетики, перинатальные кардиологи. Совместное рассмотрение клинических ситуаций позволяет выработать рациональную тактику ведения беременности, принять коллегиальное решение и, что не менее важно, информировать беременную и ее семью о возможных осложнениях и исходах беременности, прогнозе для будущего ребенка.
Ежегодно в Центре проводятся более 100 пункционных процедур под УЗ-контролем — амниоредукций, трансфузий эритроцитной массы, обедненной лейкоцитами и тромбоцитами, фетальных лапароцентезов, пункций плевральной полости и кистозных образований. В 2018 году произведено более 40 оперативных вмешательств при осложнениях монохориальной многоплодной беременности, проведена внутриутробная коррекция менингомиелоцеле открытым доступом.
Фетальные вмешательства можно разделить на этиотропные, к которым относятся операции при осложнениях монохориальной многоплодной беременности, патологии плаценты, пуповины и оболочек, и паллиативные — при аномалиях развития плода, когда вмешательство не устраняет причину, а лишь позволяет предотвратить развитие необратимых нарушений. Как непосредственные, так и отдаленные результаты последних требуют дальнейшего изучения.
Фетальная хирургия быстро развивается, современные методы внутриутробной коррекции способны изменить естественное течение заболевания. Аномалии развития плода, подлежащие антенатальному хирургическому лечению, как правило, относятся к летальным либо сопровождаются высокой заболеваемостью и инвалидизацией ребенка. Редкость данных состояний объясняет немногочисленность публикаций по их лечению, в связи с чем провести статистически точную оценку эффективности и безопасности не представляется возможным.
Нерешенными проблемами остаются определение оптимальных сроков вмешательства, показаний и невозможность проведения мультицентровых рандомизированных клинических исследований. Стадии отработки технических этапов операций пройдены, большинство вмешательств внедрены в клиническую практику. Лимитирующими факторами для повсеместного внедрения внутриутробных операций остаются сложность и возможные осложнения. Сегодня хирургия плода — уже реальность, но требует дальнейшего развития, современных исследований, продолжения изучения эффективности и безопасности предлагаемых вмешательств.








