ВВЕДЕНИЕ
На протяжении последних 15–20 лет отмечается рост частоты кесарева сечения (КС) в 3–4 раза[1]. В России число младенцев, рожденных путем КС, колеблется в пределах 10–45%[2]. Расширение показаний к оперативному родоразрешению со стороны плода привело к снижению перинатальной смертности более чем вдвое — с 16% до 7,1%[3].
Внедрение в практику программы ускоренного восстановления (ПУВ) после абдоминального родоразрешения призвано минимизировать стрессовую реакцию организма матери на хирургическую травму. Ранее нами было показано, что абдоминальное родоразрешение, как при традиционной тактике ведения периоперационного периода у родильниц, так и с применением ПУВ, сопровождается окислительным стрессом, активацией перекисного окисления липидов (ПОЛ) и белков в результате дисбаланса ПОЛ и антиокислительной системы в плазме крови и мембранах эритроцитов[4].
Объективным прогностическим методом оценки метаболического здоровья новорожденного является изучение состояния окислительно-оксидантной системы пуповинной крови. В литературе крайне мало сведений об особенностях окислительно-антиоксидантной системы у новорожденных при абдоминальном родоразрешении. Дисбаланс данной системы, в основе которого лежит нарушение целостности клеточных мембран с активацией ряда внутриклеточных сигнальных путей (NF-kB, p53, MAPK), может приводить к системным нарушениям, снижению адаптационного потенциала у новорожденных при абдоминальном родоразрешении[5].
В связи с этим важной представляется цель нашего исследования: сравнительный анализ окислительно-антиоксидантного статуса и окисляемости белков у новорожденных после КС при использовании у родильниц программы ускоренного выздоровления и при их традиционном ведении в периоперационном периоде.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в ГБУ «Республиканская клиническая больница» (перинатальный центр) города Махачкалы в 2019–2020 гг.
В исследование вошли доношенные новорожденные массой от 3000 до 3900 г (средняя масса — 3400 ± 100 г), извлеченные с помощью КС по следующим показаниям: 1) рубец на матке после двух и более операций КС; 2) поперечное положение плода; 3) патология костей таза у матери (анатомически узкий таз 3–4-й степени сужения). Средний возраст родильниц составлял 30 ± 2 года (от 22 до 38 лет).
В исследование не включались доношенные новорожденные, извлеченные путем КС, при наличии соматических и акушерских осложнений: 1) преэклампсии любой степени тяжести; 2) СД; 3) ожирения. Из исследования исключались новорожденные с макросомией, гипоксией и гипотрофией любой степени, недоношенные, рожденные при многоплодной беременности.
Выделены две группы новорожденных: I-я группа (контрольная, n = 38) включала младенцев, рожденных путем КС при традиционном ведении периоперационного периода, когда антибиотикотерапия родильницы проводилась интраоперационно после пережатия пуповины и предоперационное голодание длилось более 8 часов; II-я группа (сравнения, n = 43) включала детей, рожденных с помощью КС при ведении периоперационного периода у родильниц по ПУВ[6] с употреблением углеводного напитка за 2 часа до операции и введением антибиотика (цефазолина 2 г) за 30 минут до операции.
Забор пуповинной крови проводили в первые минуты после извлечения плода. Всего получен 81 образец исследуемого материала (пуповинной крови).
В работе использованы биохимические методы исследования. Кровь для анализа у всех новорожденных забиралась из вен пуповины в центрифужные пробирки с гепарином. Кровь центрифугировали при 1500 об./мин в течение 5 мин на центрифуге Eppendorf 5702R. Плазму отбирали для дальнейшего анализа. Осадок эритроцитов ресуспендировали в 10,0 мл охлажденного 0,9%-ного раствора NaCl или забуференного (0,01 М трис-HCl буфер, рН = 7,4) 0,9%-ного раствора NaCl, затем клетки осаждали путем центрифугирования при 2000 об./мин в течение 5 мин. В последующем эритроциты трижды промывали 0,9%-ным раствором NaCl. Забор ткани и приготовление образцов для экстрагирования проводили при температуре 4°С.
Плотный осадок эритроцитов использовали для выделения мембран эритроцитов. Белые тени эритроцитов получали по методу А.Н. Кленовой, содержание малонового диальдегида определяли методом Л.И. Андреевой и соавт.[7]. В плазме крови и мембранах эритроцитов измеряли концентрации гидроперекисей липидов (ГЛ) методом B. Mihaljević и соавт.[8], SH-групп — методом A.F.S.A. Habeeb[9], карбонильных групп в качестве маркера окислительной модификации белков — методом A.Z. Reznick и L. Packer[10], витамина Е — методом S.L.Tailor и соавт.[11].
Статистический анализ данных, полученных в ходе исследования, включал проверку на статистическую значимость отклонения рядов показателей от нормального закона распределения с помощью критерия Шапиро — Уилка, методы описательной статистики, расчет центральных тенденций и вариабельности числовых показателей, а также проверку статистической значимости различий средних значений с помощью t-критерия Стьюдента для независимых выборок.
Последний был использован, поскольку отклонение всех выборочных распределений исследуемых показателей от нормального закона было статистически незначимо, так же, как и различие дисперсии одноименных переменных в сравниваемых группах.
Гипотеза о равенстве дисперсий проверялась с помощью теста Фишера. В двух случаях статистически значимого различия дисперсий перед использованием критерия Стьюдента применялся расчет общей дисперсии по формуле, принятой в таких случаях. Уровень значимости принятия гипотезы о достоверности различия средних α принят равным 0,05.
Статистический анализ данных проводился с помощью программного пакета Statistica. Результаты статистической обработки данных представлены в формате среднего значения (стандартного отклонения) — М (SD).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследования влияния процедуры подготовки беременных женщин к операции КС по ПУВ на состояние окислительно-антиоксидантного статуса новорожденных и окисленность белков пуповинной крови представлены в таблицах 1–4.
Таблица 1
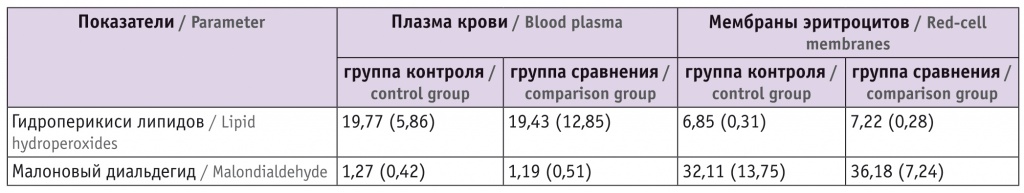
Содержание гидроперекисей липидов и малонового диальдегида в плазме крови и мембранах эритроцитов новорожденных, M (SD)
Примечания.
- Различия в содержании гидроперекисей липидов и малонового диальдегида в плазме крови и в мембранах эритроцитов в контрольной группе и в группе сравнения статистически значимы (р < 0,05).
- Единицы измерения гидроперикисей липидов: в плазме — нмоль/л, в мембранах эритроцитов — нмоль/мг белка; единица измерения малонового диальдегида — мкмоль/л.
Таблица 2
Содержание SH-групп в белках плазмы крови и мембранах эритроцитов пуповинной крови новорожденных, M (SD)
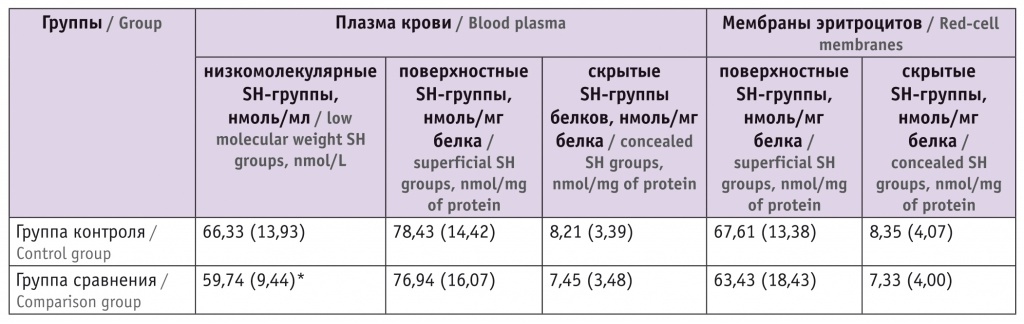
* Отличие от группы контроля статистически значимо (р < 0,05).
Таблица 3
Содержание витамина Е в плазме крови и мембранах эритроцитов новорожденных, мкмоль/мл, M (SD)
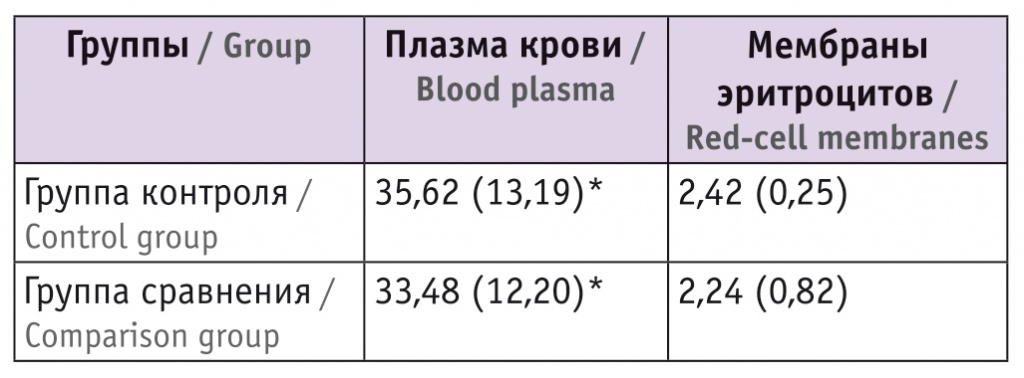
* Отличие показателей в плазме крови от показателей в мембранах эритроцитов статистически значимо (р < 0,05).
Таблица 4
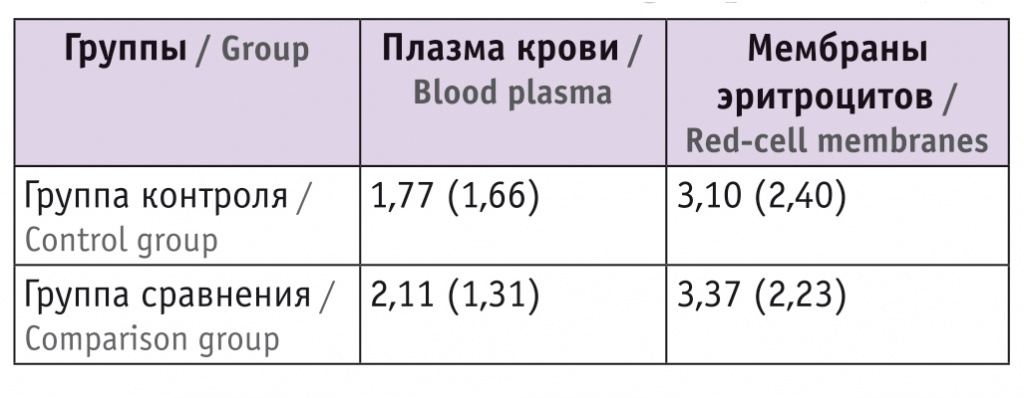
Содержание карбонильных групп в белках плазмы и мембранах эритроцитов новорожденных, нмоль/мг белка, M(SD)
Как видно из таблицы 1, между двумя пулами крови (плазма и эритроциты) у новорожденных, как и у родильниц[4], имеет место значительное расхождение в содержании начальных (ГЛ) и конечных продуктов (малоновый диальдегид) ПОЛ. Так, уровень ГЛ в плазме крови новорожденных почти в 3 раза превышает таковой показатель в мембранах эритроцитов. Содержание конечного высокотоксичного продукта ПОЛ малонового диальдегида в мембранах эритроцитов в десятки раз выше фонового уровня продукта ПОЛ в плазме крови.
Эритроциты, содержащие гемоглобин с высоким сродством к кислороду, образуют в организме как бы первый фронт встречи с кислородом. В связи с тем, что концентрация кислорода в эритроците многократно выше, чем в любой другой клетке организма, резко возрастает опасность образования в нем перекисей и, следовательно, спонтанного окисления структур клетки, образования метгемоглобина, нарушения избирательной проницаемости и реологических свойств клетки.
С учетом роли ГЛ в качестве исходного субстрата для образования конечных токсичных продуктов ПОЛ становится понятно, что более высокий фоновый уровень малонового диальдегида в мембранах эритроцитов по сравнению с таковым в плазме крови определяется недостаточностью антиоксидантных ресурсов эритроцитов, необходимых для обрыва цепи реакций ПОЛ на стадии образования ГЛ.
Высокий окислительный статус эритроцитов определяет и большую нагрузку на антиоксидантный потенциал красных клеток, который, несмотря на свою мощность, недостаточен для полной нейтрализации активных форм кислорода, образующихся в процессе оксигенации-деоксигенации гемоглобина, а также в реакциях, катализируемых некоторыми оксидоредуктазами.
Абдоминальное родоразрешение при любой технологии ведения периоперационного периода не повлияло на содержание ГЛ и МДА в плазме крови и мембранах эритроцитов новорожденных. У родильниц, как выявлено нами ранее[4], уровни ГЛ и малонового диальдегида существенно превышали показатели дооперационного периода, что свидетельствует об интенсификации ПОЛ при обоих вариантах ведения периоперационного периода КС.
Важную роль в защите клеток от окислительного стресса играют ферменты и низкомолекулярные биоантиоксиданты, в частности глутатион-γ-глутамилцистеинилглицин (GSH), α-токоферол и аскорбиновая кислота.
Глутатион является полифункциональным цитозольным биоантиоксидантом, поставщиком SH-групп, защищающим макромолекулы клетки от гидроксильных радикалов (•ОН) и других активных форм кислорода. SH-группы глутатиона окисляются гораздо легче, чем SH-группы в белковых молекулах, и за счет этого реализуется защита макромолекул от необратимой окислительной модификации[12].
GSH не только предохраняет тиоловые группы белков, в том числе ферментов и гемоглобина, от окисления, но и участвует в восстановлении дисульфидных мостиков, детоксикации ксенобиотиков, восстановлении дегидроаскорбата, неферментативном восстановлении метгемоглобина.
Как видно из таблицы 2, у новорожденных исходное содержание SH-групп, принадлежащих низкомолекулярным гидрофильным антиоксидантам тиолового ряда, в плазме крови достаточно высокое. При этом у новорожденных группы сравнения этот показатель значимо ниже, чем в группе контроля. Очевидно, что компоненты ПУВ, примененные к родильницам этой группы, активируют антиоксидантную защиту плода, что сопровождается снижением уровней SH-групп тиоловых соединений.
Характерной особенностью плода является интенсивный липидный обмен, нарастающий по мере его роста, особенно в последние 29–40 неделю беременности, что приводит к значительному увеличению общего содержания липидов и отдельных их фракций в 1-е сутки жизни. Интенсивное использование жиров системой «мать — плод», образование активных форм кислорода новорожденного в период перехода к самостоятельному дыханию могут сами по себе приводить к усилению ПОЛ и окислительной модификации белков[11].
Так, определение содержания поверхностных и скрытых SH-групп белков плазмы крови и мембран эритроцитов как маркеров окисленности белковых молекул показало, что, несмотря на незначительную тенденцию к уменьшению этих показателей в группе сравнения, значимые различия между группами отсутствуют, за исключением показателя в плазме крови (см. табл. 2). Полученные данные позволяют констатировать, что конформационное состояние белков пуповинной крови новорожденных после КС при использовании ПУВ является относительно благополучным.
Гидрофобный антиоксидант α-токоферол (витамин Е) в отличие от GSH локализован в эритроцитарной мембране, он не синтезируется в красных кровяных клетках, а встраивается в мембрану из липопротеиновых частиц плазмы крови. Антиоксидантное действие α-токоферола реализуется с помощью трех основных механизмов: взаимодействия с перекисными радикалами липидов, тушения синглетно-возбужденного молекулярного кислорода, упорядочивания архитектоники и динамического поддержания транспортных систем за счет ограничения молекулярной подвижности компонентов биологических мембран.
Как донор водородных ионов α-токоферол обладает высокой антирадикальной активностью. Константа скорости его взаимодействия с перекисными радикалами на 1–2 порядка выше, чем константы скоростей для многих известных биоантиоксидантов. Проявляя антиоксидантную активность, α-токоферол окисляется, и его восстановление происходит с участием ретинола и аскорбата[11].
Как видно из таблицы 3, исходный уровень витамина Е в плазме крови новорожденных значительно превышает таковой в мембранах эритроцитов и, как выявлено нами ранее, у родильниц[5].
Мы не обнаружили значимые различия в содержании витамина Е в плазме крови и мембранах эритроцитов у новорожденных обеих групп. Можно сказать, что пуповинная кровь новорожденных обладает надежным пулом гидрофобного антиоксиданта.
Высокий антиоксидантный статус крови новорожденных, а также, возможно, и высокая антиоксидантная активность плацентарного барьера обеспечивают надежную защиту организма ребенка от агрессивных воздействий реакционных радикалов. Об этом свидетельствует и состояние окисленности белковых молекул, которое оценивали по содержанию карбонильных групп, связанных главным образом с окислением внешних аминокислотных остатков белковых молекул.
Данные, представленные в таблице 4, показывают, что статистически значимые различия в содержании карбонильных групп в обследованных группах новорожденных в плазме крови и в мембранах эритроцитов отсутствуют. Из этого следует, что белковые молекулы плазмы крови и мембран эритроцитов у новорожденных не претерпевают заметные окислительные модификации и сохраняют нативную конформацию.
ЗАКЛЮЧЕНИЕ
На основании сравнения показателей окислительно-антиоксидантной системы пуповинной крови детей, рожденных в результате абдоминального родоразрешения при традиционном ведении периоперационного периода и при применении программы ускоренного выздоровления, можно сделать заключение, что у новорожденных обеих групп, в отличие от родильниц[4], отсутствуют признаки окислительного стресса.
Высокий уровень антиоксидантной защиты в обоих пулах крови новорожденных, вероятно, является фактором, лимитирующим развитие окислительного стресса.
Поступила: 02.12.2020
Принята к публикации: 18.01.2021








