ВВЕДЕНИЕ
Широкое внедрение в практику ВРТ, успехи преодоления бесплодия привели к повышению частоты монохориального многоплодия[1–3]. При данном виде многоплодия велика вероятность возникновения осложнений у женщины, плодов, новорожденных и детей раннего возраста[4–6]. Высокие заболеваемость и смертность детей из монохориальных диамниотических двоен обусловлены особенностями ангиоархитектуры монохориальной плаценты. Морфологической основой развития трансфузионного синдрома является функционирование плацентарных анастомозов[7–9].
Современные возможности фетальной хирургии повышают вероятность сохранения жизни обоих плодов, однако вопрос о влиянии преодоленного трансфузионного синдрома на здоровье ребенка нуждается в дополнительном изучении и уточнении[10, 11]. Поскольку у недоношенных детей из монохориальных диамниотических двоен наиболее высок уровень инвалидности по нервно-психическим заболеваниям[12, 13], целью нашей работы стала оптимизация обследования детей из монохориальных диамниотических двоен в раннем возрасте в зависимости от того, перенесли ли они синдром фето-фетальной трансфузии (СФФТ).
МАТЕРИАЛЫ И МЕТОДЫ
Проведено наблюдение за развитием недоношенных детей из монохориальных диамниотических двоен от рождения до достижения возраста 18 месяцев с проведением магнитно-резонансной трактографии.
Критерии включения:
- гестационный возраст 26 недель 0–6 суток — 32 недели 0–6 суток;
- монохориальная диамниотическая беременность;
- родители — жители Екатеринбурга и Свердловской области;
- принадлежность пациентов к славянской этнической группе.
Для всех пациентов родителями оформлялось информированное согласие на включение в исследование.
Критерии невключения:
- дети из дихориальных диамниотических двоен;
- дети из троен;
- наличие серьезных врожденных пороков развития, не связанных с СФФТ (врожденных пороков сердца и ЖКТ);
- выявление наследственных (генетических) заболеваний у детей.
Критерии исключения:
- отказ родителей на очередном этапе от последующего наблюдения;
- переезд семьи в другой регион России или за границу.
В исследование включены 60 недоношенных новорожденных из монохориальных диамниотических двоен. Основную группу (группу I) составили 30 пациентов, перенесших СФФТ и его внутриутробную хирургическую коррекцию методом лазерной коагуляции плацентарных анастомозов в сроке 22–24 недели гестации. В группу сравнения (группу II) вошли 30 детей, у которых СФФТ не было.
Наблюдаемые дети родились в 2019–2020 гг. в ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России (директор — д. м. н. Галина Борисовна Мальгина). Все они выхаживались в стационаре второго этапа указанной медицинской организации и до достижения конечной точки наблюдения (18 месяцев постменструального возраста, ПМВ) в декретированные сроки госпитализировались в стационар отделения детской реабилитации для дообследования и проведения лечебных мероприятий.
Промежуточные контрольные точки — сроки катамнестического (проспективного) наблюдения:
1-я точка — рождение (26 нед 0–6 суток — 32 нед 0–6 суток, гестационный возраст равен ПМВ);
2-я точка — 6 мес корригированного возраста (64 нед ПМВ);
3-я точка — 12 мес корригированного возраста (88 нед ПМВ);
4-я точка — 18 мес корригированного возраста (112 нед ПМВ).
Диагностические процедуры:
- осмотр и физикальное обследование;
- общеклинические лабораторные исследования;
- инструментальные исследования (нейросонография с ультразвуковой доплерометрией, электроэнцефалограмма-видеомониторинг, МРТ головного мозга с МР-трактографией).
Диффузионно-тензорную МРТ с трактографией (МР-трактографию) проводили на томографе Signa HDxt 1.5Т (General Electric, США) с индукцией магнитного поля 1,5 Тл. Исследование включало 2D BRAVO Т1 последовательность (TR/ТЕ — 8,4/3,1 мс, толщина среза — 1,2 мм, непрерывно, FOV — 24 × 24 см, матрица — 200 × 200, аксиальная плоскость), Т2 FLAIR (TR/ТЕ — 9002,0/135,6 мс, толщина среза — 4 мм, непрерывно, FOV — 24 × 24 см, матрица — 288 × 56, аксиальная плоскость). Диффузионно-тензорные изображения были получены с использованием следующих параметров: TR/ТЕ — 9000,0/94,9 мс, матрица — 96 × 96; толщина среза — 2,5 мм, непрерывно, максимальный коэффициент диффузии (b-value) — 1000 с/мм2, без наркоза и седации, в период естественного дневного сна.
Полученные данные обрабатывались на рабочей станции AW версии 4.3, где проводили измерения среднего коэффициента диффузии (average diffusion coefficient, ADC) и фракционной анизотропии (fractional anisotropy, FА) в выделенных симметричных областях (region of interest, ROI) с использованием инструментов программного обеспечения Functools рабочей станции AW версии 4.3. Проводилась трехмерная реконструкция проводящих путей головного мозга. Результаты оценивались совместно со специалистами отделения биофизических и лучевых методов исследований.
Для оценки моторных и сенсорных путей исследовали кортикоспинальный тракт и заднюю таламическую лучистость. Кортикоспинальный тракт оценивали на уровне передней ножки, задней ножки и колена внутренней капсулы. Для оценки комиссуральных межполушарных волокон проводили измерения мозолистого тела на следующих уровнях: колено мозолистого тела, средняя и задняя треть ствола, а также валик мозолистого тела. Для каждой исследуемой анатомической структуры выделялись области интереса (ROI). Количество пикселей соответствовало размерам анатомической области на данном срезе. Для основной группы и группы сравнения показатели FA и ADC были получены в аналогичных анатомических структурах.
Возрастные периоды выбраны с учетом стадий миелинизации по R.B. Dietrich (1988): младенческая стадия — до 6 мес, переходная стадия — 8–12 мес, ранняя взрослая стадия — 10–31 мес жизни.
Восстановительное лечение (абилитация) всех пациентов включало:
- нейропротекторы и противосудорожные средства по индивидуальным показаниям;
- кинезиотерапию (лечебную физкультуру, массаж, тактильно-кинестетическую стимуляцию);
- гидротерапию;
- иглорефлексотерапию;
- физиотерапию — токолечение, теплолечение, сухую иммерсию;
- семейно-ориентированное психологическое сопровождение (работу с перинатальным психологом).
В качестве основных исходов сочетанной перинатальной патологии у детей в обеих когортах фиксировалась частота:
- грубых органических поражений ЦНС, таких как детский церебральный паралич, судорожный синдром, выраженная задержка психомоторного развития;
- негрубых резидуальных (функциональных) нарушений — темповой задержки психомоторного развития, вегето-висцеральных нарушений.
В связи с ограниченным контингентом больных и небольшой длительностью наблюдения гендерные различия не фиксировали.
Этическая экспертиза осуществлена в соответствии с процедурой комплексной экспертной оценки полного конкурсного цикла Российского фонда фундаментальных исследований, предусмотренной для исследования по данному направлению.
За время наблюдения нежелательных явлений не было. Все пациенты перенесли исследование удовлетворительно.
Обработка цифрового материала выполнена с использованием пакета компьютерной программы Statistica 10.0 for Windows ХР, BioStat в соответствии с общепринятыми методами медицинской статистики. Количественные данные (FA и ADC) представлены в формате медианы (Me) и стандартного отклонения (m). Рассчитывали также непараметрические показатели: χ2, критерий Фишера, отношения рисков. Различия считали статистически значимыми при р ≤ 0,05.
РЕЗУЛЬТАТЫ
В настоящее время диффузионно-тензорная МРТ с трактографией (МР-трактография) прочно вошла в клиническую практику, с ее помощью совершенствуются подходы к диагностике заболеваний в детской неврологии благодаря уникальным возможностям клинико-нейровизуализационных сопоставлений. Трактография головного мозга — диагностический метод, основанный на диффузионно-тензорной МРТ (МР-трактографии), позволяющий визуализировать ориентацию и целостность проводящих путей головного мозга in vivo. Еще несколько лет назад трактография была предметом научных исследований, в настоящее время этот метод становится доступным[14, 15].
При оценке тяжести перинатальных энцефалопатий у наблюдаемых детей из монохориальных диамниотических двоен мы учитывали следующие показатели: оценку по шкале Апгар, тяжесть состояния при рождении, неврологические синдромы в постнатальном периоде, характер патологических изменений по данным нейросонографии, результаты доплерометрии.
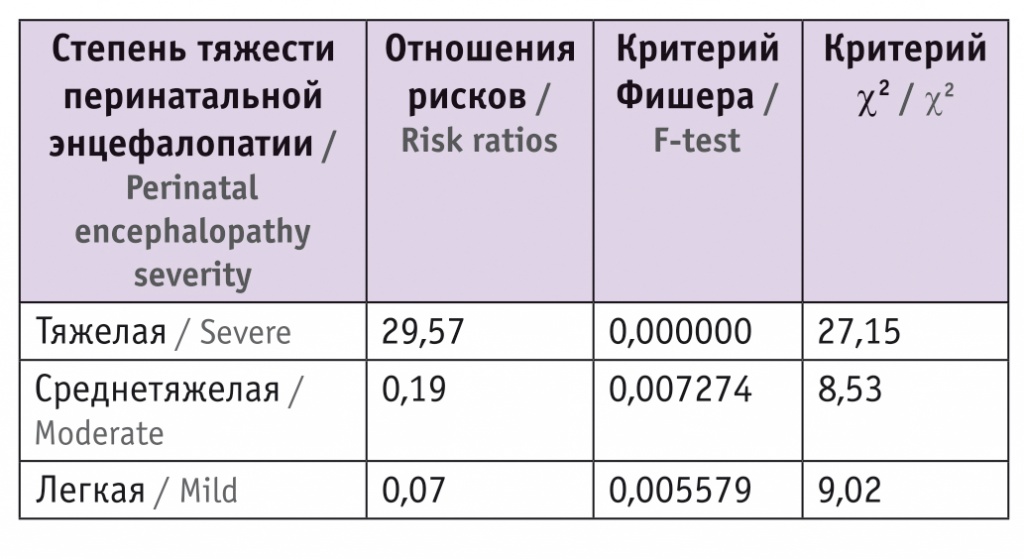
Структура перинатального поражения ЦНС у детей, включенных в исследование: тяжелые формы перинатального поражения ЦНС в группе I зафиксированы у 23 (76,7%) детей, в группе II — у 3 (10,0%) (р < 0,01); среднетяжелые варианты в группе I — у 6 (20,0%) младенцев и в группе II — у 17 (56,7%) (р < 0,01). У 1 (3,3%) ребенка, перенесшего СФФТ, и у 10 (33,3%) пациентов группы сравнения диагностированы легкие формы перинатального поражения ЦНС. Показатели представлены в таблице 1.
Таблица 1
Частота диагностированных перинатальных энцефалопатий у пациентов
СФФТ вызывает развитие гемодинамических нарушений у плодов, что может спровоцировать гибель нейронов, снижение как общего числа нейронов, так и количества правильно миелинизированных аксонов. С целью диагностики целостности и направления проводящих каналов головного мозга у изучаемых детей была проведена диффузионно-тензорная МРТ с трактографией в возрасте 6, 12, 18 месяцев корригированного возраста (табл. 2–4).
Таблица 2
Показатели магнитно-резонансной трактографии у младенцев в 6 месяцев корригированного возраста
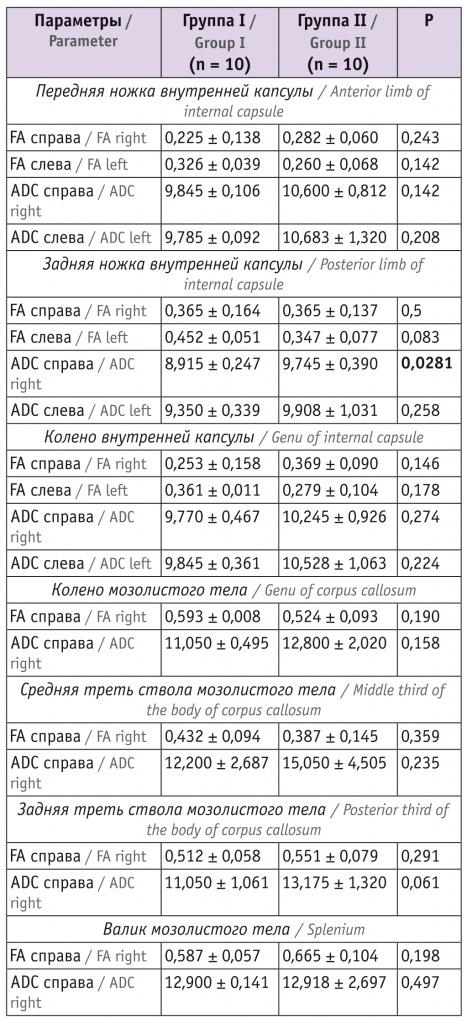
Примечание. Здесь и в таблицах 3, 4: ADC — средний коэффициент диффузии (average diffusion coefficient) (единица измерения — –103 мм/с), FА — коэффициент фракционной анизотропии (fractional anisotropy).
Таблица 3
Показатели магнитно-резонансной трактографии у младенцев в 12 месяцев корригированного возраста
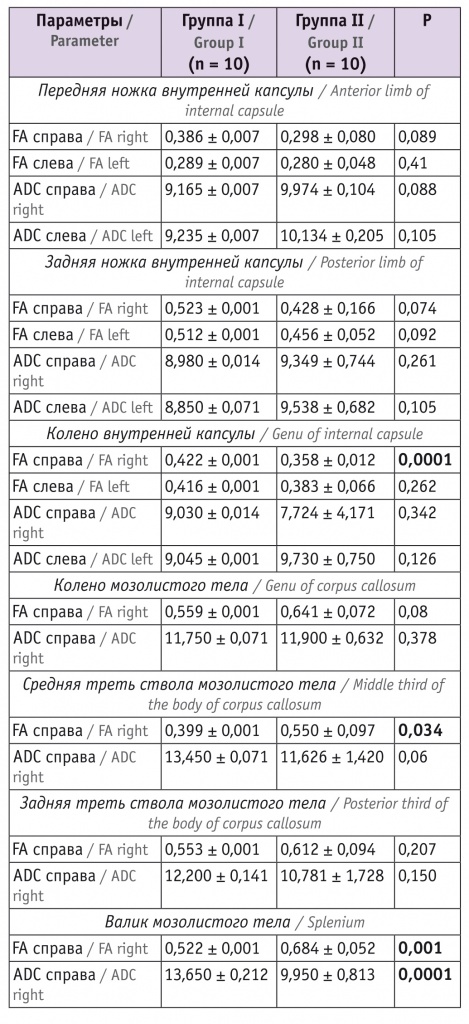
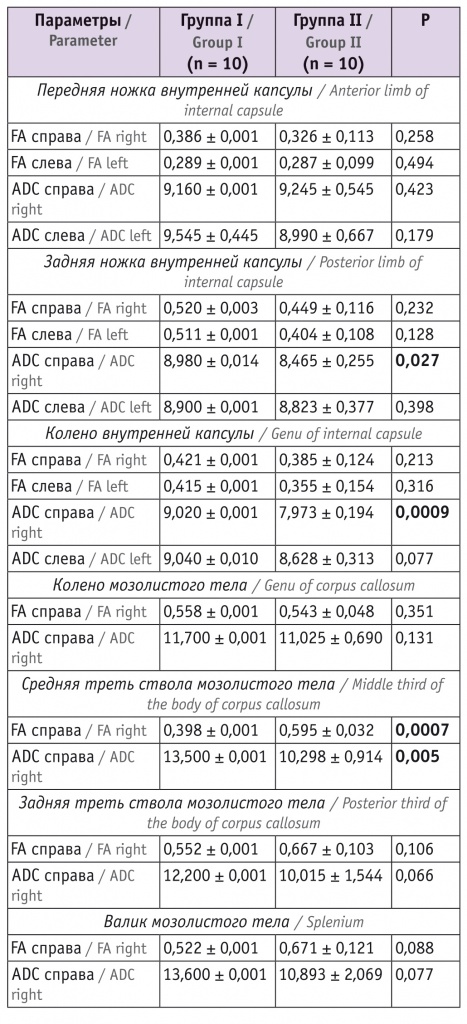
Таблица 4
Показатели магнитно-резонансной трактографии у младенцев в 18 месяцев корригированного возраста
Согласно представленным в таблице 2 данным, исследуемые показатели у детей групп I и II значимо не различались, кроме показателя ADC справа задней ножки внутренней капсулы. У детей в возрасте 12 мес значимые различия в изучаемых параметрах выявлялись чаще (см. табл. 3).
При анализе изучаемых показателей в возрасте 12 месяцев у младенцев, перенесших СФФТ, отмечались значимые снижение показателя FA в средней трети ствола мозолистого тела и валике мозолистого тела справа, повышение значения ADC в валике мозолистого тела справа. Выявлена тенденция к повышению FA у детей основной группы в изучаемых параметрах внутренней капсулы, значимо более высокий показатель FA справа зафиксирован в колене внутренней капсулы. Значения ADC в колене, передней и задней ножках внутренней капсулы в основной группе и группе сравнения существенно не различались.
В возрасте 18 месяцев корригированного возраста значения FA справа средней трети ствола мозолистого тела у пациентов, перенесших СФФТ, были значимо ниже, чем в группе сравнения. Показатели ADC справа задней ножки и колена внутренней капсулы, а также средней трети ствола мозолистого тела были существенно выше в группе I, чем в группе II.
Структура исходов перинатальной патологии у пациентов, достигших 18 месяцев корригированного возраста: грубая органическая патология ЦНС у детей группы I зафиксирована значительно чаще — 14 (46,7) против 5 (16,7%) в группе II (р < 0,05); негрубые резидуальные проявления перинатальной патологии ЦНС отмечены у 15 (50,0%) детей группы сравнения и у 13 (43,3%) младенцев основной группы (р > 0,05), условно здоровыми признаны 10 (33,3%) пациентов группы II и только 3 (10,0%) ребенка группы I (р < 0,05). Случаев оформления инвалидности по неврологической патологии не было.
Проведенный нами анализ подтверждает значимость базового критерия — задержки темпов миелинизации кортикоспинального тракта и задней таламической лучистости у недоношенных детей из монохориальных диамниотических двоен, перенесших СФФТ, в определении прогноза развития отсроченных неврологических нарушений, особенно грубой органической патологии ЦНС. Полученные значимые различия при относительно небольшой численности наших когорт и ограниченном сроке исследования свидетельствуют о том, что требуется дальнейшее изучение состояния здоровья недоношенных детей, перенесших СФФТ.
ОБСУЖДЕНИЕ
В настоящее время все больше возрастает необходимость в неинвазивном бесконтактном получении информации о характере регионарных и очаговых процессов, происходящих в головном мозге ребенка, как на диагностическом этапе, так и в процессе лечения заболеваний ЦНС у детей различных возрастных групп. В этом отношении новые перспективы открывает метод МР-трактографии[16, 17]. МР-трактография мозга у детей в различные возрастные периоды обладает рядом особенностей. У новорожденных реконструкция проводящих путей затруднена из-за малонаправленного характера диффузии на фоне незавершенной сформированности. Тяжелое состояние новорожденного ребенка, ИВЛ могут стать препятствиями для проведения данной диагностической процедуры. Малые размеры головного мозга требуют использования уменьшенной величины вокселя, что снижает интенсивность получаемых сигналов и затрудняет реконструкцию трактограмм[18, 19].
Процесс миелинизации мозга (увеличение содержания липидов и уменьшение содержания воды в оболочках нервных путей) начинается на пятом месяце внутриутробного развития и продолжается активно до 2 лет. В этом возрасте миелинизация мозга является ключевым компонентом неврологического развития, она коррелирует с увеличением сенсорных, моторных и когнитивных способностей, тесно связана с неврологической функциональной зрелостью[20].
ЗАКЛЮЧЕНИЕ
Недоношенные новорожденные из монохориальных диамниотических двоен, перенесшие синдром фето-фетальной трансфузии (СФФТ), составляют группу риска нарушения миелинизации проводящих путей, по результатам магнитно-резонансной трактографии. Определена прогностическая значимость СФФТ и темповой задержки созревания кортикоспинального тракта и задней таламической лучистости, доказана необходимость динамического контроля за процессом миелинизации у детей из группы риска. Ранняя диагностика повреждения, своевременный подбор абилитационной и реабилитационной терапии повышают шансы успешного лечения и благоприятных отдаленных исходов у недоношенных детей из монохориальных диамниотических двоен. Предполагается продолжить медицинское сопровождение семей недоношенных детей из монохориальных диамниотических двоен, перенесших СФФТ, с целью этапной коррекции неврологических нарушений и улучшений показателей здоровья и психомоторного развития.
Поступила: 15.01.2021
Принята к публикации: 10.02.2021








