Окислительная теория повреждения тканей гласит, что патогенез основных патологических состояний связан с прогрессивным накоплением в организме активных форм кислорода (АФК)[11]. В свою очередь, образование свободных радикалов вызывает физиологическую дисфункцию — необратимое клеточное повреждение[13]. Эта теория повреждения тканей постулирует положительный механизм обратной связи, когда свободные радикалы, образованные митохондриями, изменяют транспортную цепь электронов, вызывая их повреждения и дальнейшее накопление АФК[7]. Известно, что митохондрии являются основным источником образования свободных радикалов[20].
Молекулярный кислород не вступает в неконтролируемые химические реакции внутри организма. Его активация осуществляется ферментативными системами, а именно ферментами метаболизма кислорода: оксидазами и оксигеназами. В каталитических центрах этих ферментов кислород включается в конечные соединения, не выделяясь в среду и не взаимодействуя с органическими макромолекулами клеток[19].
Окислительный, или оксидативный, стресс — состояние, характеризующееся повышенными уровнями внутриклеточных АФК. АФК включают супероксидный радикал (О2–), перекись водорода (Н2О2), гидроксильные (свободные) радикалы (О–), синглетные формы кислорода (1О2), ионы НО2–. Все эти вещества способны к реакциям, приводящим к разрушению ДНК, белков и липидов[20]. При физиологических условиях АФК нивелируются в клетках воздействием супероксиддисмутазы (СОД), каталазы, глутатиона[16].
Низкие уровни внутриклеточных АФК были идентифицированы как регуляторы сигналов транскрипционных процессов, изменяющиеся в зависимости от деления клеток или их гибели. Высокие дозы АФК приводят к разобщению этих процессов[6]. Оксидативный стресс активизирует многочисленные внутриклеточные сигнальные пути, такие как Akt, NFkB, p53, Jak/Stat и MAPK, приводя к генетическим повреждениям или апоптозу. Экспрессия Bcl-2 аннулирует активацию свободнорадикальных реакций, вызывая апоптоз[5].
Общая (ОА) и регионарная анестезия (РА) может оказывать воздействие на метаболизм кислорода за счет афферентных, соматических и вегетативных нервных стимулов с места повреждения и за счет изменения состава дыхательной смеси. Особое значение имеют и химические вещества, используемые для анестезии. Они способны вызывать как местную, так и общую реакцию организма, сопровождающуюся увеличением содержания АФК и снижением антиокислительной активности[17].
Повреждающий эффект АФК может затрагивать различные органы и влиять на каскад внутриклеточных и внеклеточных сигналов, воздействуя на состояние ангиогенно-воспалительного стресса, послеоперационную боль и процессы репарации после хирургического вмешательства[15].
В 2003 г. нами была разработана интегральная гемодинамическая номограмма с добавлением показателей транспорта кислорода и ПОЛ. Это была одна из первых попыток оценить в режиме реального времени развитие оксидативного стресса у беременных в условиях ОА при операции кесарева сечения[4].
В настоящее время роль оксидативного стресса у беременных в периоперационном периоде в литературе отражена недостаточно.
Цель исследования: оценить состояние про- и антиокислительной активности у беременных женщин на системном уровне в периоперационном периоде плановой операции кесарева сечения при РА (комбинированной спинально-эпидуральной анестезии) и ОА.
МАТЕРИАЛЫ И МЕТОДЫ
Под наблюдением находились 62 беременные женщины в возрасте от 21 года до 37 лет (в среднем — 30,9 ± 6,2 года), родоразрешенные путем операции кесарева сечения. Исследование проводили в 2012–2014 гг. на базе отделения анестезиологии и реанимации ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В. И. Кулакова». Пациенток разделили на две группы. В первую группу были включены 33 женщины, выбором обезболивания у которых при абдоминальном родоразрешении послужила ОА. Их средний возраст составил 29,6 ± 5,8 года, средний срок гестации — 38,06 ± 1,74 недели. Во вторую группу (группу РА) вошли 29 беременных, прооперированных под комбинированной спинально-эпидуральной анестезией (средний возраст составил 31,1 ± 6,2 года, средний срок гестации — 39,01 ± 1,52 недели). Паритет родов, возраст, сроки гестации и ростовесовые показатели участниц групп исследования не имели статистически значимых различий.
Все участницы дали письменное информированное согласие на проведение анестезии. ОА и РА выполняли, как описано нами ранее[1, 2].
Про- и антиоксидантный статус. Образцы крови забирали непосредственно после помещения пациентки на операционный стол (Т1), сразу после ушивания операционной раны (Т2), через 12 часов (Т3) и 24 часа (Т4) после взятия первого образца. Для измерения концентрации редуцированного глутатиона (РГ) использовали эритроцитарную массу. Определение уровня глутатионпероксидазы (ГП) проводили в цельной крови. Плазму, эритроцитарную массу и лизаты эритроцитов сохраняли при –70 °C.
Для определения уровней СОД (МЕ/г Hb), ГП (МЕ/г Hb), РГ (ммоль/л), активных продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-ап) (мкмоль/л), а также общей антиокислительной активности (OАА) (ммоль/л) использовали стандартизованные реагенты. Концентрации СОД и ГП, ОАА измеряли с помощью коммерческих наборов фирмы Randox (Северная Ирландия), уровень РГ — с применением наборов фирмы Oxis (США). Содержание ТБК-ап определяли с использованием реагентов фирмы «Агат» (Россия). Постановку реакций и учет результатов проводили профессор В. А. Бурлев и Н. А. Ильясова.
Статистический анализ. Для анализа результатов использовали статистические компьютерные программы IBM SPSS Statistics 20. Результаты исследования представлены в виде среднего значения и стандартного отклонения (М ± SD). Применяли парный или непарный t-тест или ANOVA, критерий Вилкоксона, U-критерий Манна — Уитни или тест Вилкоксона. Различия между группами считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Средняя продолжительность операции в группах ОА и РА составила 53,08 ± 14,44 и 51,08 ± 15,32 минуты соответственно (р > 0,05). Суммарная кровопотеря, измеренная гравиметрическим методом, — 696,6 ± 182,73 мл в группе ОА и 667,6 ± 198,79 мл в группе РА (р > 0,05). Состояние новорожденных по шкале Апгар в группах ОА и РА: на первой минуте — 7,7 ± 0,92 и 7,6 ± 0,94 балла соответственно (р > 0,05), на пятой минуте — 8,6 ± 0,67 и 8,4 ± 0,72 балла соответственно (р > 0,05).
Женщины, прооперированные под РА, во всех исследуемых промежутках времени находились на спонтанном дыхании атмосферным воздухом, в то время как у пациенток, перенесших ОА, имели место значительные изменения характеристик дыхания и кислородной нагрузки. При ОА в Т1-период в течение 3 минут перед индукцией в анестезию осуществляется спонтанное дыхание 100%-м кислородом (фракция кислорода во вдыхаемой смеси (FiO2) = 100%) и затем, в период Т2, проводится традиционная ИВЛ газовой наркозной смесью с содержанием кислорода до 30% (FiO2 = 30%). При РА в аналогичные периоды осуществляется спонтанное дыхание атмосферным воздухом (FiO2 = 21%). В периоды Т3 и Т4 прооперированные не получают дополнительного кислорода.
Показатели оксидативного стресса в крови в периоперационном периоде плановой операции кесарева сечения в зависимости от вида анестезии представлены в таблице.
Таблица
Показатели оксидативного стресса в крови у обследованных пациенток при общей и регионарной анестезии в периоперационном периоде плановой операции кесарева сечения (M ± SD)
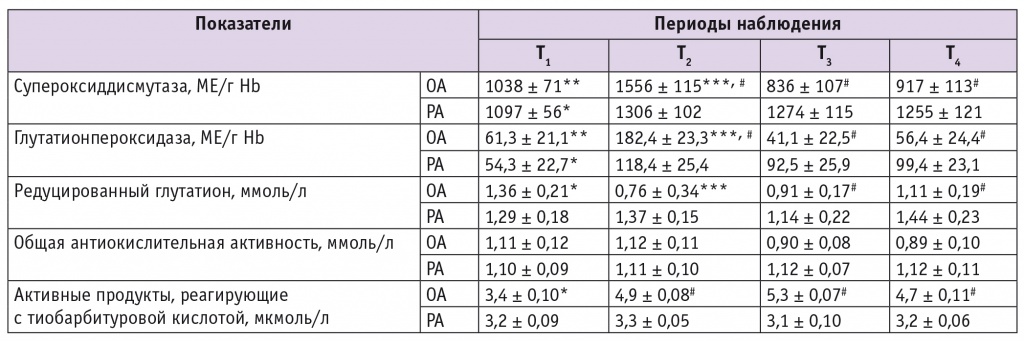
Примечания.
- ОА — общая анестезия, РА — регионарная анестезия.
- Статистическая проверка гипотезы о достоверности межгрупповых различий средних величин в исследуемых временны’х промежутках периоперационного периода проводилась с помощью ANOVA.
- Знаками (*) и (#) отмечены статистически значимые различия (p < 0,05): (*) — между периодом T1 и интервалами Т2–Т4; (**) — между периодами Т1 и Т2; (***) — между периодом Т2 и интервалами Т3 и Т4; (#) — между группами ОА и РА.
Как следует из приведенных данных, активность СОД при ОА статистически значимо возрастала после ушивания послеоперационной раны (Т1 против T2) и затем снижалась к интервалам Т3 и T4 (по отношению к интервалу Т2, p < 0,05). При РА активность СОД достоверно увеличивалась в периоды Т2–Т4 по сравнению с Т1 (p < 0,05). Сравнение групп анестезии показало, что до нее у беременных обеих групп активность СОД не различалась. В интервалах Т3 и Т4 она была статистически значимо ниже при ОА, чем при РА.
Активность ГП при ОА достоверно возрастала в Т2-период по сравнению с периодом Т1 (в 3,0 раза) и затем снижалась в Т3- и Т4-периоды по отношению к интервалу Т2 (в 4,4 и 3,2 раза соответственно, p < 0,05). При РА отмечалось увеличение активности ГП в период Т2 по сравнению с периодом Т1 (в 2,2 раза, p < 0,05) без статистически значимых изменений в последующей динамике. До проведения анестезии активность ГП в группах исследования была сходной, однако при ОА в сравнении с РА она была в 1,5 раза выше в период Т2 (p < 0,05) и в 2,2 и 1,8 раза ниже в периоды Т3 и Т4 соответственно (p < 0,05).
Содержание РГ при ОА в период Т2 максимально снижалось по сравнению с исходным (в 1,8 раза, p < 0,05) и было достоверно снижено также в периоды Т3 и Т4. При РА достоверных изменений концентрации РГ не было. В периоды Т1 и Т2 различий между группами в зависимости от вида анестезии не отмечено, но в периоды Т3 и Т4 имело место достоверное снижение уровня РГ в группе ОА.
Различий в ОАА в пределах изученных интервалов (Т1–Т4) и в зависимости от вида анестезии у обследованных пациенток не зафиксировано.
Содержание ТБК-ап в крови при ОА статистически значимо возрастало в интервале Т2 и оставалось повышенным в интервалах наблюдения Т3 и Т4. У пациенток, находившихся под РА, уровень ТБК-ап в крови в интервалах Т1–Т4 не менялся. Сравнение между группами ОА и РА по различным интервалам установило отсутствие достоверных различий в период Т1 и достоверное увеличение концентрации ТБК-ап в интервалах Т2–Т4 при ОА.
ОБСУЖДЕНИЕ
В настоящее время не вызывает сомнений, что при любом патологическом состоянии наблюдаются отклонения в показателях биохимического статуса организма. В 1992 г. В. А. Бурлеву впервые удалось доказать, что акушерская патология сопровождается изменением транспорта кислорода к плоду, гипоксемией, метаболическим ацидозом и что эти процессы индуцируют оксидативный стресс. Проявления оксидативного стресса наблюдаются при невынашивании беременности, преждевременных родах, плацентарной недостаточности, гипоксии плода, гестозе (преэклампсии и эклампсии), слабости родовой деятельности[3].
В то же время проблема оценки состояния больного после хирургического вмешательства и сопряженного с ним анестезиологического пособия, в том числе после операции кесарева сечения, выполняемого по медицинским показаниям, обусловленным тяжестью акушерской патологии, многие годы остается значимой ввиду разнообразия как клинических проявлений в этот период, так и вариантов прогноза[9, 14]. Воздействие анестезиологического пособия испытывает и плод[10].
В последние годы предложены разнообразные маркеры для оценки оксидативного стресса при операции кесарева сечения[12], однако вариабельность показателей и неоднородность пациенток, включенных в исследования, не позволяют проводить сравнение между различными данными[8]. К числу наиболее значимых показателей для оценки неблагоприятных состояний в периоперационный период следует отнести повышение уровней ангиогенных факторов роста, белков острого воспаления, проинфламаторных цитокинов[2].
Изменение активности СОД, ГП, РГ и ТБК-ап в условиях ОА следует рассматривать как ответ на оксидативный стресс. Однако при наличии мощного антиокислительного пула и управляемой тактики проведения ОА эти изменения не достигают критического уровня и не оказывают значительного влияния в периоды Т3 и Т4.
Снижение количества РГ и увеличение содержания окисленного глутатиона непосредственно связаны с процессом активации оксидативного стресса, поскольку под действием экзогенного кислорода редокс-равновесие глутатиона изменяется с тенденцией к его окислению в процессе ОА[18].
Недостаток РГ и повышение уровней СОД, ГП или ТБК-ап в предоперационном периоде могут приводить к избыточному проявлению оксидативного стресса и тем самым оказывать воздействие на периоперационный период. Определение показателей оксидативного стресса, в первую очередь концентрации РГ, позволяет устанавливать его патологические границы.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования указывают на различное влияние регионарной (РА) (комбинированной спинально-эпидуральной) или общей анестезии (ОА) на оксидативный стресс в интра- и раннем послеоперационном периоде при кесаревом сечении. Под действием оксигенации 100%-м кислородом, который использовали у пациенток перед началом ОА в Т1-период, и затем при проведении традиционной ИВЛ газовой наркозной смесью с содержанием кислорода до 30% (фракция кислорода во вдыхаемой смеси (FiO2) = 30%) в Т2-период на фоне ОА при операции кесарева сечения наблюдаются лабораторные изменения, характерные для оксидативного стресса. При РА в аналогичные периоды осуществляется спонтанное дыхание атмосферным воздухом (FiO2 = 21%) и проявления оксидативного стресса отсутствуют. Изменения изученных показателей при ОА в периоды Т1 и Т2 за счет оксигенации 100%-м кислородом являются основой для проявления оксидативного стресса. Выделение критических этапов в периоперационном периоде позволяет своевременно выявлять их отрицательную динамику и тем самым прогнозировать осложнения.








