ВВЕДЕНИЕ
Монохориальное многоплодие в настоящее время заслуживает пристального внимания в связи с увеличением его частоты в результате активного внедрения вспомогательных репродуктивных технологий и ввиду высокой перинатальной заболеваемости и смертности[1, 2].
Существуют специфические осложнения, связанные с монохориальным многоплодием, такие как синдром фето-фетальной трансфузии (СФФТ), селективная задержка роста одного из плодов, синдром обратной артериальной перфузии или внутриутробная гибель одного плода из двойни.
Фетоскопическая лазерная коагуляция плацентарных анастомозов (ЛКПА) зарекомендовала себя как оптимальная методика для коррекции СФФТ[3]. Частыми осложнениями фетоскопической ЛКПА при СФФТ являются преждевременное излитие околоплодных вод, септотомия (разрыв межамниотической мембраны), отслойка амниотической оболочки, рецидив СФФТ, синдром анемии-полицитемии, гибель одного плода из двойни, зеркальный синдром (синдром Баллантайна).
По данным V. Beck и соавт., повреждение плодных оболочек лидирует среди прочих осложнений при фетоскопических вмешательствах и в ряде случаев приводит к развитию синдрома псевдоамниотических тяжей (СПАТ)[4].
СПАТ является редким осложнением внутриутробных манипуляций: амниоцентеза, амниоредукции, септотомии, фетоскопической ЛКПА, коагуляции сосудов пуповины у монохориальных диамниотических двоен, осложненных СФФТ, и т. д.[5, 6]. Частота СПАТ у монохориальных близнецов после инвазивных процедур составляет от 1,8% до 3,3%[5, 6].
Относительно развития СПАТ имеются две гипотезы. Первая основывается на непреднамеренной септотомии во время инвазивной процедуры, что встречается в 7,2% случаев фетоскопической лазерной коагуляции. СПАТ возникает вследствие перфорации амниотической полости плода-донора при прохождении троакара в полость матки, когда плацента расположена по передней стенке, а также в случаях расположения анастомозов на донорской части плаценты, что ведет к травматизации и разрывам межблизнецовой мембраны[7].
Во второй гипотезе определяющую роль играет послеоперационный разрыв межблизнецовой перегородки, связанный с многоводием у плода-реципиента и его гиперподвижностью[8].
Тяжи, возникающие после разрыва межблизнецовой мембраны, сходны по клиническим проявлениям со СПАТ, ассоциирующимся с косметическими дефектами и тяжелыми пороками развития, которые связаны с деформацией или ампутациями конечностей плода в результате разрыва амниона в первом триместре беременности[9].
С 2005 по 2008 г. M. Habli и соавт. проводили исследование с участием 152 пациенток, перенесших фетоскопическую ЛКПА для коррекции СФФТ в сроке 16–26 недель беременности, с целью оценки частоты развития ранних и поздних осложнений. Осложнения включали два случая полного разрыва межблизнецовой мембраны и формирования моноамниотической двойни (1,3%), три случая синдрома анемии-полицитемии и рецидива СФФТ (2,0%), пять случаев СПАТ (3,3%)[10].
С 1999 по 2006 г. N. Winer и соавт. проанализировали 438 случаев коррекции СФФТ у монохориальной диамниотической двойни в сроке 15–26 недель беременности. СПАТ развился в восьми случаях (1,8%), пострадавшим всегда был плод-реципиент. В двух из восьми (25,0%) наблюдений диагноз был поставлен пренатально. Чаще отмечалось поражение верхних и нижних конечностей плода. В данном исследовании причинами развития СПАТ стали преждевременный разрыв межблизнецовой мембраны и внутриутробная гибель плода-донора[5].
Исследование R. Cruz Martinez и соавт., проведенное с 2006 по 2009 г. с участием клиник Барселоны (Испания) и Бельгии, включало 414 пациенток с СФФТ, которым была выполнена ЛКПА. Средний гестационный возраст при терапии и родах составлял 20,4 и 32,7 недели соответственно. Септотомия произошла в течение первой недели после операции в 30 случаях (7,2%), 11 из них были выявлены в течение 24 часов после операции. Восемь (1,9%) случаев септотомии были осложнены СПАТ и диагностированы постнатально, остальные установлены в ходе пренатального динамического наблюдения. Случаев ампутации конечностей не зарегистрировано[7].
В 2012 г. R. Andreia и соавт. в ходе наблюдений за пациентками после коррекции СФФТ определили, что доля СПАТ у них равна 1,8%[11]. Y.H. Ting и соавт. в 2016 г. опубликовали данные, согласно которым частота встречаемости СПАТ в их клинике составляет 2% и только 27% случаев СПАТ диагностируются пренатально[9]. G.P. Savino в 2018 г. также сообщил о том, что СПАТ после фетоскопической лазерной коррекции СФФТ обнаруживается у 2% прооперированных; основным методом купирования данного состояния, по мнению автора, является своевременное лазерное рассечение тяжа/тяжей[12]. A.A. Nassr и соавт. в 2019 г. предоставили данные о том, что СПАТ после ЛКПА в их практике встречался в 1,8–3,3% случаев в разные годы[13].
А.В. Михайлов и соавт. после серии собственных наблюдений сообщили о том, что развитие синдрома в 1,8% случаев обусловливает возникновение поперечной редукции конечностей, которое чаще наблюдается у плода-реципиента, особенно при гибели плода-донора, что не расходится с раннее опубликованными результатами аналогичных исследований[14].
Ультразвуковым проявлением синдрома является визуализация тонких нитевидных мембранных тяжей, пересекающих амниотическую полость и прилежащих к поверхности тела плода. К числу явных ультразвуковых признаков относится наличие констрикционных колец на конечностях плода в сочетании с дистальной лимфедемой. Могут выявляться особенности развития плода: множественные асимметричные дефекты конечностей, черепно-лицевые или висцеральные дефекты[15]. Ряд ученых при диагностике СПАТ отдает предпочтение ультразвуковому сканированию в режиме 3D.
Пренатальная диагностика позволяет наблюдать за состоянием плода/плодов в послеоперационном периоде, своевременно диагностировать СПАТ, а также незамедлительно выполнять необходимые хирургические мероприятия при нарушении васкуляризации конечности и сдавлении пуповины[16].
На базе ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» («НИИ ОММ») МЗ РФ с 2012 по 2019 г. проведено 195 фетоскопических операций с целью коррекции СФФТ. Представленный случай формирования СПАТ является вторым пренатально диагностированным осложнением внутриутробной коррекции СФФТ на базе нашего учреждения. Исследование проводилось на ультразвуковой диагностической системе Voluson E8 (GE, США) c применением конвексных датчиков C1-5-RS и E8C-RS.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациентка В., 32 лет, повторнобеременная, повторнородящая, поступила в ФГБУ «НИИ ОММ» МЗ РФ с диагнозом: Беременность в сроке 20–21 недели, двойня монохориальная диамниотическая. Синдром фето-фетальной трансфузии 3-й стадии по Квинтеро. Истмико-цервикальная недостаточность.
В сроке 21 недели беременности установлен акушерский пессарий. В сроке 21–22 недель проведена селективная ЛКПА. Амниоредукция в объеме 1000 мл. Выписана с диагнозом: Беременность в сроке 24–25 недель. Антенатальная гибель плода-донора в сроке 23–24 недель. Синдром фето-фетальной трансфузии 3-й стадии, купирован. Амниоредукция. Отслойка амниотической оболочки. Истмико-цервикальная недостаточность. Акушерский пессарий. Анемия 1-й степени.
В сроке 25–26 недель беременности пациентка повторно поступила в отделение патологии беременных № 2 ФГБУ «НИИ ОММ» МЗ РФ. При УЗИ выявлен СПАТ.
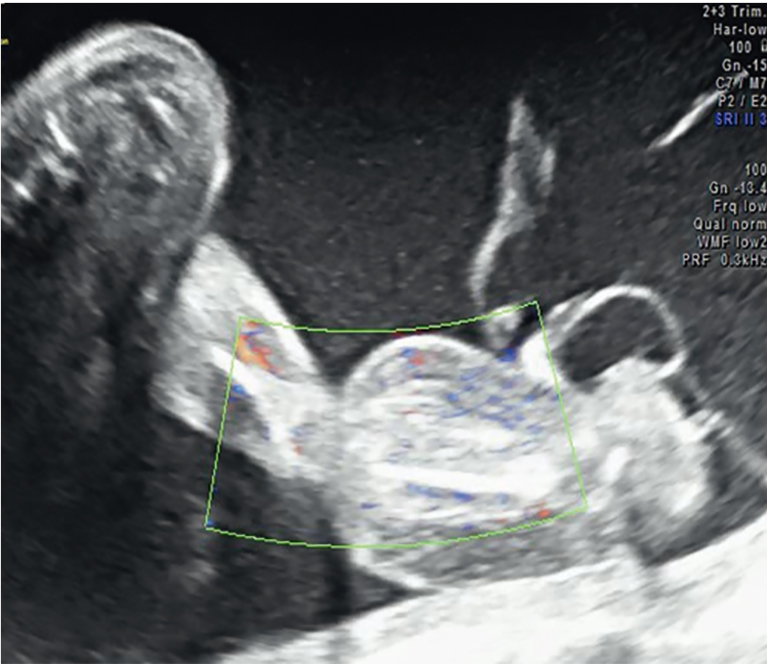
В ходе УЗИ у беременной обнаружен один живой плод, фетометрические показатели которого соответствовали сроку 25–26 недель беременности. Визуализировались разрыв межблизнецовой мембраны и коллизия пуповин; определялось тугое обвитие пуповиной и оболочками погибшего плода правой нижней конечности живого плода, на которой имелся выраженный (до 9 мм) отек голени и стопы. При допплерометрическом исследовании прослеживался сниженный кровоток в сосудах над и под участком сдавления, был отмечен нулевой диастолический кровоток в артериях голени плода (рис. 1).
Рис. 1. Сниженный кровоток в сосудах нижней конечности, прослеживающийся над и под участком сдавления. Иллюстрация авторов
Учитывая срок беременности, отсутствие технической возможности для внутриутробной коррекции СПАТ и наличие высокого риска ампутации дистального отдела правой голени плода, было принято решение об экстренном оперативном родоразрешении.
Пациентка была родоразрешена путем операции кесарева сечения в сроке 26 недель беременности в головном предлежании. Показатели физического развития ребенка (девочки) при рождении: масса — 890 г; длина тела — 29 см; окружность головы — 22,5 см; окружность груди — 21,0 см. Оценка по шкале Апгар — 3/6 баллов. Реанимационная помощь в родовом зале: согревание, интубация трахеи (ЭТТ № 2,5) на 60-й секунде, ИВЛ. На 4-й минуте эндотрахеально введено 120 мг порактанта альфа.
Ребенок переведен в отделение реанимации и интенсивной терапии новорожденных (ОРИТН) на ИВЛ. Состояние при поступлении в ОРИТН тяжелое за счет дыхательных, гемодинамических, неврологических нарушений на фоне глубокой недоношенности и незрелости, а также синдрома эндогенной интоксикации, связанного с цитолизом, высвобождением токсических продуктов и их поступлением в организм из очага ишемии. Сознание было угнетено, кома. Шоковое состояние характеризовалось падением уровня артериального давления, централизацией кровообращения, развитием дефицита объема циркулирующей крови. Ишемический токсикоз представлял непосредственную угрозу жизни и усугублял тяжесть состояния глубоко недоношенного ребенка.
Известно, что при развитии местной ишемии первыми страдают мышцы, более устойчивы к гипоксии кожа и подкожная клетчатка. В ишемизированных тканях, как правило, накапливаются токсические продукты миолиза (миоглобин, креатинин, ионы калия и кальция, лизосомальные ферменты и др.). Эндогенная интоксикация, а также непосредственное воздействие поступающих в кровоток продуктов цитолиза приводят к многочисленным полиорганным функциональным и морфологическим нарушениям, ведущее место среди них занимает острая почечная недостаточность.
Status localis пораженной конечности при рождении: правая голень и стопа увеличены в объеме, отечные, явления лимфостаза, кожа теплая, не изменена. Движения в голеностопном суставе и суставах пальцев отсутствуют.
Девочка консультирована хирургом в 1-е, 3-и, 13-е сутки жизни и в возрасте 2 месяцев 12 дней. Диагноз: Амниотическая перетяжка на уровне верхней трети правой голени. Эквиноварусная деформация правой стопы на фоне нарушения иннервации.
После консультации физиотерапевта проведено лечение: озокеритовые аппликации на область верхней трети правой голени № 10 и гель «Тизоль с лидазой» на область перетяжки № 15. Уже на 10-е сутки отмечалась выраженная положительная динамика. Status localis: отечность правой голени и стопы купировалась, нога при пальпации теплая, физиологической окраски, кожа не изменена, пассивные движения в голеностопном суставе и суставах пальцев в полном объеме. Признаки нарушения кровоснабжения и оттока лимфы из отделов конечностей, расположенных дистально по отношению к уровню перетяжки, отсутствовали. Результаты миографии в возрасте 3 месяцев 20 суток: моторная нейропатия правого малоберцового нерва (глубокая и поверхностная ветви), блок проведения на уровне головки малоберцовой кости по глубокой ветви.
Респираторная поддержка: ИВЛ с рождения до 26 суток жизни, затем продолжена респираторная поддержка BNCPAP до 32 суток, с 32 до 40 суток подача увлажненного подогретого кислорода через высокопоточные канюли. В возрасте 41 суток девочка переведена в отделение патологии новорожденных и недоношенных детей.
Для исключения хромосомных аномалий проведено медико-генетическое консультирование матери и ребенка, выполнено кариотипирование — отклонений от нормы не выявлено.
Девочка выписана из стационара в возрасте 95 суток. Постконцептуальный возраст (ПКВ) — 38–39 недель, масса тела — 2330 г (прибавка за 1-й месяц — 128,0 г, за 2-й месяц — 306,0 г, за 3-й месяц — 809,0 г, общая прибавка составила 1440,0 г), окружность головы — 30,5 см (+8 см с рождения). Состояние на момент выписки удовлетворительное. В условиях кроватки нормотермия. Вскармливание: грудное молоко до 55,0 мл, усваивает, не срыгивает. Прикладывается к груди. Восходящая весовая кривая. Реакция на осмотр адекватная, мышечный тонус в форме дистонии, рефлексы периода новорожденности вызываются, нестойкие. Сохраняется амниотическая перетяжка на уровне верхней трети правой голени. Объем активных движений в правой голени и стопе снижен, пассивные движения в полном объеме.
Выписана с диагнозом: Недоношенность 25–26 недель (ПКВ — 38–39 недель). Бронхолегочная дисплазия, классическая форма, легкая степень тяжести. Ишемически-геморрагическое поражение ЦНС тяжелой степени (субтотальная ишемия с формированием лейкомаляций 1-й степени; внутрижелудочковое кровоизлияние 2-й степени; врожденная нейропатия правого малоберцового нерва на фоне амниотической перетяжки; эквиноварусная деформация правой стопы). Цитомегаловирусная инфекция: гепатит (синдромы цитолиза, холестаза). Анемия недоношенных тяжелой степени (гемотрансфузия № 3). Ретинопатия недоношенных, 2-я стадия. Нарушение микрофлоры кишечника. Реконвалесцент кардиореспираторного дистресс-синдрома новорожденного, внутриутробной инфекции (пневмония), гипертрофической кардиомиопатии, стеноза выходящих отделов правого и левого желудочков. Экстремально низкая масса тела при рождении. Первый ребенок из монохориальной диамниотической двойни.
В настоящее время девочка растет и развивается в соответствии с ПКВ, состоит на диспансерном учете у невролога, хирурга, офтальмолога, кардиолога.
ОБСУЖДЕНИЕ
На базе ФГБУ «НИИ ОММ» МЗ РФ с 2012 по 2019 г. проведено 195 фетоскопических операций с целью коррекции СФФТ. Эффективность оперативного лечения за указанный период составила 78%, в последние годы достигнув 88–89%. СПАТ после ЛКПА отмечался дважды. Первый случай был зафиксирован у доношенного новорожденного и выражался в обвитии ножки разорвавшейся амниотической перегородкой. Отек стопы самостоятельно купировался в течение первых суток жизни. Второй случай, описанный выше, был диагностирован в результате динамической оценки плода после проведенной ЛКПА.
Оптимальная тактика лечения СПАТ на данный момент не определена. Выжидательная позиция с тщательным наблюдением за внутриутробным состоянием плода целесообразна, если нет угрозы внутриутробной гибели или ампутации конечностей. Хирургическая внутриутробная помощь актуальна, когда отмечается снижение интенсивности кровотока при допплеровских измерениях дистальнее зоны сжатия псевдоамниотическим тяжем и появляется отек конечности[17, 18].
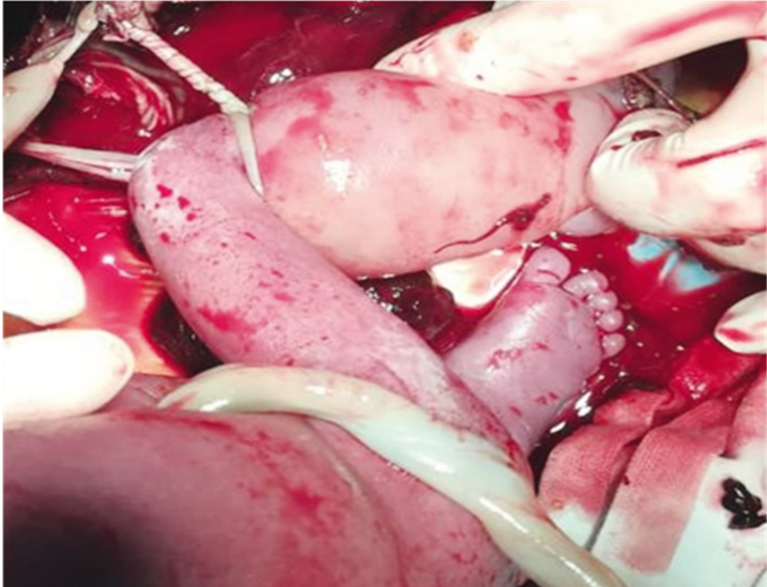
В описанном случае тяж представлял собой межблизнецовую амниотическую оболочку и пуповину погибшего плода, визуализировался как широкая гиперэхогенная структура, плотно опутывавшая ножку живого плода и обусловливавшая нарушение ее кровоснабжения, нулевой диастолический кровоток в артериях ниже уровня сжатия (рис. 2).
Рис. 2. Тяж, представляющий собой межблизнецовую амниотическую оболочку и пуповину погибшего плода. Иллюстрация авторов
Решение об экстренном оперативном родоразрешении определялось сроком беременности 26 недель и наличием пуповины и дупликатуры амниотической мембраны в составе псевдоамниотического тяжа (т. е. диаметром тяжа), что не позволило корригировать данную ситуацию внутриутробно. Состояние ребенка при рождении было тяжелым вследствие дыхательных, гемодинамических, неврологических нарушений на фоне глубокой недоношенности и незрелости, а также ввиду специфического варианта травмы, связанной с раздавливанием мягких тканей, сдавлением магистральных сосудов и нервов конечностей.
В патогенезе синдрома длительного сдавления наибольшее значение имеют три фактора, которые в той или иной степени присущи любой механической травме:
- регуляторная (нейрорефлекторная и нейрогуморальная) реакция организма на длительное болевое воздействие механической травмы;
- плазмопотеря, развивающаяся в результате прогрессивного нарастания отека поврежденных тканей и генерализованного увеличения капиллярной проницаемости;
- токсемия, обусловленная поступлением в общий кровоток продуктов метаболизма поврежденных тканей, прежде всего миоглобулина, накоплением их в организме в связи с нарушением процессов детоксикации и функции почек.
Осмотр хирурга в первые сутки после рождения и своевременно начатое местное физиотерапевтическое воздействие позволили избежать возникновения некроза тканей в области вдавления и иссечения рубцовых изменений пострадавшей конечности. Явления лимфостаза и отека подкожно-жировой клетчатки, возникшие дистальнее сдавления, достаточно быстро нивелировались. В результате лечения удалось избежать серьезной компрессии периферических нервов, развития паралича конечности по периферическому типу и атрофии мышц.
ЗАКЛЮЧЕНИЕ
- После хирургической коррекции синдрома фето-фетальной трансфузии УЗИ необходимо проводить каждые две недели — не только с целью определения состояния плода, но и для оценки экстраэмбриональных структур (межблизнецовой мембраны, пуповины, плаценты).
- Основным методом коррекции синдрома псевдоамниотических тяжей (СПАТ) является внутриутробное рассечение/иссечение перетяжек под фетоскопической навигацией. При диагностике СПАТ в сроках глубоко недоношенной беременности и состояниях, не угрожающих жизни плода и целостности его конечностей, возможна выжидательная тактика. В случаях, позволяющих рассчитывать на выхаживание новорожденного, при угрозе жизни плода и развитии редукционных поражений конечностей требуется экстренное родоразрешение.
- Представленный клинический случай демонстрирует своевременную диагностику СПАТ и оптимальную акушерскую тактику в сроке беременности пациентки.
- Терапию СПАТ следует рассматривать в том числе с позиции синдрома сдавления тканей. Коллегиальное ведение новорожденного совместно с хирургом, неврологом, физиотерапевтом позволило избежать серьезных осложнений и обеспечить восстановление функции пораженного органа.
Поступила: 11.03.2020
Принята к публикации: 06.05.2020








