ВВЕДЕНИЕ
Гипергликемия при беременности как проявление СД — одно из наиболее распространенных состояний, определяющих исход и течение процесса гестации[1, 2]. От матерей с различными формами гипергликемии сегодня на свет появляются 16,2% новорожденных. Важной медико-социальной проблемой является гестационный СД (ГСД), который неблагоприятно влияет на внутриутробное состояние плода, а также здоровье и развитие новорожденного в последующем[2–5]. На его долю приходится 85,1% всех случаев гипергликемии во время беременности. Значимую роль в формировании риска ГСД у молодых женщин играют метаболические нарушения, в первую очередь ожирение[6, 7].
Одно из наиболее ярких проявлений нарушения метаболической адаптации новорожденных — диабетическая фетопатия (ДФ), основным неинвазивным методом ее антенатальной диагностики считается УЗИ[2, 8]. На основании рекомендаций Российского консенсуса, к ультразвуковым критериям ДФ относятся крупный плод (диаметр живота плода > 75-го перцентиля), гепатоспленомегалия, кардиомегалия/кардиопатия, двухконтурность головки плода, отек и утолщение подкожно-жировой клетчатки, шейной складки, впервые выявленное или нарастающее многоводие при установленном диагнозе ГСД (в случае исключения других причин многоводия)[9]. Некоторые из признаков можно считать скрининговыми, например макросомию плода, однако не все они обладают достаточной информативностью[10]. Дети, рожденные с массой тела более 90-го перцентиля, входят в группу риска возникновения углеводных, метаболических и гипертензионных расстройств[11–13].
Один из наиболее спорных вопросов современного акушерства — выбор метода и сроков родоразрешения беременных с ГСД. По сути, нормативная база на сегодня представлена документами, которые нуждаются в расширении и дополнении[14]. Все это диктует необходимость дальнейшего научного поиска, направленного на оптимизацию акушерской тактики у матерей с ГСД путем улучшения методов диагностики внутриутробного состояния плода.
Цель нашего исследования — выявление наиболее значимых и менее вариабельных ультразвуковых маркеров ДФ у плодов пациенток с ГСД и создание математической модели ее прогнозирования.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в период с 2017 г. по I полугодие 2019 г. на клинической базе кафедры акушерства и гинекологии с курсом дополнительного профессионального образования ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России — в КГБУЗ «Алтайский краевой клинический перинатальный центр «ДАР» (главный врач — к. м. н. Молчанова И.В.). В отделении патологии беременных данного родовспомогательного учреждения III уровня концентрируются беременные Алтайского края с ГСД, специализированную помощь которым оказывают врачи акушеры-гинекологи и эндокринологи.
Критерии включения в исследование: ГСД при самопроизвольно наступившей одноплодной беременности, доношенный срок.
Критерии исключения: прегестационный СД, многоплодная беременность, наличие тяжелых акушерских осложнений (тяжелой преэклампсии), декомпенсированная плацентарная недостаточность, врожденные пороки развития плода.
Пациентки с диагностированным ГСД (n = 118) были разделены на две группы: группа I — 39 беременных, у плодов которых обнаружены ультразвуковые критерии ДФ; группа II — 79 беременных, у плодов которых указанные критерии не выявлены. Все женщины подписали добровольное информированное согласие на участие в исследовании. Протокол исследования одобрен локальным этическим комитетом ФГБОУ ВО АГМУ Минздрава России.
Диагноз ГСД устанавливали в соответствии с критериями, утвержденными Министерством здравоохранения РФ в виде клинических рекомендаций (2014)[9].
УЗИ фетоплацентарного комплекса у пациенток с диагностированным ГСД проведено за 3–7 дней до срочных родов на приборах Voluson E6 (Австрия) и Philips iU22 (Нидерланды), снабженных блоком цветового допплеровского картирования, объемным и конвексным датчиком с частотой 3,5–5 МГц. Диагностические исследования производили в В-режиме и М-режиме.
В В-режиме проведена оценка соответствия фетометрических показателей нормативным процентильным показателям для срока беременности[15]. Макросомия плода диагностировалась при предполагаемом весе более 4000 г при доношенной беременности или > 90-го перцентиля по таблицам внутриматочного роста плода[16].
Диагноз ДФ у новорожденного ставили при наличии фенотипических признаков и/или их сочетания с клинико-лабораторными признаками (признаки морфофункциональной незрелости, проявления дыхательной недостаточности, гипогликемия, гипомагниемия, гипокальциемия, гипербилирубинемия)[5, 16].
Статистическая обработка полученных данных осуществлялась с помощью пакета программ IBM SPSS Statistics Version 20,0. Результаты представлены в виде медианы и интерквартильного размаха (5-й и 95-й перцентили), средней величины ОШ и 95%-ного ДИ. Группы сравнивались с помощью рангового анализа вариаций по Краскелу — Уоллису с последующим парным сравнением групп тестом Манна — Уитни. Критический уровень значимости (р) принимался меньшим или равным 0,05.
Рассчитывали скорригированный коэффициент детерминации, показывающий долю объясняемой зависимости (определение значимости факторов риска ДФ). Для определения диагностической ценности прогностической модели использовалась ROC-кривая. В качестве регрессионной модели была выбрана регрессия с оптимальным шкалированием (Regression with Optimal Scaling, CATREG). Для каждого из включенных в регрессионную модель предикторов подсчитан его балл по следующему правилу: абсолютное значение соответствующего коэффициента важности умножено на 100 и округлено до целых.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Участницы групп сравнения были сопоставимы по социальному статусу, возрасту, акушерско-гинекологическому анамнезу, соматическому индексу, течению беременности и родов. Программированные роды в доношенном сроке 39,1–39,6 недели произошли у 18 (46,1%) и у 47 (59,5%) женщин в группах I и II соответственно (р > 0,05). Остальные пациентки родоразрешены путем кесарева сечения (p > 0,05). Основным показанием к оперативному родоразрешению в группе II являлся неполноценный рубец на матке, в группе I — наличие рубца на матке и/или ультразвуковые признаки ДФ при отсутствии биологической готовности к родам.
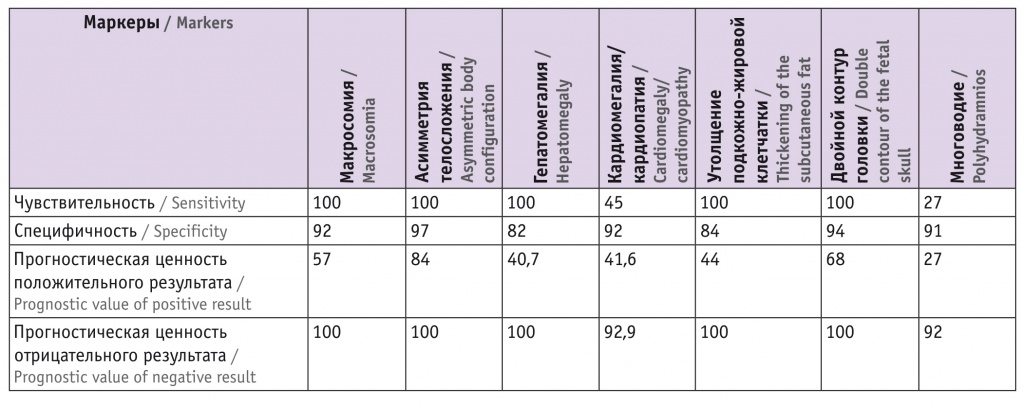
Информативность выявленных ультразвуковых маркеров ДФ у беременных группы I представлена в таблице 1. Большинство предложенных в клинических рекомендациях Минздрава РФ[9] маркеров обладают высокой чувствительностью, все имеют высокую специфичность и прогностическую ценность отрицательного результата, что сопоставимо с данными других авторов[8, 10, 11]. Однако стоит отметить, что в нашем исследовании диагноз ДФ постнатально подтверждался неонатологами только у 12 (10,2%) новорожденных.
Таблица 1
Информативность ультразвуковых маркеров диабетической фетопатии у плодов пациенток с гестационным сахарным диабетом, %
При сравнении частоты развития ДФ в зависимости от проведенной во время беременности терапии выявлены значимые различия (табл. 2).
Таблица 2
Частота диабетической фетопатии (ДФ) у новорожденных в зависимости от проведенной терапии матери, n (%)
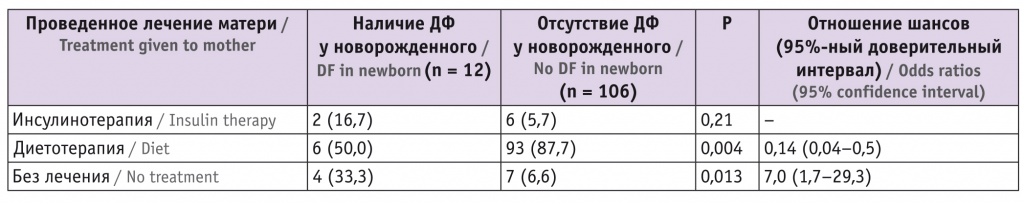
При своевременном назначении диетотерапии риск формирования ДФ у плода, а также рождения ребенка с массой тела более 90-го перцентиля снижается (ОШ = 0,14; 95%-ный ДИ: 0,04–0,5 и ОШ = 0,2; 95%-ный ДИ: 0,01–0,57 соответственно). При отсутствии лечения частота развития ДФ увеличивается в 7 раз (р = 0,013), а частота рождения детей с макросомией — в 3,86 раза (р = 0,045).
При изучении влияния проведенного лечения инсулином на формирование ДФ и макросомии статистически значимые различия между сравниваемыми группами не выявлены (р = 0,21 и р = 0,08 соответственно). Это объясняется тем фактом, что показанием к назначению инсулина служила не только гипергликемия, не поддающаяся коррекции диетой, но и наличие ультразвуковых маркеров ДФ.
Таким образом, назначение инсулина не приводило к изменению сформировавшегося на фоне гипергликемии фенотипа плода, однако позволяло пролонгировать беременность до оптимального срока.
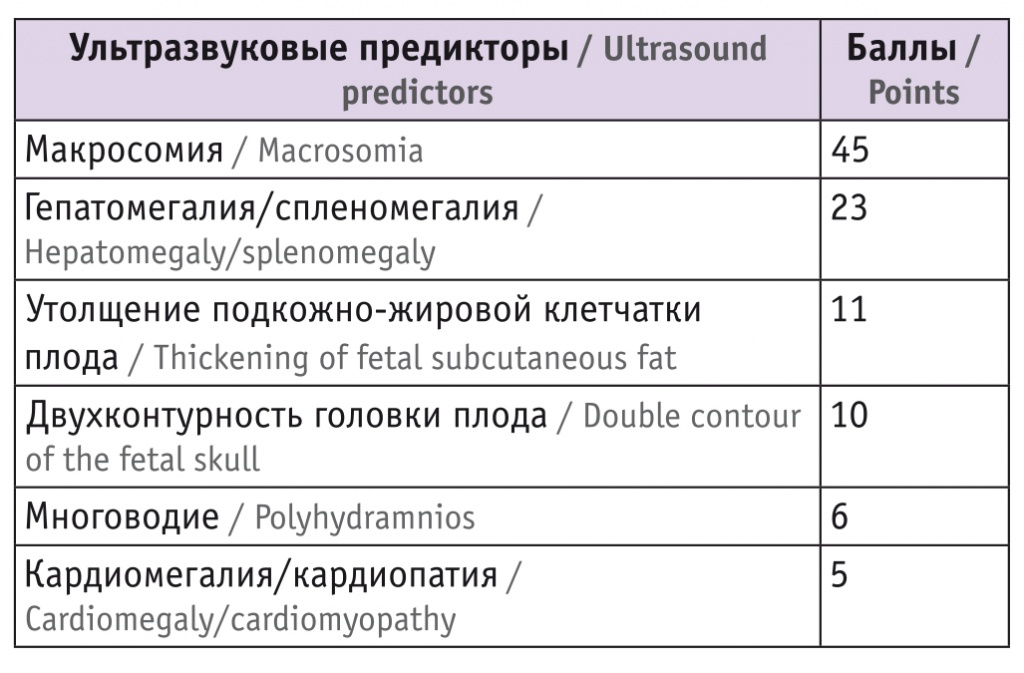
С помощью категориальной регрессии CATREG в программе IBM SPSS получены так называемые «коэффициенты важности» отдельных ультразвуковых маркеров. Для каждого из шести включенных в регрессионную модель предикторов ДФ подсчитан его балл по следующему правилу: абсолютное значение соответствующего коэффициента важности было умножено на 100 и округлено до целых, и разработана шкала диагностики ДФ (табл. 3). Пациент в зависимости от выявляемого предиктора и балла, соответствующего предиктору, набирал суммарную оценку, которая являлась числовым показателем вероятности того, что зависимая переменная (ДФ) примет значение «да» или «нет».
Таблица 3
Шкала диагностики диабетической фетопатии
С помощью ROC-анализа нами оценено качество модели прогнозирования ДФ (рис.).
Рис. ROC-кривая математической модели прогнозирования диабетической фетопатии
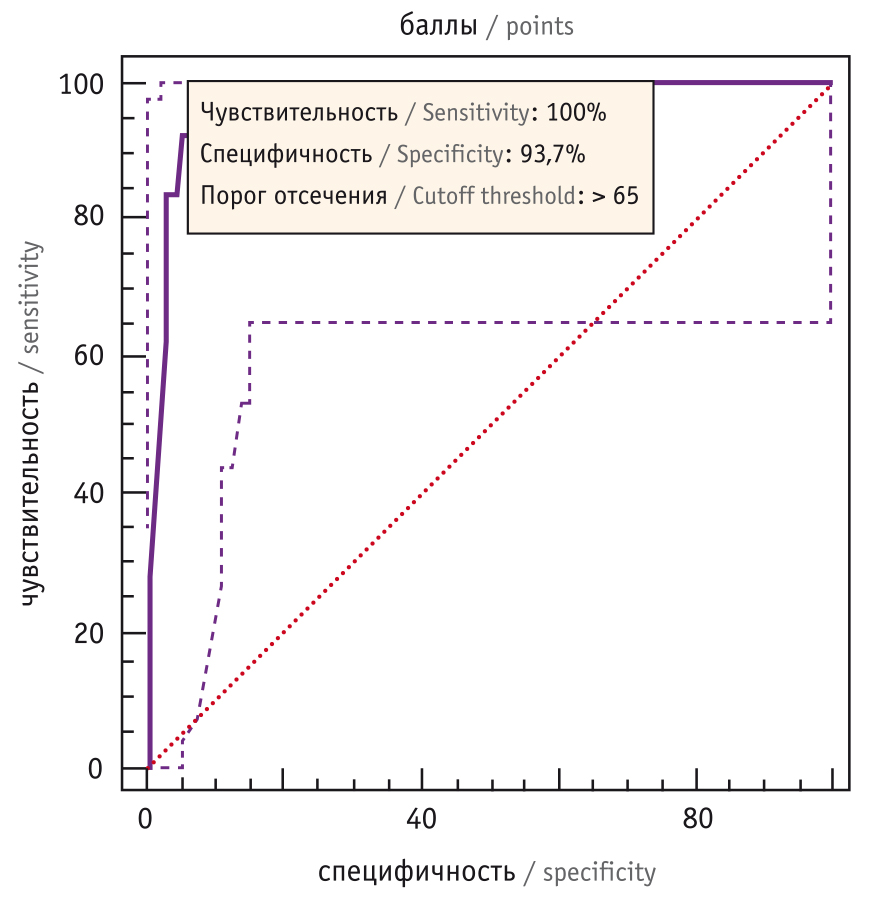
Площадь под ROC-кривой (AUC) = 0,978, что указывает на высокое качество данного классификатора; 95%-ный ДИ: 0,930–0,996 (р < 0,0001). Как видно из рисунка, чувствительность ROC-модели (доля истинно положительных результатов классификации — наличие ДФ) составляет 100%, специфичность (доля истинно отрицательных результатов — отсутствие ДФ) — 93,7%, что является высоким результатом. Порог отсечения (cut-off value), позволяющий разделить больных на две группы, соответствует значению 65. Результаты анализа показали, что набранные суммарные баллы оказывают статистически значимое влияние (χ2 = 51,2133; p < 0,0001) на итоги классификации.
Уравнение прогноза имело следующий вид:
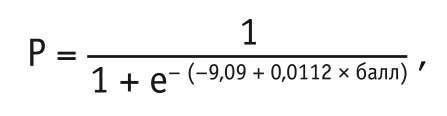
где Р — теоретическая вероятность развития фетопатии; балл — количество баллов, набранных плодом; 0,0112 — β-коэффициент регрессии; –9,09 — свободный член уравнения.
ЗАКЛЮЧЕНИЕ
Основным ультразвуковым маркером, обладающим высокой чувствительностью, специфичностью и прогностической ценностью положительного и отрицательного результата является асимметричная макросомия плода. Гепатомегалия, двойной контур головки, утолщение подкожно-жировой клетчатки плода обладают высокой чувствительностью и специфичностью, однако прогностическая ценность положительного результата у данных маркеров невысока.
Анализ адекватности полученной регрессионной модели, включающей шесть ультразвуковых предикторов диабетической фетопатии, из которых наиболее значимым признана макросомия (45 баллов), показал, что она достаточно эффективна как для предсказания ДФ (прогностическая ценность положительного результата — 83,3%), так и для прогноза ее отсутствия (прогностическая ценность отрицательного результата) (верно 96,9% случаев). Величина общего процента верных классификаций (95,4%) является высоким показателем, что говорит о хорошей прогностической способности данной регрессионной модели.
Поступила: 07.11.2019
Принята к публикации: 09.12.2019








