Синдром поликистозных яичников (СПКЯ) признан наиболее часто встречающейся эндокринопатией среди женщин репродуктивного возраста[1–6]. Распространенность СПКЯ существенно варьирует и неодинакова в различных популяциях. В частности, она различается в городских и сельских поселениях[7], а также зависит от расовой и этнической принадлежности[8, 9]. Среди женщин, обращающихся в медицинские учреждения, частота СПКЯ значительно выше популяционной и составляет от 46% по критериям диагностики Национальных институтов здоровья США (англ. National Institutes of Health, NIH) до 73,3% по Роттердамским критериям диагностики (описание критериев см. ниже. — Прим. авт.). В неселективной с медицинской точки зрения популяции женщин репродуктивного возраста распространенность СПКЯ по вышеназванным критериям колеблется от 4–6,6% до 6–21% соответственно[1, 5, 8, 10].
СПКЯ встречается у каждой четвертой пациентки с ожирением[11], а при клинических проявлениях гиперандрогенизма его частота достигает 72,6%[12].
СПКЯ характеризуется гиперандрогенией (ГА) и сложным спектром репродуктивных расстройств, таких как менструальная дисфункция, невынашивание беременности, бесплодие[13], а также ассоциирован с повышенным риском метаболических нарушений, в том числе инсулинорезистентности и сахарного диабета 2 типа[14]. Кроме того, существует связь между СПКЯ и риском развития карциномы эндометрия, сердечно-сосудистых и церебральных катастроф[15], депрессии и психосексуальных расстройств[16], апноэ сна[3, 17]. Беременность у женщин с СПКЯ сопряжена с повышенным риском развития акушерских и перинатальных осложнений, включая гестационный диабет с макросомией плода[17]. Имеются сведения о том, что СПКЯ ассоциирован с более высокой частотой госпитализаций, не связанных с травмами и акушерскими факторами[3].
Первые описания СПКЯ опубликованы много лет назад[18, 19], тем не менее этиология и патофизиология этого расстройства продолжают активно изучаться. Доказана многофакторность СПКЯ[20], подчеркнуто значение генетических и эпигенетических факторов в его развитии[21].
К основным механизмам патогенеза СПКЯ относят нарушения стероидпродуцирующей функции яичников[22] с увеличением продукции андрогенов и нарушением их преобразования в эстрогены, а также повышение уровня свободного тестостерона на фоне низкого содержания глобулина, связывающего половые гормоны (ГСПГ)[23]. В свою очередь, гиперандрогенизм ассоциирован с абдоминальным типом ожирения и изменениями липидного профиля[24]. Кроме того, СПКЯ характеризуется наличием гонадотропной дисфункции, что закономерно приводит к ановуляции или как минимум к недостаточности прогестерона[22]. Наряду с этим ановуляция и мелкокистозная трансформация яичников являются следствием так называемого фолликулярного ареста, ассоциированного с чрезмерной секрецией антимюллерового гормона (АМГ). 50–90% женщин с СПКЯ имеют гиперинсулинемию и инсулинорезистентность[14], которые усугубляют гиперандрогенизм, ожирение и овариальную дисфункцию[25].
Гиперандрогенизм и висцеральный тип ожирения, свойственные пациенткам с СПКЯ, сопровождаются дисбалансом между провоспалительными медиаторами, противовоспалительнымим цитокинами и, как следствие, хроническим системным воспалением и окислительным стрессом[26, 27]. Причем степень проявления системного воспалительного ответа прямо пропорциональна степени ожирения и ИМТ[28], тогда как выраженность окислительного стресса при СПКЯ от ИМТ не зависит[26]. Однако в клинической практике определение маркеров хронического воспаления и оксидативного стресса пока не распространено.
Исторически диагностика СПКЯ основана на критериях, утвержденных и представленных в различных консенсусах. Первые согласованные подходы к диагностике СПКЯ были предложены в апреле 1990 г. Национальным институтом здоровья детей и развития человека им. Юнис Кеннеди Шрайвер (англ. Eunice Kennedy Shriver National Institute of Child Health and Human Development, NICHD), входящим в состав NIH[29]. В 2003 г. в Роттердаме экспертами Европейского общества репродукции человека и эмбриологии (англ. European Society of Human Reproduction and Embryology) и Американского общества репродуктивной медицины (англ. American Society of Reproductive Medicine, ASRM) были приняты новые критерии диагностики СПКЯ[30]. В 2006 г. свою версию критериев предложили эксперты Общества по гиперандрогениям и СПКЯ (англ. Androgen Excess and PCOS Society, AE-PCOS)[31]. Последнее руководство, посвященное диагностике СПКЯ и ведению пациенток с этим синдромом, было опубликовано в 2018 г.[3].
Согласно критериям NIH (1990), необходимым условием для диагностики СПКЯ являлось наличие олиго-/ановуляции и гиперандрогенизма (после исключения состояний с похожими симптомами)[29]. При этом обнаружение поликистозной структуры яичников по УЗИ не рассматривалось как обязательный признак СПКЯ. После принятия Роттердамского консенсуса (2003) диагностически значимым стало считаться наличие как минимум двух признаков из трех: олиго-/ановуляции, поликистозной структуры яичников, клинического и/или биохимического гиперандрогенизма. Введение данных критериев закономерно привело к увеличению частоты выявления СПКЯ за счет неандрогенного и овуляторного фенотипов. Критерии СПКЯ, принятые AE-PCOS (2006), концентрировались на проявлениях гиперандрогенизма, который был признан необходимым признаком СПКЯ. По мнению экспертов АE-PCOS, СПКЯ следовало диагностировать при обязательном наличии гиперандрогенизма в сочетании с менструальной и овуляторной дисфункцией и/или поликистозной структурой яичников по данным УЗИ[32]. В результате последующих обсуждений было принято решение рекомендовать для диагностики СПКЯ Роттердамский подход, охватывающий критерии как NIH (1990), так и AE-PCOS (2006), с обязательной идентификацией фенотипа СПКЯ[33].
Предложена следующая классификация фенотипов СПКЯ:
- фенотип А — все признаки СПКЯ (клинический гиперандрогенизм и/или гиперандрогенемия, овуляторная дисфункция и поликистозные яичники по данным ультрасонографии);
- фенотип B — ГА и олиго-/ановуляция;
- фенотип C — ГА и поликистозная структура яичников по данным УЗИ;
- фенотип D — олиго-/ановуляция и поликистозная структура яичников по данным ультрасонографии[33].
Фенотип А (классический) считается наиболее тяжелым: он характеризуется всеми тремя Роттердамскими критериями. Ожирение и инсулинорезистентность, высокий уровень АМГ, хотя и не входят в диагностические критерии, тесно связаны с этим фенотипом[33].
Фенотип В (также классический (NIH) фенотип) отличается выраженной менструальной дисфункцией и характеризуется более высокой частотой инсулинорезистентности и метаболических нарушений по сравнению с негиперандрогенными формами СПКЯ[3, 33].
При фенотипе С (овуляторном) пациентки имеют повышенные уровни андрогенов и липидов в сыворотке крови[33], а также умеренную гиперинсулинемию с более низкой частотой метаболического синдрома и гирсутизма, чем при прочих фенотипах СПКЯ.
У пациенток с фенотипом D (неандрогенным) в нескольких исследованиях показаны максимальное количество регулярных менструальных циклов, наиболее низкая степень метаболических нарушений[3, 23]. У этих женщин регистрируются более низкие значения тестостерона и соотношения ЛГ/ФСГ в сыворотке крови, но значительно более высокие уровни ГСПГ в сравнении с пациентками с классическими фенотипами СПКЯ[34].
Некоторые данные свидетельствуют о том, что женщины с фенотипами СПКЯ A и B имеют более высокий риск стеатоза печени, чем пациентки с негиперандрогенным фенотипом заболевания и здоровые женщины. Самые высокие уровни АМГ также обнаружены в группах с классическими фенотипами СПКЯ[3].
В настоящее время диагностика синдрома основана на клинических и биохимических проявлениях ГА и овуляторной дисфункции, а также на результатах оценки ультразвуковой структуры яичников. Обновленные подходы к диагностике представлены в новом консенсусе (2018), который включает в себя рекомендации, базирующиеся на фактических данных, и затрагивает основные клинико-диагностические и лечебные аспекты СПКЯ[3].
Клиническими проявлениями гиперандрогенизма являются гирсутизм и (в меньшей степени) алопеция и акне. Термин «гирсутизм» означает чрезмерный рост терминальных волос у женщин и детей с мужским типом распределения. Для оценки гирсутизма в качестве показателя клинического гиперандрогенизма в настоящее время рекомендована стандартизированная модифицированная визуальная шкала Ферримана — Галлвея (D. Ferriman — J. Gallwey, mFG)[35]. При осмотре пациенток с подозрением на гирсутизм клиницисты должны оценивать наличие именно терминальных волос по мужскому типу оволосения на девяти различных участках тела (верхняя губа, подбородок, грудь, верхняя часть спины, нижняя часть спины, верхняя часть живота, нижняя часть живота, плечо, бедро) (рис. 1)[35, 36].
Рис. 1. Схематическое представление модифицированной шкалы Ферримана — Галлвея. Воспроизводится с разрешения авторов[36]
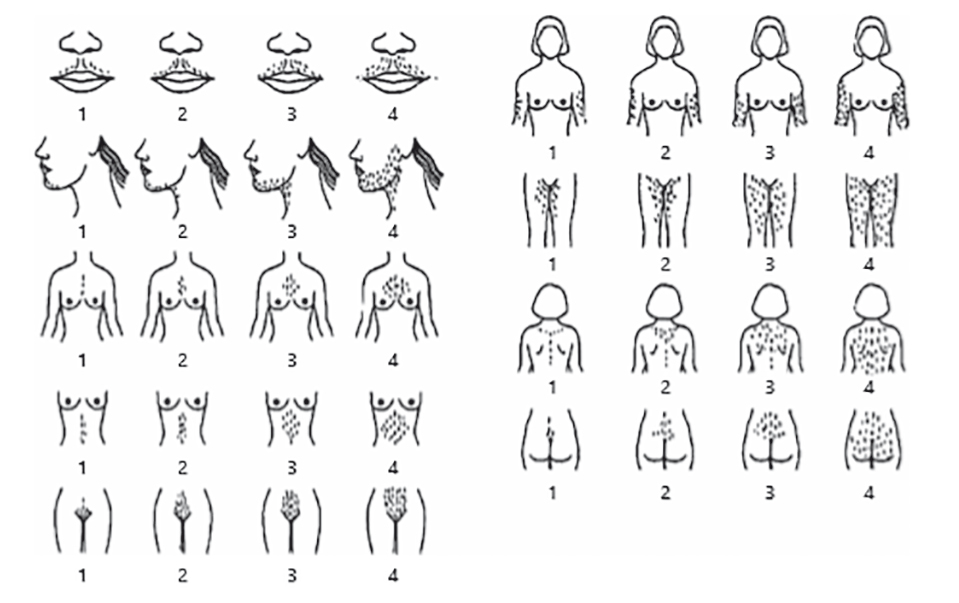
Сумма баллов по шкале mFG ≥ 6 указывает на гирсутизм[3]. Однако пороговое значение mFG при диагностике гирсутизма может различаться в зависимости, например, от расы (табл.).
Таблица
Критерии диагностики гирсутизма по шкале Ферримана — Галлвея в различных популяциях
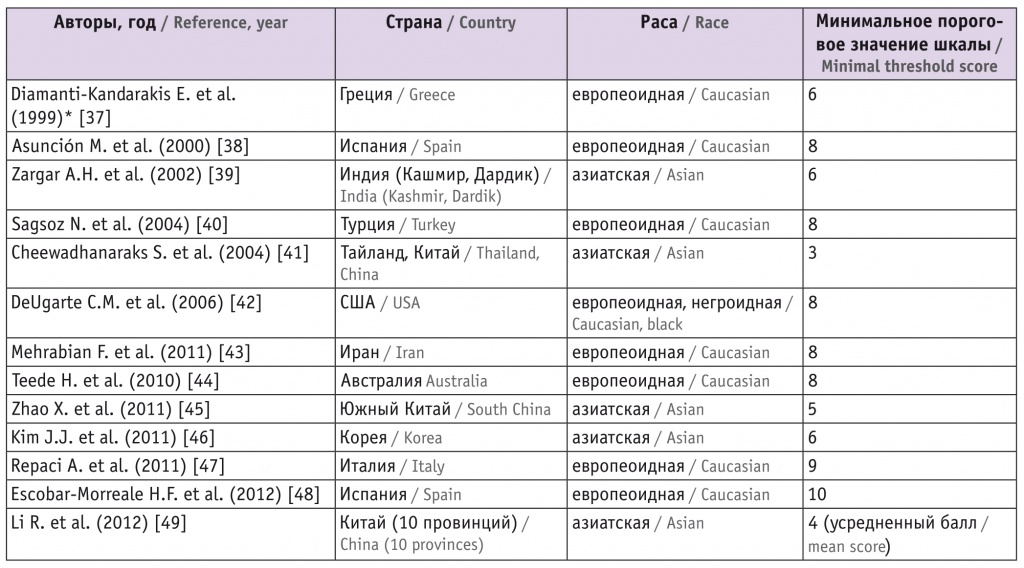
Примечание. Знаком (*) отмечена работа, основанная на данных оригинальной шкалы Ферримана — Галлвея, в остальных случаях применялась модифицированная версия шкалы (mFG).
Избыточный рост волос сам по себе не всегда является отражением ГА и может быть обусловлен семейными/этническими особенностями, отклонениями в выработке кортикостероидов и гормона роста, нарушением функции щитовидной железы, гиперпролактинемией или применением лекарственных препаратов. Гирсутизм необходимо отличать от гипертрихоза, который чаще характеризуется локализованным ростом мягких тонких волос (преимущественно на предплечьях или голенях), хотя возможен и их генерализованный избыточный рост. Иногда у пациентки наблюдается как гирсутизм, так и гипертрихоз. Гипертрихоз обычно не является следствием гиперандрогенизма, но гиперандрогенемия может усугубить его[36].
Шкала mFG имеет недостатки, связанные с субъективностью оценки состояния по ней как со стороны пациентки, так и, в меньшей степени, со стороны врача. При самооценке пациентке сложно оценить степень гирсутизма в труднодоступных для осмотра местах (например, в области ягодиц), тогда как врач может испытывать затруднения, оценивая выраженность гирсутизма, если пациенткой используются различные способы удаления волос. Таким образом, полезно проводить как самооценку[50], так и подсчет баллов опытным специалистом[51].
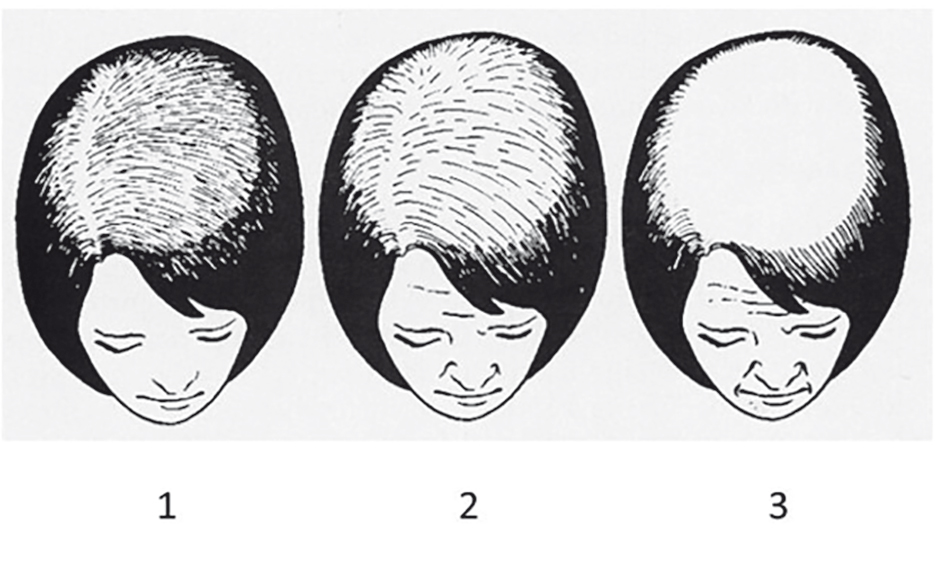
Для оценки алопеции принята стандартная визуальная шкала Людвига (рис. 2)[3].
Рис. 2. Стадии андрогенной алопеции по шкале Людвига[3]
Наличие акне при диагностике ГА принимается во внимание только в случаях его сочетания с другими проявлениями заболевания, в частности с гирсутизмом.
Оценка биохимического гиперандрогенизма наиболее актуальна при постановке диагноза СПКЯ и/или определении фенотипа в тех случаях, когда клинические признаки ГА (в частности, гирсутизм) слабо выражены или отсутствуют, например в азиатских популяциях.
Характерной особенностью СПКЯ является избыток тестостерона. На современном этапе оптимальным методом оценки концентраций общего тестостерона считается жидкостная хроматография с масс-спектрометрией. Кроме того, для диагностики гиперандрогенемии рекомендуется определение содержания свободного/биодоступного тестостерона с применением расчетных методов. При нормальных концентрациях общего и свободного тестостерона дополнительными маркерами ГА при СПКЯ могут быть повышенные уровни андростендиона и дегидроэпиандростерона[3].
Диагностика олиго-/ановуляции, овариальной дисфункции основана на оценке менструальной и/или овуляторной функции. В репродуктивном возрасте нарушенным считается менструальный цикл продолжительностью менее 21 или более 35 дней, так как доказано, что это коррелирует с олиго-/ановуляцией. Диагностическое значение имеет также наличие в анамнезе менее 8 менструальных циклов в год. При нормальной длительности менструального цикла необходимо оценивать овуляторную функцию путем не менее чем двукратного измерения уровня прогестерона в лютеиновую фазу[3].
В клинической оценке структуры яичников у сексуально активных женщин стандартом является трансвагинальное УЗИ. При использовании датчика частотой 8 МГц основаниями для диагностики поликистозных яичников считаются наличие 20 и более фолликулов хотя бы в одном яичнике, а также объем яичников, равный 10 мл и более, при присутствии доминантных фолликулов, кист или желтых тел. Подчеркнуто, что для диагностики СПКЯ объем яичников — значительно более надежный параметр, чем число фолликулов, особенно при использовании ультразвуковой аппаратуры, не обладающей современными характеристиками. У пациенток с ГА и нерегулярными менструальными циклами УЗИ органов малого таза не является необходимым для постановки диагноза СПКЯ, однако имеет значение для уточнения клинического фенотипа заболевания. Кроме того, в консенсусе 2018 г. протокол УЗИ органов малого таза рекомендован для повышения качества исследования[3].
Известно, что пациентки с СПКЯ имеют более высокие уровни АМГ, чем здоровые женщины[52], доказана корреляция концентрации АМГ с количеством антральных фолликулов вне зависимости от менструального цикла[52]. Появилась гипотеза о том, что AMГ может быть не просто маркером количества фолликулов, а эндокринным сигналом, играющим ключевую роль в патогенезе СПКЯ[53]. Замечено также, что уровень АМГ снижается с возрастом, при уменьшении клинических проявлений СПКЯ[54]. В связи с этим некоторые авторы рассматривают АМГ как биомаркер СПКЯ, и овариальной дисфункции в частности[55, 56]. Однако данный маркер не используется в рутинной клинической практике из-за недостаточной надежности лабораторных тест-систем[57], изменчивости уровней гормона[54].
У пациенток с СПКЯ, независимо от степени ожирения, типа распределения жировой ткани и уровней андрогенов, часто выявляются резистентность к инсулину и гиперинсулинемия. Женщины с СПКЯ имеют высокий риск развития нарушения толерантности к глюкозе и сахарного диабета 2 типа[3]. В связи с вышеизложенным у всех женщин с СПКЯ должен оцениваться исходный гликемический статус[3]. Диагностика нарушений углеводного обмена основана на определении уровней глюкозы и гликированного гемоглобина в плазме крови натощак.
У женщин с СПКЯ группы высокого риска рекомендуется проведение перорального теста на толерантность к глюкозе[3]. К группе риска относятся женщины европеоидной расы с ИМТ более 25 кг/м2 и азиатской расы с ИМТ более 23 кг/м2, пациентки с нарушениями углеводного обмена (гипергликемией натощак, нарушением толерантности к глюкозе или гестационным диабетом) в анамнезе, женщины с отягощенным семейным анамнезом по сахарному диабету и гипертонической болезни, а также представительницы этнических групп с высоким риском нарушений углеводного обмена[3]. Учитывая риск гестационного диабета, всем женщинам с СПКЯ следует предлагать тест на толерантность к глюкозе при планировании беременности или обращении по поводу бесплодия[3].
Появляется все больше подтверждений того, что обструктивное апноэ во сне (ОА) должно рассматриваться в качестве фактора риска кардиометаболических нарушений при СПКЯ. OА является относительно распространенным синдромом, характеризующимся хроническим нарушением сна в виде рецидивирующей полной (апноэ) или частичной (гипопноэ) обструкции верхних дыхательных путей во время сна. Стандартным диагностическим тестом в отношении OA признана ночная полисомнография. Тяжесть ОА обычно оценивают по индексу апноэ-гипопноэ, который представляет собой общее количество эпизодов апноэ и гипопноэ за час сна, зафиксированное во время полисомнографии. OA проявляется чрезмерной сонливостью в дневное время, когнитивной дисфункцией, снижением качества жизни и повышением риска несчастных случаев. Существуют также убедительные доказательства того, что ОА способствует развитию артериальной гипертензии, сердечно-сосудистых заболеваний, нарушений углеводного обмена. Доказано, что у взрослых пациенток с СПКЯ риск развития ОА в 9,74 раза выше, чем у женщин аналогичного возраста, не имеющих этого заболевания[58].
Чтобы своевременно выявить симптомы, связанные с ОА (храп, ощущение утомления и усталости после сна, сонливость и разбитость в дневное время, признаки депрессии), рекомендуется проводить скрининг пациенток с СПКЯ, используя соответствующие опросники. Пациенткам, вошедшим в группу риска по ОА, рекомендовано дальнейшее обследование с помощью ночной полисомнографии[3].
Первые ссылки на связь рака эндометрия и СПКЯ были опубликованы в 1949 г., всего через 14 лет после первого классического описания СПКЯ Ф. Штейном и М. Левенталем[19]. В современных исследованиях также отмечена высокая частота встречаемости гистологически подтвержденных патологих состояний эндометрия, в том числе хронического эндометрита, у таких больных[59]. У пациенток с классическим (по критериям NIH) СПКЯ риск развития рака эндометрия в ≤ 6 раз превышает популяционный[60], причем часто сохраняется до менопаузы. Вместе с тем в большинстве случаев опухоли являются высокодифференцированными и имеют благоприятный прогноз[61]. Наличие аномального эндометрия у пациенток, имеющих СПКЯ и нарушение в связи с этим процессов децидуализации и плацентации[62], сопровождается более частым развитием патологии беременности: невынашивания, преждевременных родов, преэклампсии и артериальной гипертензии беременных[63].
Для своевременного выявления патологических состояний эндометрия при СПКЯ проводится обследование с помощью трансвагинального УЗИ. Пациенткам с утолщенным эндометрием и/или имеющим факторы риска, например длительную аменорею, аномальные маточные кровотечения или лишний вес, рекомендуется биопсия эндометрия. Вместе с тем стандартизованных критериев и алгоритмов формирования групп риска для своевременного выявления патологических состояний эндометрия и прогнозирования клинических исходов у женщин с СПКЯ до настоящего времени не разработано. Поэтому предложено информировать пациенток с синдромом об имеющихся у них рисках[61].
Внимание исследователей традиционно привлекает связь СПКЯ с депрессивными и тревожными симптомами. В различных странах и регионах проведено больше 30 исследований, в которых оценивались риски возникновения умеренных и тяжелых симптомов депрессии у женщин при наличии и отсутствии СПКЯ. В результате было отмечено, что у пациенток с СПКЯ вероятность возникновения депрессии выше, чем у женщин, не имеющих этого синдрома. Однако исследования имели недостатки, основным из которых стало то, что авторы сравнивали госпитальные группы с контролем из популяции[64]. Кроме того, остаются недостаточно изученными географические и расовые особенности распространенности депрессии у пациенток с СПКЯ.
Согласно последним рекомендациям (2018), следует выполнять скрининг тревожных и депрессивных симптомов у всех женщин при постановке диагноза СПКЯ[3]. В случае выявления эмоционального неблагополучия предложено привлекать квалифицированных специалистов и проводить психологическую терапию или фармакологическое лечение в соответствии с региональными практическими рекомендациями. Однако до настоящего времени не определен оптимальный интервал для осуществления скрининга тревожных и депрессивных симптомов у пациенток с СПКЯ. Кроме того, при скрининге необходимо учитывать сопровождающие СПКЯ факторы риска эмоциональных нарушений (такие как бесплодие, невынашивание беременности, ожирение, гирсутизм), а также принимать во внимание использование препаратов, способных провоцировать и усугублять депрессивные расстройства.
ЗАКЛЮЧЕНИЕ
Синдром поликистозных яичников (СПКЯ) представляет собой гетерогенное заболевание со сложным этиопатогенезом, включающим в себя генетические, эпигенетические, этнические компоненты, которые при взаимодействии друг с другом участвуют в формировании фенотипа и определяют отдаленные последствия синдрома.
Основными проявлениями СПКЯ являются гиперандрогенизм, овариальная и/или овуляторная дисфункция и поликистозные изменения яичников. У значительного числа пациенток с СПКЯ имеются инсулинорезистентность, гиперинсулинемия и повышенный риск развития метаболических осложнений, а также репродуктивных нарушений и патологических состояний эндометрия. Женщины с СПКЯ подвержены риску развития депрессивных состояний, которые коррелируют с избытком андрогенов и гиперинсулинизмом; депрессии характеризуются хроническим течением и обусловливают снижение качества жизни.
Таким образом, современные подходы к диагностике СПКЯ предусматривают оценку основных клинических проявлений заболевания, а также исключение состояний со сходной симптоматикой и обязательную верификацию клинического фенотипа СПКЯ. Принимая во внимание повышенные риски нарушений углеводного обмена, сердечно-сосудистых заболеваний и депрессивных состояний при СПКЯ (особенно у женщин с ожирением), ведение пациенток следует осуществлять на междисциплинарной основе.
Своевременная диагностика СПКЯ является необходимым условием раннего начала терапии и, соответственно, профилактики его осложнений.
Поступила: 09.01.2020
Принята к публикации: 30.03.2020








