ВВЕДЕНИЕ
Новые молекулярно-генетические методы находят все более широкое применение в клинической медицинской практике. Это связано с тем, что с их использованием открываются новые возможности в диагностике и профилактике генетических заболеваний, в понимании механизмов их развития, а также возможность подбора индивидуальной схемы лечения для конкретного человека.
Одним из направлений применения молекулярно-генетических исследований является выявление хромосомных болезней (ХБ), этиологическая причина которых — нарушение количества или структуры хромосом. ХБ занимают одно из ведущих мест среди причин врожденной и наследственной патологии и зачастую проявляются тяжелыми инвалидизирующими состояниями у ребенка[1].
Однако сбалансированные хромосомные перестройки (СХП) чаще всего фенотипически нейтральны для носителей и проявляются бесплодием, ранними репродуктивными потерями или рождением ребенка с хромосомной патологией. Это обусловлено тем, что в мейозе у носителей СХП возможно формирование несбалансированных гамет и, как следствие, эмбриона с полной анеуплоидией или сегментарными нарушениями генетического материала[2].
Обнаружение структурных хромосомных перестроек у эмбриона или плода служит показанием для кариотипирования супругов, если раньше им его не проводили[3]. По различным данным, от 1,8% до 8%[4, 5] пациентов с нарушением репродуктивной функции (НРФ) являются носителями различных ХП, самые частые из которых — транслокации. Частота носителей транслокаций оценивается как 1 на 600 супружеских пар[6].
Таким образом, исследование кариотипа у пациентов с НРФ — «золотой стандарт» и необходимый этап обследования супружеских пар перед планированием беременности. Это тем более важно, поскольку, несмотря на появление новых геномных технологий, кариотипирование — один из немногих инструментов, способных выявлять СХП. Тем не менее, являясь отправной точкой в лабораторной диагностике репродуктивных проблем, стандартное цитогенетическое исследование (СЦИ) — трудоемкий процесс, связанный с длительным культивированием клеток крови. В настоящее время отсутствует автоматизация процесса получения метафазных хромосом.
Большое значение в кариотипировании имеет субъективизм исследователя. Все эти факторы могут стать причинами ошибок в исследовании кариотипа. В ряде случаев выявить точную ХП у пары с НРФ возможно только после обследования их эмбрионов или абортного материала.
Классическим методом профилактики рождения больного ребенка у пациентов с ХП является пренатальная генетическая диагностика, которая осуществляется во время беременности, в случае если эта беременность сохранится до срока ее проведения. При выявлении у плода аномального кариотипа беременность прерывают, что наносит вред репродуктивному и психологическому здоровью женщины. Поэтому в последнее время пациентам с изменениями в кариотипе предлагают пройти программу ЭКО с преимплантационным генетическим тестированием структурных перестроек (ПГТ-СП) у эмбрионов до переноса их в полость матки женщины.
Самым современным методом генетического тестирования эмбрионов, который может определять анеуплоидии и несбалансированные хромосомные патологии одновременно, является метод высокопроизводительного секвенирования (Next Generation Sequencing, NGS). Сейчас он все больше вытесняет другие методы ПГТ и активно внедряется в широкую практику клиник ВРТ за рубежом и в России. ПГТ-СП методом NGS завоевывает все бо́льшую популярность при диагностике хромосомной патологии у эмбрионов пациентов с аберрациями кариотипа.
На успешное использование NGS у пациентов с НРФ указывают многочисленные публикации авторов из разных стран, которые показали, что ПГТ методом NGS повышает эффективность программы ВРТ у пациентов не только с измененными кариотипами, но и с неудачными программами ЭКО в анамнезе, при невынашивании беременности, у других групп больных с НРФ и даже у фертильных супружеских пар[7].
Принцип метода NGS основан на определении последовательности нуклеиновых кислот, что отличает его от других методов и делает самым точным при проведении ПГТ.
В данной статье представлены два клинических случая проведения ПГТ методом NGS у супружеских пар с НРФ. На момент включения пар в программу ВРТ в одной из них был определен нормальный кариотип супругов, в другой у женщины отмечали реципрокную транслокацию между 2 и 7 хромосомами: 46,XX,t(2;7)(p21;q36).
СЦИ выполняли на фитогемагглютинин-стимулированных лимфоцитах периферической крови, культивированных 72 часа в соответствии с принятым протоколом[8]. Для визуализации бэндинга хромосом использовали метод GTG-окрашивания. Анализировали от 11 до 30 метафазных пластинок.
Для визуализации метафазных GTG-окрашенных хромосом применяли микроскоп Nikon Eclipse Ci (Nikon Corporation, Япония) с программным обеспечением «ВидеоТесТ-Карио 3.1» («Видеотест», Россия).
Результаты исследований записывали в соответствии с Международной номенклатурой[9].
Для проведения ПГТ эмбрионов использовали реагенты (VeriSeq PGS Kit) и программу анализа полученных данных секвенирования (программное обеспечение (ПО) BlueFuse Multi). Данное решение позволило провести исследование от получения ДНК из клеток трофэктодермы и пробоподготовки до биоформатического анализа полученных данных (ПО BlueFuse Multi).
Показатель качества подготовки образцов — концентрация полученной двухцепочечной библиотеки. Показателем качества исходного образца и в конечном счете качества полученных данных является ряд параметров, отображаемых в ПО для анализа результатов: количество и качество данных, полученных в запуске, абсолютное количество прочтений для каждого образца, эффективность выравнивания ридов и т. д.
ПГТ осуществлялось методом NGS на приборе MiSeq компании Illumina с применением коммерческого набора VeriSeq PGS Kit. Результаты, полученные прибором, обрабатывали с помощью ПО BlueFuse Multi.
Для тестирования брали клетки 5–6-дневных эмбрионов, полученных в программе ВРТ. Все эмбрионы были получены после оплодотворения методом ИКСИ. Перед секвенированием осуществляли полногеномную амплификацию ДНК клеток трофэктодермы. Анализ качества полученного продукта WGA проводили с помощью электрофореза.
КЛИНИЧЕСКИЙ СЛУЧАЙ 1
Пациентка С.В.В., 1985 г. р., впервые обратилась в отделение ВРТ в сентябре 2014 года с жалобами на невынашивание беременности и ненаступление беременности в течение последнего года.
Менструальная функция: менструации с 13 лет, установились сразу, через 30 дней, по 6–7 дней, регулярные, умеренные, безболезненные.
Беременностей три, все закончившиеся самопроизвольными абортами в 2008, 2009, 2013 годах, анэмбриония. Цитогенетический анализ ткани абортусов не проводился.
Гинекологические операции: лапароскопия в июне 2008 года, удаление параовариальной кисты диаметром 5 см справа. Маточные трубы и яичники не изменены.
Брак первый, в течение 10 лет. Детей у мужа 35 лет нет. В спермограмме отмечали нормозооспермию.
Кариотип супругов на момент включения в программу ВРТ нормальный: муж — 46,XY, жена — 46,ХХ.
У женщины проведены три программы ВРТ: две со своими яйцеклетками и одна с донорскими.
Протокол ЭКО № 1. Короткий протокол. При трансвагинальной пункции (ТВП) получены 14 ооцит-кумулюсных комплексов (ОКК), из которых 5 развились до бластоцисты к 5-му дню. На 5-е сутки развития была проведена биопсия трофэктодермы с последующей витрификацией методом Китазато. Перенос эмбрионов в стимулированном цикле не проводился.
Результат исследования хромосомного набора методом NGS 5 эмбрионов показал наличие 2 здоровых эмбрионов на день исследования: один мужского пола, другой — женского. В остальных эмбрионах выявлена анеуплоидия различных хромосом или сегментов (табл. 1).
Таблица 1
Результаты исследования 5 эмбрионов пациентки С.В.В.
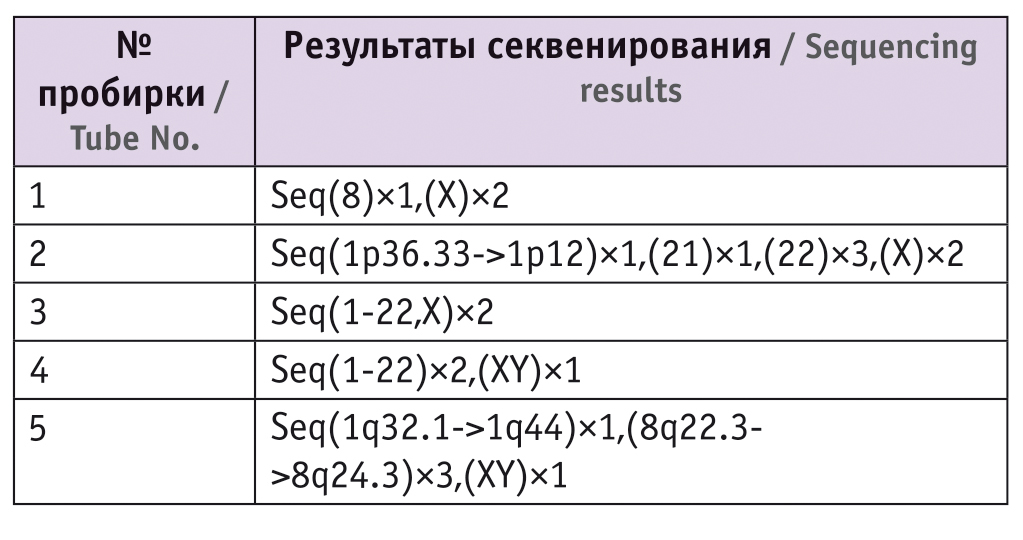
В одном эмбрионе обнаружена одна копия участка хромосомы 1 и три копии участка хромосомы 8 (рис. 1В), но с учетом того, что кариотип был в норме, данную патологию приняли за случайную мутацию de novo, что часто отмечают у преимплантационных эмбрионов.
Рис. 1. Примеры анализов результатов секвенирования клеток трофэктодермы методом высокопроизводительного секвенирования на платформе Illumina в программе BlueFuse Multi у пациентки С.В.В. А и B — профиль хромосом; C и D — размеры участков с делецией и дупликацией
Перенос в последующем цикле эмбриона женского пола закончился наступлением беременности, которая в 5–6 недель остановилась в развитии. Инструментальное удаление ее не проводилось.
Перенос эмбриона мужского пола закончился беременностью, которую пришлось прервать медикаментозно в 11–12 недель по медицинским показаниям. УЗИ показало множественные пороки развития плода (МВПР): мегацистис и вторичный гидронефроз по типу синдрома prune-belly, омфаломезентериальную кисту пуповины; единственную артерию пуповины, гипоплазию носовой кости; субамниотическую и субхориальную гематомы как признаки начавшегося прерывания беременности.
Генетическое исследование тканей абортуса методом NGS выявило нормальный молекулярный кариотип, как и во время проведения ПГТ: seq(1-22)×2,(XY)×1. Дополнительно произведено полноэкзомное секвенирование, оно не показало патогенные мутации, которые могли быть причиной МВПР.
Протокол ЭКО № 2. Длинный протокол. При ТВП фолликулов получен 21 ОКК. На 5-й день развития для ПГТ были пригодны 8 эмбрионов. Полногеномная амплификация образцов показала, что один не пригоден для секвенирования (рис. 1). Тестирование остальных выявило один пригодный к переносу эмбрион женского пола. В остальных найдены различные хромосомные патологии. В 4 эмбрионах отмечена закономерная патология, которая могла указывать на наличие сбалансированной хромосомной транслокации у одного из родителей (табл. 2).
Таблица 2
Результаты исследования 8 эмбрионов пациентки С.В.В.

Было принято решение о повторном исследовании кариотипа пациентов уже с указанием врачу-цитогенетику выявленных точек разрыва хромосом в клетках эмбриона. Повторное исследование обнаружило у супруги сбалансированную транслокацию между хромосомами 1 и 8: 46,XX,t(1;8)(q32;q22).
Несмотря на то что секвенирование показало наличие одного здорового эмбриона, супруги решили использовать в дальнейшем в программе ВРТ донорские ооциты с ПГТ.
Протокол ЭКО с донорскими ооцитами. Разморожены и оплодотворены методом ИКСИ 8 донорских ооцитов. На 5-й день развития получены 4 эмбриона, двум из которых проведено ПГТ. Результат подтвердил, что оба эмбриона пригодны к переносу. Последующий перенос эмбриона мужского пола закончился наступлением беременности, которая завершилась в 2019 году рождением здорового мальчика весом 3668 г и ростом 54 см.
КЛИНИЧЕСКИЙ СЛУЧАЙ 2
Пациентка К.М.А., 14.08.1986 г. р., наблюдалась в отделении ВРТ с 2013 года с диагнозом «бесплодие 2». На момент включения пациентки в программу ЭКО было известно о наличии в ее кариотипе сбалансированной хромосомной транслокации с участием хромосом 2 и 7: 46,ХХ,t(2;7)(р21;q36). На исследование кариотипа супружескую пару направили в связи с тем, что в анамнезе была отмечена неразвивающаяся беременность на сроке 6–7 недель. Исследование материала абортуса FISH-методом показало: пол — женский, ХХ. Анеуплоидии по маркерам для хромосом 13, 14, 16, 18, 21 и 22 не выявлены.
У женщины отмечали спаечный процесс в полости малого таза; хронический эндометрит вне обострения; гипоплазию матки I ст.; мультифолликулярные яичники; хронический цистит вне обострения; атопический дерматит.
Менструальная функция: менструации с 15 лет, установились сразу, по 5 дней, через 30–32 дня, умеренные, безболезненные, регулярные. Принимала оральные контрацептивы непрерывно в течение 5 лет.
Беременность одна, остановилась в развитии на сроке 6–7 недель. Произведены удаление остатков плодного яйца и выскабливание стенок полости матки, затем бужирование цервикального канала и офисная гистероскопия.
У пациентки проведена одна программа ВРТ по короткому протоколу. При ТВП получены 16 ОКК. На 5-е сутки развития пригодных для биопсии эмбрионов было 8, после биопсии они были криоконсервированы.
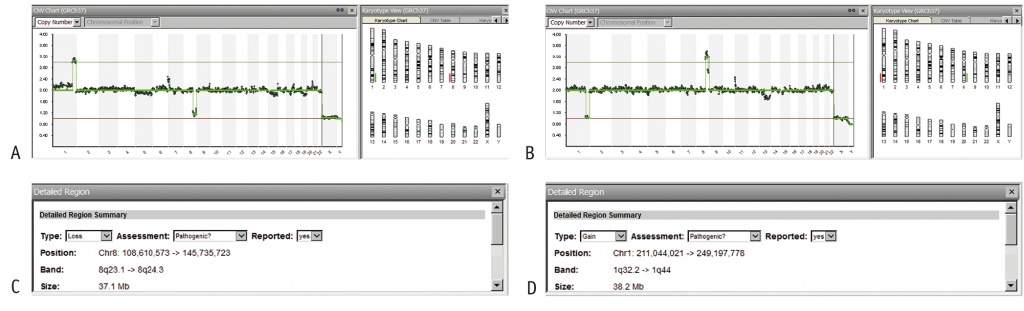
По результатам ПГТ (табл. 3) к переносу рекомендованы 2 эмбриона: мужского и женского пола. В остальных эмбрионах наблюдали несбалансированную транслокацию участков хромосом 2 и 7 (рис. 2А и 2В) и/или другие хромосомные нарушения. Однако точки разрыва в эмбрионах не совпадали с точками разрыва в кариотипе женщины (рис. 2C, 2D). Принято решение о повторном кариотипировании с указанием точек разрыва, выявленных в эмбрионах. В результате повторного исследования хромосомного набора у женщины определены такие же точки разрыва, как у эмбрионов: 46,XX,t(2;7)(p11.2;q31.2).
Таблица 3
Результаты исследования 8 эмбрионов пациентки К.М.А.

Рис. 2. Примеры анализов результатов секвенирования клеток трофэктодермы методом высокопроизводительного секвенирования на платформе Illumina в программе BlueFuse Multi у пациентки К.М.А. А и B — профиль хромосом; C и D — размеры участков с делецией и дупликацией
При последующим переносе эмбриона женского пола беременность не наступила. Перенос эмбриона мужского пола закончился наступлением беременности, которая завершилась в 2019 году рождением здорового мальчика массой 3800 г и ростом 52 см.
ОБСУЖДЕНИЕ
В настоящее время в литературе имеются многочисленные публикации, которые доказывают, что изменения в кариотипе пациентов могут быть причиной различных НРФ человека: от бесплодия, невынашивания беременности до рождения ребенка с генетическими нарушениями. Поэтому таким больным в рамках программы ВРТ уделяется особое внимание и всегда рекомендуется проведение ПГТ, потому что одной визуализации морфологии эмбриона недостаточно для вывода о его генетическом здоровье.
S. Munné и соавт. проанализировали исходы программ ВРТ 34 клиник и 9 лабораторий США, Канады, Англии и Австралии в группах женщин, у которых оценивали перед переносом только морфологию эмбрионов, и в группе, где также исследовали генетический статус эмбрионов. Для чистоты исследования эмбрионы с выявленным мозаицизмом в 16,8% случаев не использовались для переноса.
Анализ показал, что в группе пациенток старше 35 лет, где проводилось ПГТ, отмечалось значительное улучшение исходов программ ВРТ: частота рождения здоровых детей составила 51% против 37% в группах только с визуализацией эмбрионов[10].
Современные молекулярно-генетические методы находят все более широкое применение в медицинской практике у пациентов с генетическими изменениями, особенно в тех случаях, когда классические методы исследования не могут выявлять причину заболевания. Возможное одномоментное исследование всех 24 хромосом сделало прорыв в ПГТ. До недавнего времени применяли, а в некоторых клиниках до сих пор применяют метод aCGH (сравнительную геномную гибридизацию), который позволяет исследовать 24 хромосомы. В основе метода лежит гибридизация ДНК на чипах. Однако NGS имеет ряд преимуществ перед этим методом.
J. Friedenthal и соавт. сравнивали исходы 916 программ ВРТ при переносе единичных размороженных эуплоидных эмбрионов, исследованных методами aCGH и NGS: частоту имплантации, биохимических беременностей, спонтанных абортов и рождения детей. Результаты исследования показали, что частота имплантации была значительно выше, когда исследование проводили методом секвенирования (71,6% против 64,6%). Частота рождения детей была также выше (62% против 54,4%).
Стоит отметить, что частота биохимических беременностей оказалась значительно выше при применении метода aCGH (15,1% против 8,7%). Авторы сделали заключение, что тестирование эмбрионов методом NGS дает более высокие показатели исходов программ ВРТ, чем aCGH, т. к. секвенирование имеет возможность лучше выявлять мозаицизм, делеции и дупликации, влияющие на жизнеспособность эмбрионов, и тем самым исключать перенос эмбрионов с генетическими особенностями[11].
Секвенирование нового поколения изменяет известные представления о причинах возникновения НРФ. Знание точной причины НРФ у конкретной супружеской пары имеет принципиальное значение, т. к. это определяет тактику ведения пациентов и в зависимости от причин, вызывающих НРФ, может изменить алгоритм лечения. В ряде случаев пациенты хотят использовать программу с донорскими клетками как в нашем наблюдении № 1.
Результаты нашей работы еще раз подтверждают, что ПГТ необходимо проводить пациентам с отягощенным акушерским анамнезом, так это может помочь в нахождении причин НРФ у конкретной супружеской пары (наблюдение № 1). Если бы основывались только на данных кариотипа, которые изначально определили как норму, и не провели ПГТ дважды, то выяснить причину НРФ в данном случае не удалось бы. Кроме того, в рамках программы ВРТ у пары, помимо невынашивания беременности, мог родиться ребенок с ХП. Поэтому пациенты должны иметь полную информацию о причинах своих НРФ и только самостоятельно принимать решение, по какому алгоритму лечения они пойдут.
При проведении ПГТ необходимо обращать внимание и на возраст пациенток, так как у женщин старше 35 лет, помимо генетического груза, связанного с изменениями кариотипа, дополнительно повышается риск возникновения различных анеуплоидий у эмбрионов, не вовлеченных в транслокацию, как было отмечено в обоих наших наблюдениях. Перенос таких эмбрионов может привести к высокому риску невынашивания беременности и рождению больного ребенка.
ЗАКЛЮЧЕНИЕ
Собственные результаты и зарубежные данные показали, что точность преимплантационного генетического тестирования (ПГТ) зависит от метода, которым оно проводится, и что метод высокопроизводительного секвенирования на платформе компании Illumina может быть успешно применен у пациентов с изменениями в кариотипе, даже в случае, когда кариотип родителей определен неправильно или неизвестен[10, 11]. При нарушении репродуктивной функции знание точек разрыва имеет принципиальное значение, т. к. от них может зависеть выбор метода последующей генетической диагностики у эмбриона.
Последующее внедрение искусственного интеллекта в медицинскую практику, возможно, повысит точность диагностики в ПГТ.
Это увеличит достоверность полученных результатов, раскроет механизмы происхождения генетического дисбаланса, что в конечном итоге улучшит качество медико-генетического консультирования семей с высоким риском рождения больного ребенка.
Благодарности: Авторы благодарят учениц 9-го класса ГБОУ «Школа № 1358», ГБОУ «Школа № 1514» г. Москвы К.В. Науменко и М.А. Фролову за помощь в переводе зарубежных публикаций для статьи.
Поступила: 25.09.2020
Принята к публикаци: 02.12.2020








