ВВЕДЕНИЕ
В России ежегодно рождается более 35 000 детей с врожденными пороками сердца (ВПС). Это дает основание полагать, что количество беременных с патологией сердца в дальнейшем увеличится[1].
Благодаря демократизации общества, снижению социальной стигматизации, разработке и внедрению новых методов лечения, существенно улучшающих качество жизни больных, а также доступности современных методов исследования и наблюдения за течением беременности, все больше женщин с ВПС интегрируются в активную жизнь общества, имеют семью и стремятся завести детей. Следовательно, значительно возрастает количество беременных с тяжелой кардиальной патологией. Кроме того, только 3% женщин с пороками сердца дают согласие на прерывание беременности[1, 2].
Наиболее распространенными являются дефект межжелудочковой перегородки (ДМЖП) (27–42%), дефект межпредсердной перегородки (5–15%), открытый артериальный проток (10–18%), коарктация аорты (7%), врожденный стеноз устья аорты (6%), стеноз устья легочной артерии (8–10%), пороки группы Фалло[3]. Гемодинамические нарушения и клиническая картина зависят от локализации и размера дефекта, характера и длительности существования поражения сердца. Беременным женщинам с ВПС требуется тщательное наблюдение с самых ранних сроков. Многие беременные поздно обращаются в женскую консультацию из боязни того, что им придется прерывать беременность[4].
Согласно последним рекомендациям Европейского и Российского кардиологических обществ, среди беременных с пороками сердца выделяют группы высокого и низкого риска[5, 6]. К группе высокого риска относят пациенток с сердечной недостаточностью III–IV функционального класса вне зависимости от причины заболевания. Чаще всего среди болезней, которые могут привести к развитию такой сердечной недостаточности, встречаются пороки сердца, сопровождающиеся легочной гипертензией, при которых материнская смертность достигает 30–50%. В группу высокого риска также входят женщины с тяжелой степенью стеноза аорты и аортального клапана. Пациенткам данной группы рекомендуется избегать беременности, в противном случае показано ее прерывание, так как риск для матери высокий: смертность составляет 8–35%, количество тяжелых осложнений — 50%. Даже само прерывание беременности сопряжено с высоким риском из-за вазодилатации и уменьшения сократительной способности миокарда в результате анестезии[7].
К группе низкого риска отнесены беременные без легочной гипертензии, а также с незначительной или умеренно выраженной недостаточностью клапана. При таких пороках сердца во время беременности декомпенсация сердечной деятельности не происходит вследствие снижения общего периферического сосудистого сопротивления.
Пациентки с незначительной или средней степенью стеноза аорты также хорошо переносят беременность. В этих случаях градиент давления увеличивается одновременно с ростом ударного объема. Даже у женщин со среднетяжелой степенью стеноза легочной артерии беременность протекает нормально.
Большинство пациенток с корригированными пороками сердца без искусственных клапанов могут хорошо перенести беременность. Однако остаточные дефекты после кардиохирургической операции имеют место в 2–50% случаев и должны быть установлены клинически и при ЭхоКГ. Кардиологическое обследование пациенток даже группы низкого риска проводят каждый триместр.
Среди пороков группы Фалло следует выделить тетраду Фалло — классический «синий» ВПС, который состоит из ДМЖП, инфундибулярного стеноза легочной артерии, декстрапозиции аорты и гипертрофии правого желудочка. «Синие» пороки служат противопоказанием для беременности и родов. Беременность резко утяжеляет их течение[8, 9].
Риск при беременности у оперированных больных зависит от состояния гемодинамики. Низкий риск наблюдается у женщин с хорошо корригированными пороками[6].
СОБСТВЕННОЕ КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациентка К., 1990 года рождения, с ВПС (тетрадой Фалло) наблюдалась у участкового педиатра по месту жительства, после достижения 16 лет наблюдение прекратила самостоятельно. Перенесенные соматические заболевания: острый нефрит с трехкратным гемодиализом в 2009 году.
Акушерский анамнез: первая беременность, наступила спонтанно.
I триместр: на 8 и 12 неделе угроза прерывания беременности, находилась на стационарном лечении, проводилась терапия, направленная на сохранение беременности. Проведены УЗИ и ИФА-скрининг, пациентка отнесена к группе низкого риска. Впервые консультирована кардиологом на сроке 12 недель, рекомендованы сохранение беременности и повторная консультация кардиолога на 24–25 неделе гестации.
II триместр: при плановом обследовании гликемия натощак составила 5,6 ммоль/л.
Выставлен диагноз: гестационный СД.
После консультации у эндокринолога больной была назначена диетотерапия.
ЭхоКГ: левое предсердие не расширено, левый желудочек — 0,84 см. Конечный систолический размер — 2,4 см, конечный диастолический размер — 4,2 см. Фракция выброса — 74%. Митральный клапан не изменен. Фиброзное кольцо — 28 мм. Пиковый градиент давления — 1,9 мм рт. ст. Аорта — 3,3 см, расположена над межпредсердной перегородкой. Аортальный клапан трехстворчатый. Фиброзное кольцо — 30 мм, пиковый градиент давления — 4 мм рт. ст. Правое предсердие — 4,2 см. Правый желудочек — 2,8 см, передняя стенка правого желудочка — 10 мм. Стеноз легочного клапана, пиковый градиент давления — 72 мм рт. ст., среднедиастолический градиент давления — 43 мм рт. ст.
Трикуспидальный клапан: пиковый градиент давления — 33 мм рт. ст. Степень регургитации первая. Межжелудочковая перегородка — 0,98 мм. Высокий дефект — 15–16 мм, пиковый градиент давления — 7,2 мм рт. ст., лево-правый сброс. Дефекты межпредсердной перегородки не обнаружены. Заключение: ВПС — тетрада Фалло.
На сроке 24 недели пациентка консультирована сосудистым хирургом: рекомендовано хирургическое лечение в условиях искусственного кровообращения после периода лактации, родоразрешение по акушерским показаниям.
III триместр: на 33–34 неделе больная находилась на стационарном лечении в связи с фетоплацентарной недостаточностью (ФПН). Была проведена терапия, направленная на улучшение функции фетоплацентарного комплекса. Женщина осмотрена кардиологом: показано родоразрешение через естественные родовые пути, рекомендовано ограничение потуг. В дальнейшем беременность протекала без осложнений.
На 36–37 неделе пациентка госпитализирована в акушерский стационар с диагнозом: 36–37 недель беременности. Головное предлежание. ФПН: синдром задержки роста плода (СЗРП) II степени. Гестационный СД. ВПС: тетрада Фалло. Легочная гипертензия II степени. Сердечная недостаточность II функционального класса. Резус-отрицательная кровь (иммунизация в 28 недель). Вирусный гепатит С минимальной степени активности.
В обсервационном отделении МОНИИАГ проведено клинико-лабораторное обследование. При лабораторном обследовании патология не выявлена. При антенатальном обследовании плода обнаружена ФПН (СЗРП II степени), гемодинамических нарушений не было. Предполагаемая масса плода составила 2300–2500 г.
ЭхоКГ: ВПС (тетрада Фалло): высокий ДМЖП — 14 мм (пиковый градиент давления — 26–28 мм рт. ст.). Смещение аорты вправо. Выраженная гипертрофия правого желудочка. Стеноз легочной артерии (пиковый градиент давления — 100 мм рт. ст.). Фракция выброса в норме.
Больная консультирована кардиологом: рекомендованы роды через естественные родовые пути с ограничением потуг, во время родов — мониторный контроль ЭКГ и сатурации, при необходимости — ингаляции кислорода.
При сроке гестации 38 недель спонтанно развилась регулярная родовая деятельность, с целью профилактики аномалий родовой деятельности при открытии маточного зева на 3 см произведена амниотомия. Роды велись через естественные родовые пути под ингаляционной седоаналгезией севофлураном.
Ингаляционная седоаналгезия севофлураном начата при открытии маточного зева на 4 см. Интенсивность боли по ВАШ до обезболивания составила 80 баллов, уровень возбуждения достиг +1 по шкале Ричмонда.
Индукцию севофлуран-кислородной смеси (10 минут, 5 схваток) проводили на фоне сохраненного спонтанного дыхания путем постоянной (во время и между схватками) ингаляции, установив поток кислорода 5 л/мин и концентрацию севофлурана на испарителе 1,5%. Целевой уровень седации, равный 3, был выделен согласно шкале Ramsay. Контролировали состояние сознания роженицы, данные пульсоксиметрии и кардиотокографии, частоту и глубину дыхания.
Через 10 минут от начала ингаляции севофлуран-кислородной смеси переходили к этапу поддержания седоаналгезии, уменьшив поток кислорода до 4 л/мин, а концентрацию севофлурана на испарителе — до 1%. Уровень седации по шкале Ramsay соответствовал 3, по шкале Ричмонда — 0; гортанно-глоточные рефлексы сохранялись, при необходимости у роженицы имелась возможность перорального приема жидкости. Интенсивность боли по ВАШ снижалась до 40 баллов и соответствовала умеренным болевым ощущениям.
Для обеспечения эффективной седоаналгезии во втором периоде родов (открытие маточного зева на 9 см и больше) поток кислорода увеличивали до 5 л/мин, концентрацию севофлурана на испарителе — до 1,5%. Ингаляцию севофлуран-кислородной смеси продолжали в постоянном режиме.
Для проведения ингаляционной седоаналгезии во время потуг переходили на дискретный режим введения: ингаляции начинали за 1–2 минуты до потуги и прекращали на ее пике. Для обеспечения эффективной седоаналгезии поток кислорода сохранялся на уровне 5 л/мин, концентрация севофлурана на испарителе — 1,5%. Интенсивность боли по ВАШ соответствовала 45–50 баллам. Время экспозиции севофлуран-кислородной смеси составило 95 минут. Побочных эффектов в виде депрессии дыхания, тошноты, рвоты не было.
Для оценки эффективности ингаляционного обезболивания севофлураном применяли шкалу-опросник Angle Labor Pain Questionnaire (A-LPQ)[10]: роженицу опрашивали в течение трех схваток до обезболивания и через 20 минут на фоне ингаляции севофлурана (рис. 1).
Рис. 1. Оценка эффективности ингаляционного обезболивания севофлураном у пациентки по шкале Angle Labor Pain Questionnaire
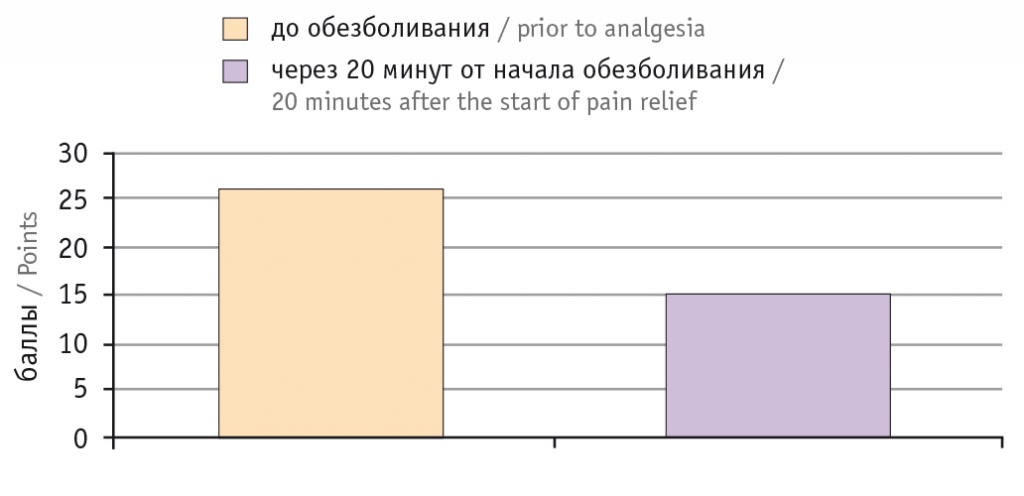
При мониторном наблюдении за витальными функциями роженицы в раннем послеродовом периоде отмечено снижение уровня SpO2 до 87% в течение первого часа после родов с последующей нормализацией показателя. Для коррекции проводилась инсуфляция кислородно-воздушной смеси в пропорции 50 : 50.
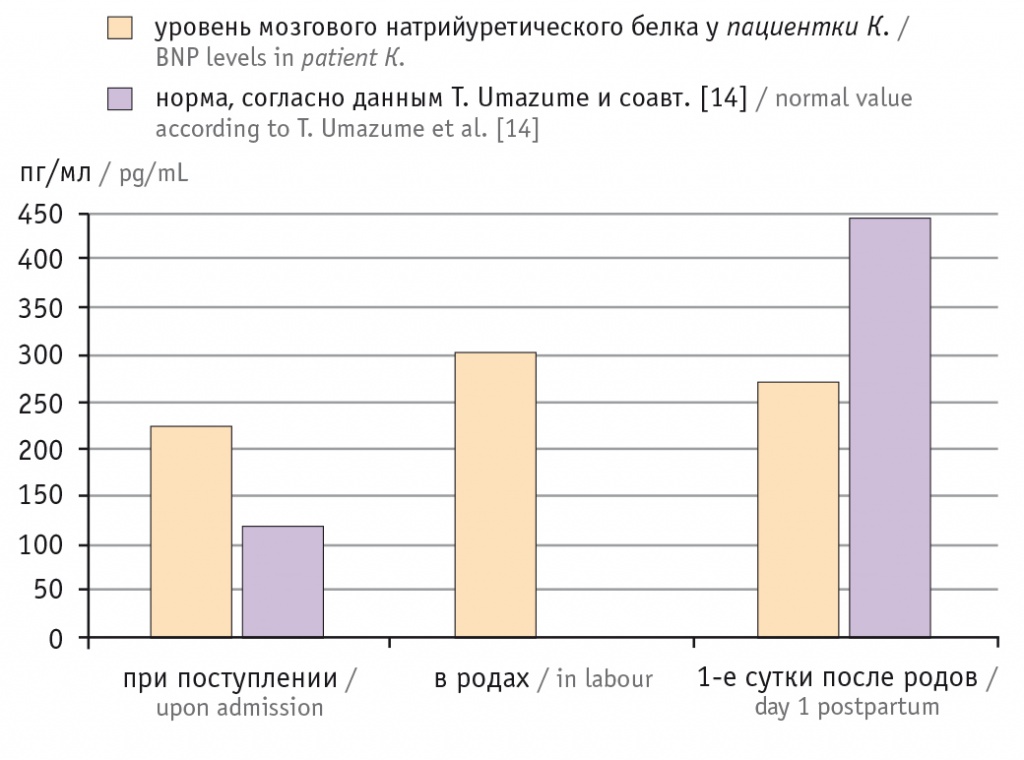
Особое значение при родоразрешении пациенток с патологией сердечно-сосудистой системы (ССС) приобретает проблема оценки ее функционального состояния на фоне возрастающей нагрузки и влияния фармакологических препаратов, применяемых для обезболивания родов. В качестве диагностического сердечного маркера использовался уровень мозгового натрийуретического белка (NT-proBNP)[11, 12].
При поступлении уровень NT-proBNP у больной превышал норму в 2 раза, что свидетельствует об исходной скомпрометированности ССС на фоне тяжелого порока (рис. 2). В процессе родов отмечалось увеличение концентрации указанного маркера на 35%, что в первую очередь связано как с изменениями центральной и периферической гемодинамики на фоне беременности, так и с возрастающей нагрузкой на миокард при родоразрешении[13]. Тем не менее бережное родоразрешение на фоне адекватного обезболивания способствовало снижению уровня NT-proBNP до нормального значения уже к первым суткам послеродового периода.
Рис. 2. Динамика уровня мозгового натрийуретического белка у роженицы
Через 6 часов 15 минут от начала регулярной родовой деятельности после проведенной медиолатеральной эпизиотомии родился живой доношенный мальчик. Третий период родов протекал без осложнений. Кровопотеря составила 200 мл.
Состояние новорожденного
Масса мальчика при рождении — 2610 г, рост — 47 см, окружность головы — 33 см, окружность груди — 31 см. Показатели физического развития по шкале Фентона, рекомендованной ВОЗ для оценки роста и веса детей, соответствовали средним значениям для данного гестационного возраста (38 недель). Оценка по шкале Апгар — 8/9 баллов. Имелся порок развития нижней конечности в виде отсутствия пальцев левой стопы. Состояние при рождении удовлетворительное. Обеспечены контакт ребенка с матерью, прикладывание к груди.
При оценке общей активности по профилю угнетения/раздражения у ребенка наблюдались физиологическая двигательная активность, полный объем движений глаз, громкий эмоциональный крик, быстрая истощаемость на раздражение, отсутствие тремора, флексорная поза, наличие удовлетворительных рефлексов орального автоматизма и сниженных рефлексов опоры и шага. При исследовании кислотно-основного состояния (КОС) сразу после рождения зафиксирован субкомпенсированный метаболический лактат-ацидоз (рН =7,32, рСО2 = 38,0, рО2 = 68,5, сlac = 3,7, ВЕ = –6,5), уровень гликемии – 2,8 ммоль/л.
В связи с высоким риском кардиальной патологии с учетом анамнеза матери в первые сутки жизни ребенку проводился кардиологический скрининг, отклонения от нормы не отмечены. При дальнейшем наблюдении состояние ребенка оставалось удовлетворительным, патологических симптомов со стороны ЦНС и внутренних органов не было. Он находился на грудном вскармливании, максимальная потеря массы составила 160 г (6,1%). Проведено полное лабораторное и инструментальное обследование ребенка.
При нейросонографии патологические изменения не выявлены. При ЭхоКГ данные о врожденном пороке сердца не найдены, показатели гемодинамики удовлетворительные. При УЗИ органов брюшной полости зафиксирована нормальная эхоскопическая картина, при УЗИ почек — пиелоэктазия левой почки (7 мм). На рентгенограмме стоп в двух проекциях справа костных изменений не было, слева определяется ядро таранной и пяточной кости, плюсневые кости и фаланги пальцев отсутствуют. В динамике КОС к концу первых суток жизни патологические изменения отсутствовали (рН = 7,39, рСО2 = 31,1, рО2 = 63,8, lac = 1,7, ВЕ = –5,1), уровень гликемии в динамике наблюдения составил 2,8–6,53,8 ммоль/л.
В клиническом и биохимическом анализах крови, анализе мочи отклонения от нормативных значений не отмечались. С учетом выявленной костной патологии ребенок был консультирован хирургом-ортопедом ГБУЗ «Московская областная детская клиническая травматолого-ортопедическая больница»: оперативное лечение в настоящее время не показано. Рекомендована консультация хирурга-ортопеда в ГБУЗ МО МОДКТОБ в возрасте 4–6 месяцев.
В отделении ребенку проведена вакцинация против гепатита B вакциной Регевак (0,5 мл в/м) и против туберкулеза вакциной БЦЖ-М (0,025 мл в/к), поствакцинальных осложнений не было. Проведены аудиоскрининг и забор крови на неонатальный биохимический скрининг. На пятые сутки жизни ребенок был выписан домой в удовлетворительном состоянии с рекомендациями контроля весовой кривой, динамики УЗИ почек и анализа мочи в возрасте месяца.
В послеродовом периоде проводилась антибактериальная, утеротоническая и симптоматическая терапия. Роженица выписана под наблюдение акушера-гинеколога и кардиолога по месту жительства на пятые сутки.
ОБСУЖДЕНИЕ
Ввиду отсутствия клинических признаков сердечной недостаточности и умеренных изменений центральной гемодинамики (по данным ЭхоКГ) к моменту родоразрешения состояние пациентки расценено как компенсированное. Поскольку регулярная родовая деятельность развилась спонтанно, было принято решение вести роды через естественные родовые пути. При выборе метода обезболивания родов принимали во внимание как прямые фармакологические воздействия на состояние плода/новорожденного, так и опосредованные, проявляющиеся через физиологические или биохимические изменения у матери во время родов и в послеродовом периоде с учетом имеющегося ВПС.
Анализ практического опыта применения наркотических анальгетиков для обезболивания родов выявил спорные моменты необходимости их использования: недостаточный анальгетический эффект в сочетании с отрицательным влиянием на организм плода/новорожденного[15]. Показано, что чем больше проходит времени от в/м введения однократной дозы меперидина, тем больше увеличивается его концентрация в крови плода[15]. Многократное введение меперидина, используемого в течение нескольких часов, приводит к накоплению его метаболита нормеперидина у матери и плода[15]. Нормеперидин ассоциируется с угнетением дыхания и с развитием судорог, т. к. он является проконвульсантом.
Нейроаксиальные методы обезболивания способны активно воздействовать на функциональное состояние кровообращения, в основном в результате развивающегося симпатического блока. Зона вегетативного блока может простираться на 6–8 сегментов выше сенсорного блока, таким образом, распространенность его в некоторых случаях может оказаться непредсказуемой[16]. С учетом данных ЭхоКГ перед родоразрешением (дефект межжелудочковой перегородки — 14 мм, выраженная гипертрофия правого желудочка, стеноз легочной артерии — пиковый градиент давления — 100 мм рт. ст.) от применения длительной эпидуральной аналгезии решено отказаться вследствие высокого риска дестабилизации системы кровообращения в виде неконтролируемой гипотензии и брадикардии.
Таким образом, методом обезболивания родов была выбрана ингаляционная седоаналгезия севофлураном по разработанной нами методике[17]. Применение субанестетических доз севофлурана (МАС 0,3–0,4) обеспечило достаточный анальгетический эффект в сочетании с умеренной седацией, который позволил исключить отрицательное влияние на ССС матери и внутриутробное состояние плода, что подтверждается данными непрерывного мониторинга (АД — 110/70–115/75 мм рт. ст., ЧСС — 74–92 уд/мин, SpO2 — 97–99%) и положительной динамикой кардиомаркера NT-proBNP.
В послеродовой период у рожениц с данным пороком сердца весьма вероятно снижение уровня SpO2 до 88%, что объясняется увеличением притока венозной крови к сердцу в результате резкого сокращения матки. Однако в связи со стенозом устья легочной артерии она не может пройти полностью в малый круг, и значительная ее часть через ДМЖП попадает непосредственно в большой круг кровообращения, резко усиливая и без того выраженную гипоксемию[13]. Необходимо отметить, что инсуфляция кислородно-воздушной смеси не дает значимого клинического эффекта в виде подъема SpO2, тем не менее данная ситуация не требует применения инвазивной ИВЛ.
ЗАКЛЮЧЕНИЕ
Приведенный клинический пример подтверждает возможность применения предложенного способа ингаляционной седоаналгезии севофлураном для обеспечения эффективного обезболивания у рожениц с патологией сердечно-сосудистой системы в первом и втором периодах родов. Использование ингаляционной седоаналгезии севофлураном не является рутинной практикой в акушерстве, однако может быть хорошей альтернативой при противопоказаниях к инвазивным методам обезболивания родов.
Поступила: 08.10.2019
Принята к публикации: 12.11.2019








