Наблюдающийся в настоящее время быстрый рост распространенности гестационного СД (ГСД), по-видимому, можно объяснить двумя основными причинами.
Во-первых, это пандемия ожирения, не только спровоцировавшая феномен «цунами» ГСД, но и изменившая его профиль. Так, согласно данным A.J. Reichelt и соавт. (2017) [1], за последние 20 лет среди пациенток с ГСД доля имеющих прегестационное ожирение увеличилась как минимум вдвое. Кроме того, эпидемиологически значимо усиливается влияние и других диабетогенных факторов (возраста, ВРТ и пр.) не только на частоту, но и на характер ГСД.
Во-вторых, рост числа выявленных случаев ГСД связан с прогрессом диагностики: включением критериев Международной ассоциации групп по исследованию диабета при беременности во многие национальные протоколы обследования, а также с организационными мерами по сплошному скринингу гипергликемии у беременных [2–4].
Изменение в профиле ГСД не могло не изменить и состояние здоровья новорожденных от матерей с ГСД. По мнению многих авторов, ГСД сегодня в развитых странах не влияет на уровень мертворождаемости, потребность в реанимационных мероприятиях, частоту респираторного дистресс-синдрома новорожденных [2, 5, 6]. Чем же определяется в современных условиях степень неонатального неблагополучия детей, рожденных матерями с ГСД?
Целью настоящего исследования явилось изучение состояния здоровья новорожденных от матерей с ГСД (состояния при рождении, перинатальной заболеваемости, течения раннего неонатального периода).
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 219 беременных с ГСД и 33 беременные без нарушения углеводного обмена (контрольная группа), родоразрешенные в период со второго квартала 2017 г. по третий квартал 2018 г. в родильном отделении ГКБ № 29 им. Н.Э. Баумана г. Москвы (главный врач — к. м. н. Папышева О.В.). Обследовали также новорожденных от этих матерей. В исследование входили только женщины с одноплодной доношенной беременностью (37,0–41,0 неделя гестации).
Диагноз ГСД был поставлен на основании критериев, утвержденных Министерством здравоохранения РФ в виде клинических рекомендаций (2014) [7]. Среди обследованных с ГСД 102 (46,6%) получали инсулинотерапию, 110 (50,2%) — только диету, у 7 (3,2%) ГСД был диагностирован лишь постфактум (не было скрининга гипергликемии во время беременности либо при зафиксированной гипергликемии натощак ГСД не был диагностирован) — по рождению ребенка с фенотипическими признаками диабетической фетопатии (ДФ).
Проводили анкетирование пациенток, изучая:
1) семейный анамнез нарушений углеводного обмена и ожирения;
2) хронические соматические и гинекологические заболевания;
3) репродуктивный анамнез;
4) осложнения настоящей беременности, сроки выявления ГСД.
Оценивали уровень прегестационного ожирения (масса тела, соответствующая началу I триместра беременности (кг/м2) [8].
Обследование новорожденных:
1) oценка в родзале — антропометрические характеристики, в т. ч. окружность головы, окружность груди, массо-ростовой индекс Кетле-I; оценка по шкале Апгар; определение фенотипических признаков ДФ [8, 9];
2) уровень гликемии в капиллярной крови;
3) клиническая оценка течения раннего неонатального периода;
4) ЭхоКГ и нейросонография на третьи сутки жизни.
Диагноз ДФ ставили при наличии у новорожденного двух и более фенотипических/клинико-морфологических признаков или сочетания одного из них с одним и более клинико-лабораторным.
Статистическую обработку данных производили с помощью программы Statistica v. 10.0. (StatSoft Inc., США). Для всех качественных признаков указаны абсолютные и относительные частоты, для количественных — медиана (Ме) и 25-й, 75-й процентили. При сравнении бинарных признаков с целью определения статистической значимости различий использовали точный критерий Фишера, для количественных признаков — критерий Манна — Уитни (уровень значимости p < 0,05).
РЕЗУЛЬТАТЫ
Чтобы определить общие характеристики состояния здоровья матерей с ГСД, сравнивали частоту типичных, описанных в литературе клинико-анамнестических факторов риска ГСД [4, 9].
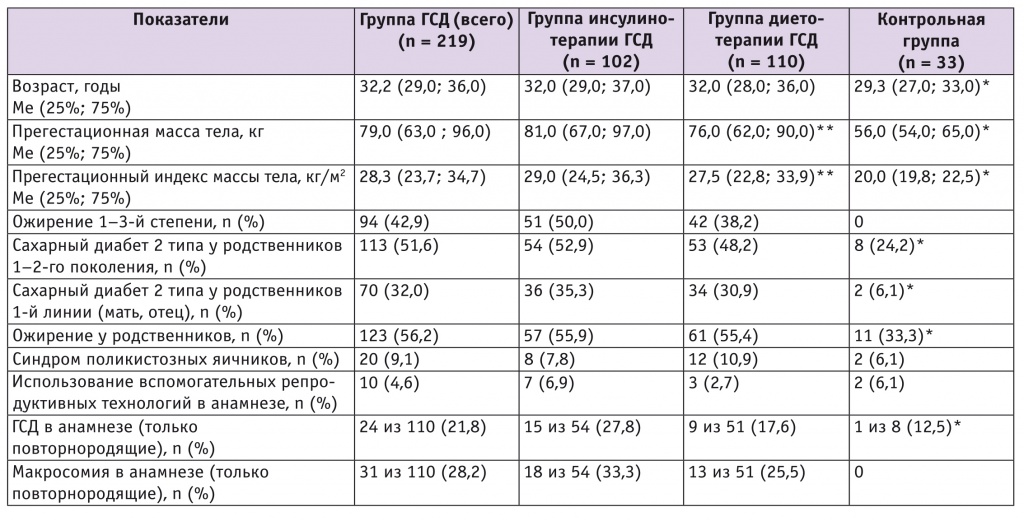
Мы оценивали традиционные клинико-анамнестические факторы риска ГСД [1, 4]. Как следует из таблицы 1, беременные с ГСД были старше и имели бóльшую массу тела, чем участницы контрольной группы. Частота ожирения у беременных с ГСД поистине впечатляет: это почти половина обследованных.
Таблица 1
Основные клинико-анамнестические факторы риска гестационного сахарного диабета (ГСД) у обследованных женщин
* Здесь и в таблицах 2, 3 и 5: отличия от группы ГСД (всего) статистически значимы (p < 0,05).
** Здесь и в таблице 5: отличия от группы инсулинотерапии статистически значимы (p < 0,05).
Как видно из таблицы 1, пациенткам с избыточной массой тела и ожирением чаще требовалась инсулинотерапия, чем женщинам с нормальной массой тела. Действительно, в группе диетотерапии доля беременных с ожирением 1–3-й степени была в 1,3 раза меньше, чем среди получавших инсулин (см. табл. 1). Это позволило бы рассматривать ГСД, требующий инсулинотерапии, как более тяжелую форму, с более выраженной инсулинорезистентностью (ИР), чем ГСД, при котором достаточно диетотерапии. Однако частота макросомии новорожденных у пациенток, получавших инсулинотерапию и диетотерапию, была сопоставимой (см. ниже).
Вероятно, объяснение этого факта может быть связано с более поздними сроками диагностики ГСД в группе получавших только диетотерапию: 26,0 (21,0; 30,0) недель против 24,0 (14,0; 28,0) недель в группе инсулинотерапии (p < 0,05). Точно так же различались и сроки взятия на учет у эндокринолога: 29,0 (23,0; 32,0) недель в группе инсулинотерапии и 30,0 (26,5;35,0) недель в группе диетотерапии (p < 0,05). Это различие было обусловлено не ранней манифестацией ГСД (в I триместре), а констатацией гипергликемии натощак в конце II–III триместре у 57 (51,8%) обследованных, находившихся на диетотерапии.
Что касается осложнений настоящей беременности у пациенток с ГСД, то, как следует из таблицы 2, наиболее частым из них была преэклампсия. Данное заболевание у них имело место в 3,2 раза чаще, чем в контрольной группе (p < 0,05).
Таблица 2
Осложнения беременности у обследованных женщин с гестационным сахарным диабетом (ГСД) и без него, n (%)
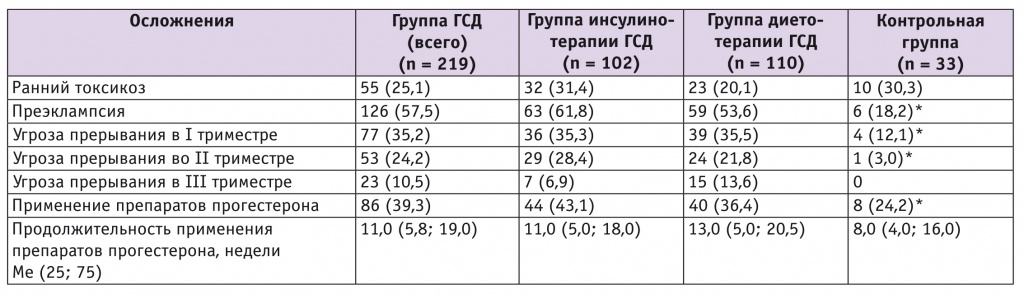
Обращает на себя внимание тот факт, что у пациенток с ГСД значительно чаще, чем в контрольной группе, диагностировали угрозу прерывания в I и II триместрах беременности (p < 0,05). Это влекло за собой более частое назначение аналогов прогестерона: более 35% обследованных с ГСД получали препараты прогестерона начиная с I триместра, т. е. в 1,6 раза чаще, чем беременные без нарушений углеводного обмена. При этом средняя продолжительность курса лечения составила 11 недель, максимальная — 36 (!) недель.
У женщин с ГСД родились 219 живых доношенных новорожденных, у женщин без нарушения углеводного обмена — 33.
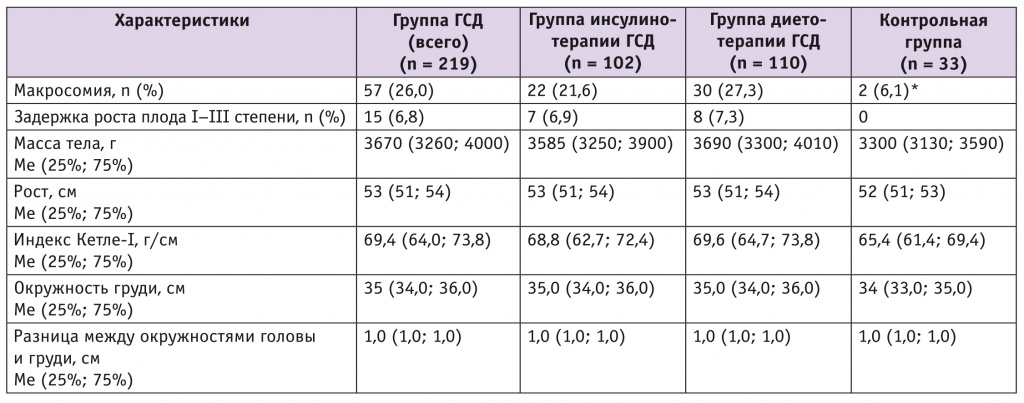
Как следует из таблицы 3, макросомия не была ведущей фенотипической особенностью новорожденных от матерей с ГСД, встречалась лишь у каждого четвертого.
Таблица 3
Антропометрические характеристики новорожденных от матерей с гестационным сахарным диабетом (ГСД) и без него
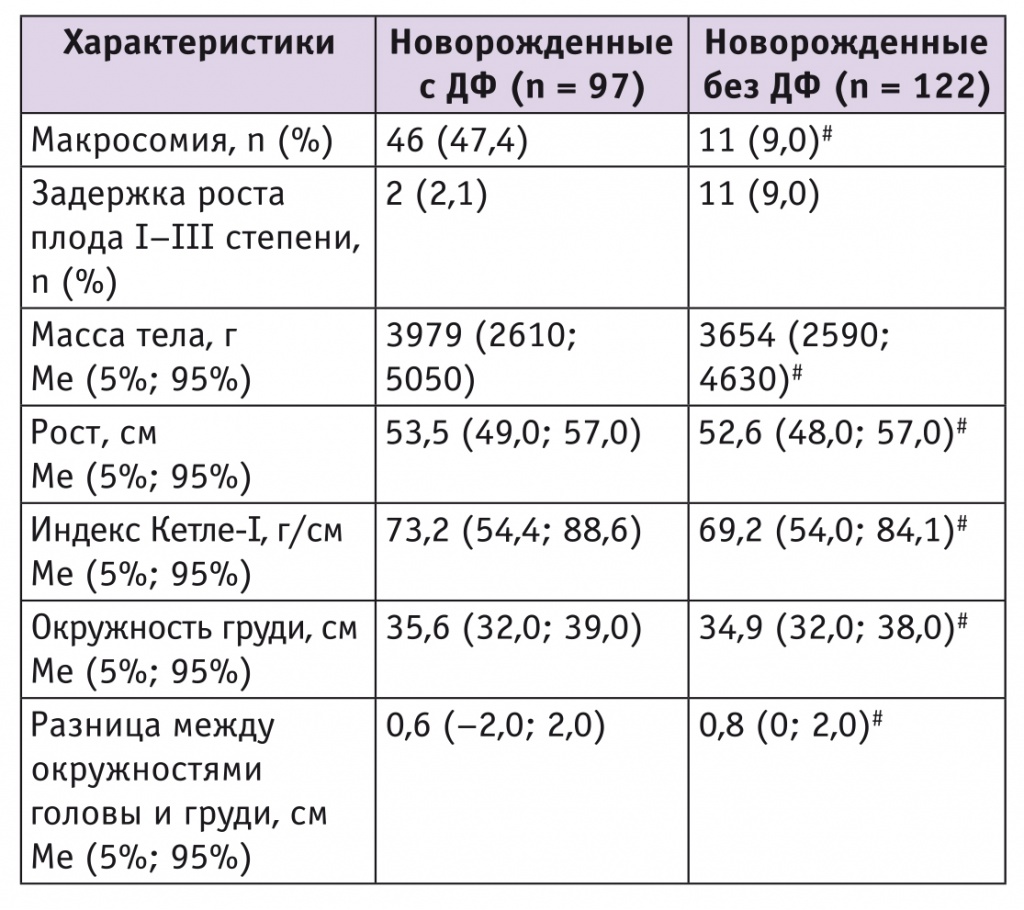
Даже при ДФ макросомия была менее чем у половины детей (табл. 4).
Таблица 4
Антропометрические характеристики новорожденных с диабетической фетопатией (ДФ) и без нее
#P < 0,05.
Согласно нашим данным, зависимость между крупными размерами плода и весом матери до беременности не обнаружена: 80,0 (70,0; 90,0) кг у матерей, родивших детей с массой тела более 4000 г, и 79,0 (63,0; 96,0) кг у родивших детей с нормальным весом. Однако выявлена значимая зависимость от степени гестационного увеличения массы тела (ГУМТ) в I триместре. Матери, родившие крупных детей, до 12 недель беременности прибавляли в весе значимо больше, чем родившие детей с нормальной массой тела: 3,0 (2,0; 5,0) и 2,0 (1,0; 4,0) кг соответственно.
В целом, антропометрические показатели (вес, рост, окружность груди) и их производные (индекс Кетле-I, разница между окружностями головы и груди) в группах диеты и инсулинотерапии статистически значимо не различались (см. табл. 3).
У детей с ДФ вследствие большей частоты диспропорциональной макросомии (47,4%) индекс Кетле-I был значительно выше, чем у новорожденных без ДФ (см. табл. 4).
Согласно полученным данным, проблема ДФ отнюдь не сводится к макросомии. Даже среди внешних признаков у новорожденных с ДФ макросомия не являлась ведущим (рис.). Среди фенотипических признаков ДФ наиболее часто встречались пастозность мягких тканей (у 9/10 детей с ДФ), кушингоидный тип телосложения (короткая шея, лунообразное лицо и различные признаки морфофункциональной незрелости — МФН).
Рис. Основные фенотипические признаки диабетической фетопатии у обследованных новорожденных (n = 97)
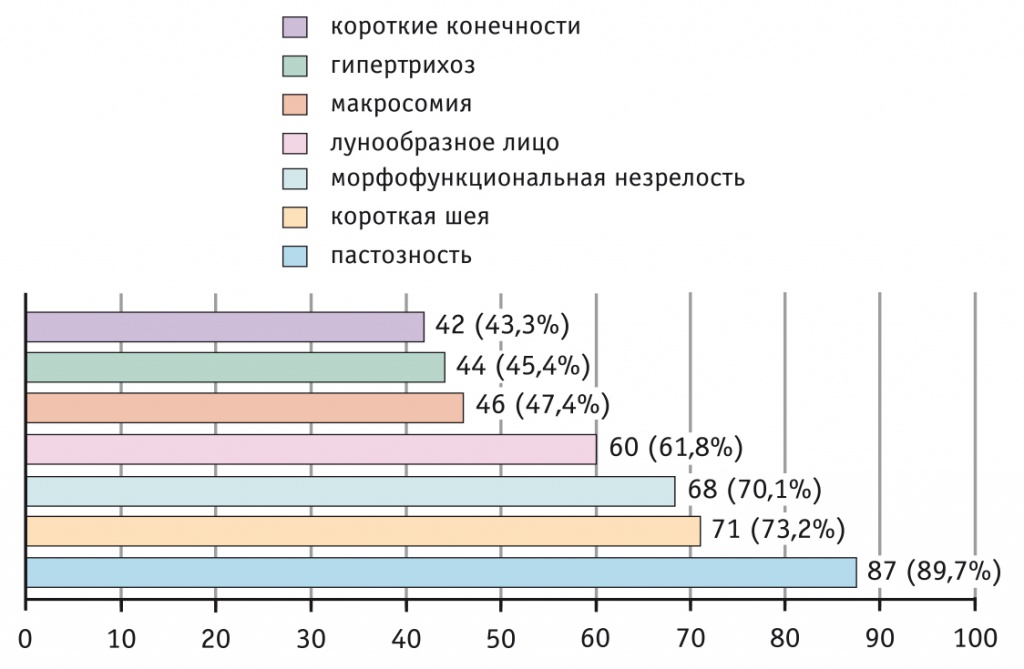
Несмотря на то что беременные, находившиеся на диетотерапии ГСД, чаще рожали крупных детей, чем получавшие инсулин, ДФ у их новорожденных диагностирована в 1,4 раза реже: 39 (35,5%) против 51 (50,0%) соответственно (p = 0,02).
Как показало наше исследование, для диагностики ДФ гораздо большее значение имели клинико-лабораторные показатели, нарушения процессов адаптации, нежели антропометрические характеристики.
При этом оценки по шкале Апгар новорожденных от матерей с ГСД не отличалась от таковых в контрольной группе. В группе ГСД в целом, а также в группах инсулинотерапии и диетотерапии оценки на 1-й/5-й минуте составили 8,0 (8,0; 9,0)/9,0 (8,0; 9,0) баллов, а в контрольной группе — 8,0 (8,0; 9,0)/9,0 (9,0; 10,0) баллов.
Высокая частота МФН (табл. 5) у новорожденных от матерей с ГСД (более половины обследованных) отнюдь не была обусловлена сроком гестации. Средний срок, при котором произошло родоразрешение пациенток с ГСД, составил 39,5 (38,5; 40,0) недели: у родивших младенцев с признаками МФН — 39,5 (38,0; 39,5) недели, без таковых — 39,5 (38,5; 40,0) недели (p > 0,05).
Таблица 5
Основные осложнения раннего неонатального периода у новорожденных от матерей с гестационным сахарным диабетом (ГСД) и без него, n (%)
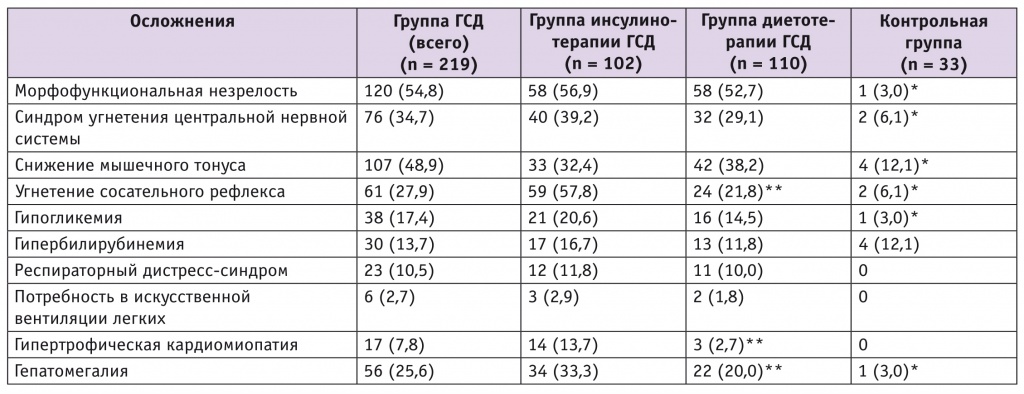
Как следует из данных таблицы 5, синдром угнетения ЦНС осложнил ранний неонатальный период трети новорожденных от матерей с ГСД, а при ДФ — уже двух третей (n = 59, 60,8%), тогда, как в контрольной группе это осложнение встречалось лишь у двоих младенцев (см. табл. 5).
Актуальность проблемы перинатальных поражений ЦНС детей от матерей с ГСД подтверждена результатами постнатальной сонографии (третьи сутки жизни). Повышенная эхогенность перивентрикулярной зоны выявлена у 111 (50,7%) новорожденных от матерей с ГСД, тогда как в контрольной группе — у 7 (21,2%), т. е. в 2,4 раза реже (р < 0,05). При ДФ этот признак встречался еще чаще — у 58 (59,8%) новорожденных.
Снижение мышечного тонуса, угнетение рефлексов при оценке рожденных в родзале отмечали также у половины новорожденных от матерей с ГСД (см. табл. 5), вялое сосание — у трети, тогда как в контрольной группе — лишь у двоих. Подавляющее большинство детей с ДФ (n = 74, 76,3%) вообще не смогли осуществить акт сосания при раннем прикладывании к груди.
Согласно данным таблицы 5, состояние новорожденных от матерей, получавших инсулинотерапию, было более тяжелым, чем у младенцев, чьи матери находились на диетотерапии, хотя оценки по шкале Апгар у них практически не различались, а частота макросомии была большей. Так, перинатальное поражение ЦНС в 1,3 раза, а снижение сосательного рефлекса — в 2,6 раза чаще наблюдалось у новорожденных от матерей на инсулинотерапии по сравнению с детьми матерей, только соблюдавших диету (для последнего признака различия статистически значимы, р < 0,05).
Гипогликемия также несколько чаще встречалась у детей из группы инсулинотерапии, чем из группы диетотерапии: у каждого 5-го и у каждого 7-го соответственно. Однако различия не были статистически значимыми.
Гипербилирубинемия имела место значительно реже — лишь у 13,7%, что сопоставимо с контрольной группой (12,1%).
Тяжелые «типичные» осложнения, характерные для детей от матерей с СД, отмечены лишь у небольшого числа новорожденных, из них наиболее частой была гепатомегалия: у 56 (25,6%), а при ДФ — у 45 (46,4% от 97); респираторный дистресс-синдром — у 23 (10,5%), при этом 20 из них имели диагноз ДФ (20,6% от 97).
Гипертрофическая кардиомиопатия диагностирована у 17 (7,8%, все дети с ДФ). Как следует из таблицы 5, в группе инсулинотерапии дети в 5,1 раза чаще страдали кардиомиопатией, чем рожденные от матерей из группы диетотерапии. С сопоставимой частотой как в контрольной группе, так и у новорожденных от матерей с ГСД встречались пороки сердца: 21 (9,6%) и 4 (12,1%) соответственно (p > 0,05). Основную часть из них составляли малые (клапанные) пороки: дефекты межжелудочковой и межпредсердной перегородок (19 (8,7%) в группе ГСД).
ОБСУЖДЕНИЕ
Проведенный анализ подтвердил значимость основных диабетогенных факторов — возраста и избыточной прегестационной массы тела. Более того, можно говорить о своеобразном «патологическом дуэте» — ожирении и ГСД. Примерно у половины пациенток с ГСД ожирение носило семейный характер, встречалось среди родственников 1-й и 2-й линии. Генетический и/или эпигенетический характер ожирения, метаболического синдрома на сегодняшний день можно считать доказанным фактом [2, 10, 11]. ГСД, бесспорно, следует рассматривать как одно из проявлений метаболического синдрома.
Вопрос назначения препаратов прогестерона, особенно у пациенток с прегестационной ИР, является крайне актуальным сегодня ввиду широкого распространения ВРТ и прочного внедрения данных препаратов в арсенал терапевтических средств. Что первично: низкий уровень эндогенного прогестерона в первой половине беременности у пациенток с ГСД [12] или провоцирующие гипергликемию действия экзогенных препаратов прогестерона? Данные литературы совершенно полярны: от констатации высоких показателей ИР у получавших аналоги прогестерона до отсутствия сколько-нибудь значимого влияния [13–15]. Наше исследование констатирует значимое (в 1,6 раза) увеличение доли пациенток, получавших аналоги прогестерона, в группе с ГСД по сравнению с контрольной. Несомненно, вопрос требует дальнейшего изучения.
Макросомия была у каждого четвертого новорожденного в группе ГСД. Это согласуется с современными данными о частоте макросомии при ГСД в развитых странах: 14,6–45,0% [5, 16].
В масштабном популяционном исследовании C. Billionnet и соавт. (2017) [5] отметили, что масса плода более 4000 г у пациенток, получавших инсулинотерапию, встречалась чаще, чем у находившихся на диетотерапии (18,2% и 14,6% соответственно). Это послужило одним из оснований считать ГСД, требующий инсулинотерапии, более серьезной формой нарушения углеводного обмена.
Согласно нашим данным, наблюдается диаметрально противоположная ситуация (см. табл. 3), что может быть связано с запаздыванием диагностики ГСД и несвоевременным назначением инсулинотерапии. Дети матерей, получавших только диетотерапию, были крупнее (масса тела, индекс Кетле-I), чем у находившихся на инсулинотерапии (хотя различия и не являются статистически значимыми, p > 0,05). Поэтому нельзя не согласиться с J. Crus и соавт. (2015), считающими, что макросомия плода является своеобразным показателем качества оказания акушерской и эндокринологической помощи при ГСД. По данным авторов, одна из ведущих причин высокой частоты макросомии — запаздывание диагностики (выявление ГСД позже 26 недель гестации) [17].
Помимо медико-социальных аспектов, среди значимых факторов риска макросомии плода при ГСД обычно выделяют прегестационную ИР (в первую очередь ожирение), а также избыточное ГУМТ [17–19].
Важность показателей ГУМТ именно в первой половине беременности как самостоятельного фактора риска ГСД отмечает ряд авторов [20, 21]. D. Boriboonhirunsarn и соавт. (2017) [20] показали, что прибавка в весе более 7 кг за I–II триместр в 2,3 раза увеличивает риск ГСД. Наши результаты полностью подтверждают эти данные. Таким образом, крайне важен контроль ГУМТ начиная с ранних сроков гестации.
Согласно нашему исследованию, оценки новорожденных по шкале Апгар во всех анализируемых группах не различались. Это подтверждает мнение многих авторов, что в современных условиях преобладания нетяжелых форм ДФ при ГСД у матери оценка по шкале Апгар не может быть достаточным критерием состояния здоровья новорожденных [3, 16, 22]. Согласно K.P. Yeagle и соавт. (2018), оценка по шкале Апгар новорожденных от матерей с ГСД позволяет лишь понять, есть ли у ребенка потребность в реанимационной помощи. Данная ситуация обусловлена тем, что на первое место выходят функциональные проблемы: проявления МФН, перинатальное поражение ЦНС.
Полученные результаты полностью коррелируют с данными литературы о высокой частоте неврологических нарушений у новорожденных при ГСД матери [6, 23]. В частности, для таких младенцев характерен синдром угнетения ЦНС. Причины этого разнообразны: начиная от морфологических изменений формирующейся на фоне гипергликемии плаценты (отек, фиброз стромы и др.), перекрестного реагирования белков нервной ткани с антителами к инсулину и его рецепторам до затрудненных родов при макросомии [23, 24].
Один из наиболее обсуждаемых вопросов — влияние терапии ГСД, получаемой во время беременности, на частоту гипогликемии новорожденного. Тогда как некоторые исследователи отмечают более высокую частоту гипогликемии у детей при применении инсулинотерапии во время беременности (по сравнению с таковой при использовании диеты или пероральных антидиабетических средств) [25, 26], другие такую зависимость не выявляют [27]. Возможно, риск неонатальных осложнений обусловлен не характером терапии, а тем, что пациентки, имеющие потребность в инсулине, отличались более высоким «базовым» риском, прегестационным ожирением, чрезмерным ГУМТ и другими отягчающими факторами. Гипогликемия также несколько чаще встречалась у детей от матерей из группы инсулинотерапии.
Таким образом, современные особенности течения и современный уровень диагностики ГСД обусловливают изменения статуса здоровья новорожденных. Тяжелые «типичные» формы ДФ не являются ведущими в структуре неонатальной заболеваемости. Основные проявления неблагополучия в раннем неонатальном периоде связаны с МФН, перинатальным поражением ЦНС, дезадаптацией в раннем неонатальном периоде. Однако данные МФН, как правило, связаны с эпигенетическими изменениями, что в условиях пандемии метаболического синдрома резко актуализирует проблему ГСД.
ЗАКЛЮЧЕНИЕ
Состояние в раннем неонатальном периоде новорожденных от матерей с гестационным СД (ГСД) определяется преимущественно морфофункциональными нарушениями. Заболеваемость новорожденных от матерей, получавших инсулинотерапию, была выше, чем детей, матери которых получали диетотерапию ГСД: гипертрофическая кардиомиопатия встречалась в 5,1 раза чаще, угнетение рефлекторной деятельности (сосательного рефлекса) — в 2,6 раза чаще, имелась тенденция к более частым перинатальному поражению ЦНС и гипогликемии.
Вследствие запаздывания диагностики ГСД, несвоевременного начала инсулинотерапии отмечалась тенденция к увеличению частоты макросомии среди детей пациенток, получавших только диету, по сравнению с таковой у младенцев, матери которых находились на инсулинотерапии.
Значимым фактором, определяющим массу плода при ГСД, является гестационное увеличение массы тела в I триместре.
Необходимо избегать необоснованного назначения аналогов прогестерона беременным с прегестационной инсулинорезистентностью. Обследованные с ГСД получали аналоги прогестерона в 1,6 раза чаще, чем беременные без нарушений углеводного обмена.








