Ремоделирование сердца представляет собой процесс комплексного нарушения его структуры и функции и включает увеличение массы миокарда, дилатацию полостей и изменение геометрической характеристики желудочков [3]. Имеются данные о влиянии ремоделирования сердца на прогноз в отношении не только возникновения аритмий, становления и прогрессирования сердечной недостаточности, но и в отншении сердечно-сосудистой смертности [1], так, от прогрессирования и декомпенсации ХСН умирает до 57% пациентов
При СД 2 типа (СД2) именно сердце признается важнейшей мишенью поражения. Сочетание инсулинорезистентности, гиперинсулинемии, гипергликемии ускоряет развитие и прогрессирование заболеваний, связанных с атеросклерозом, повышая риск сердечно-сосудистых осложнений [5]. Ранним маркером поражения миокарда при СД2 считают диастолическую дисфункцию (ДД) ЛЖ, отмечена патогенетическая взаимосвязь ДД и гипертрофии ЛЖ при развитии и прогрессировании ХСН [11]. Несмотря на имеющийся материал о патогенезе ремоделирования, результаты работ не отражают целостной картины формирования структурно-функциональных нарушений сердца у больных СД2 при ХСН. Вопрос о выраженности изменений сердца и факторов риска ремоделирования ЛЖ при СД2 остается нерешенным.
Цель исследования: изучение показателей структурно-функционального ремоделирования сердца у больных СД2 в зависимости от факторов кардиоваскулярного риска
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в соответствии с протоколом, утвержденным решением локального этического комитета ГБОУ ДПО «Пензенский институт усовершенствования врачей» Минздрава России.
Дизайн: открытое рандомизированное исследование с параллельными группами, продолжительность клинико-диагностического наблюдения составила 3 года. От каждого пациента было получено информированное согласие на добровольное участие в исследовании.
Под наблюдением находились 165 больных (91 мужчина и 74 женщины), средний возраст — 58,3 ± 4,9 года.
В группу I (n = 40) включили пациентов с СД2 без сердечно-сосудистых заболеваний в анамнезе, в группу II (n = 60) — с СД2 и АГ 1–2-й степени, в группу III (n = 65) — больных ИБС при наличии СД2 и АГ (табл. 1).
Таблица 1
Клиническая характеристика больных
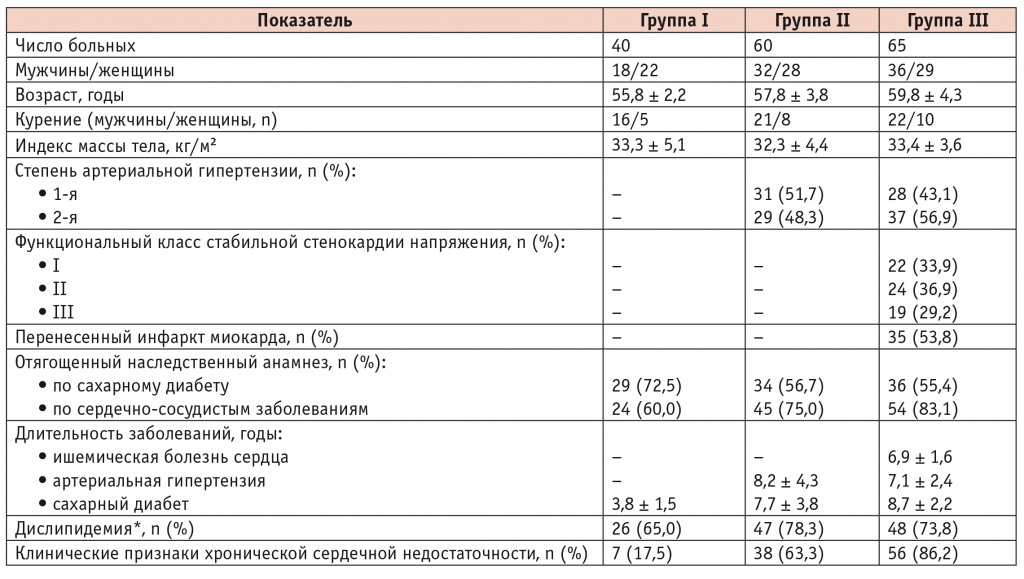
* Общий холестерин (ХС) менее 4,0 ммоль/л; ХС липопротеидов низкой плотности менее 1,8 ммоль/л; ХС липопротеидов высокой плотности более 1 ммоль/л у мужчин и более 1,2 ммоль/л у женщин; триглицериды менее 1,7 ммоль/л.
Критериями включения в исследование являлись наличие СД2, диастолическая сердечная недостаточность при фракции выброса (ФВ) ЛЖ более 50%. Дополнительным критерием для отбора пациентов в группу II считали АГ с повышением показателей систолического АД не более 180 мм рт. ст. и диастолического АД не более 110 мм рт. ст., в группу III — наличие ИБС (стабильной стенокардии напряжения) со стабильным течением на протяжении предшествующего месяца. Функциональный класс ХСН определяли согласно критериям NYHA и Национальных рекомендаций Всероссийского научного общества кардиологов по диагностике и лечению ХСН [7]. Уровень гликозилированного гемоглобина у пациентов составлял 6,7 ± 2,8%.
Критерии исключения: АД выше 180/110 мм рт. ст. (АГ 3-й степени); хронические заболевания легких с дыхательной недостаточностью; хроническая печеночная недостаточность; хроническая почечная недостаточность; ХСН IV функционального класса; наличие в анамнезе мозгового инсульта.
Обследование, кроме проведения клинико-лабораторных исследований, включало ЭКГ в 12 отведениях, ЭхоКГ, холтеровское мониторирование ЭКГ, суточное мониторирование АД (СМАД), регистрацию сигнал-усредненной ЭКГ (СУ-ЭКГ) с выделением поздних потенциалов желудочков (ППЖ), анализ вариабельности ритма (ВРС) и турбулентности ритма сердца.
ЭхоКГ выполняли на аппарате VIVID E9 (GE Healthcare) в режиме секторального сканирования с использованием цветового доплеровского картирования, тканевого, импульсного и непрерывноволнового доплеров.
В качестве диагностических критериев нарушения диастолической функции ЛЖ использованы ультразвуковые нормативы Европейского общества кардиологов, рекомендованные Всероссийским научным обществом кардиологов [7]:
-
соотношение Е/А < 1 или > 2, где Е — максимальная скорость кровотока раннего диастолического наполнения (см/с), А — максимальная скорость кровотока во время предсердной систолы (см/с);
-
время замедления кровотока раннего диастолического наполнения ЛЖ (DT) < 150 или > 220 мс;
-
время изоволюметрического расслабления (IVRT) < 60 или > 100 мс.
Типы ДД ЛЖ: аномальная релаксация (Е/А < 0,9; DT > 240 мс), псевдонормальный (1,1 ≤ Е/А ≤ 2) и рестриктивный (E/A > 2; DT < 160 мс). Для оценки выраженности диастолических нарушений применялась тканевая доплерография с изучением максимальных скоростей движения фиброзного кольца митрального клапана: Е′ (см/с) — пиковая скорость раннего диастолического расслабления, А′ (см/с) — пиковая скорость в фазу систолы предсердий; отношение максимальной скорости раннего наполнения ЛЖ (Е) к максимальной скорости движения фиброзного кольца митрального клапана в раннюю диастолу (Е′).
На основе показателей относительной толщины стенки (ОТС) и индекса массы миокарда (ИММ) ЛЖ оценивали геометрическую модель ЛЖ и выделяли типы его ремоделирования: нормальная геометрия — при нормальном значении ИММ ЛЖ и ОТС ЛЖ < 0,45; концентрическое ремоделирование — при нормальном ИММ ЛЖ и ОТС ЛЖ ≥ 0,45; эксцентрическая гипертрофия ЛЖ — при ИММ ЛЖ больше нормы и ОТС ЛЖ < 0,45; концентрическая гипертрофия — при ИММ ЛЖ больше нормы и ОТС ЛЖ ≥ 0,45.
При холтеровском мониторировании ЭКГ (комплекс ООО «ДМС Передовые технологии») анализировали положение сегмента ST в режиме повседневной активности при обязательном ведении пациентом дневника с отражением характера деятельности и субъективных ощущений, рассчитывали общую продолжительность эпизодов ишемии за сутки, максимальную глубину снижения сегмента ST; изучали желудочковые нарушения ритма, суточную вариабельность R-R интервалов, показатели турбулентности ритма сердца (начало турбулентности — ТО, наклон турбулентности — TS).
При СМАД (система BPLab) определяли средние значения АД за сутки, день и ночь; показатели нагрузки давлением (индекс времени гипертензии) за сутки, день и ночь; суточный индекс (степень ночного снижения АД), суточную вариабельность систолического и диастолического АД.
Для анализа ППЖ использовали программное обеспечение аппарата CARDIOVIT AT-10 (Schiller), учитывали показатели СУ-ЭКГ: продолжительность фильтрованного комплекса QRS (HF QRS-Dauer), среднеквадратичную амплитуду последних 40 мс комплекса QRS (RMS 40), продолжительность низкоамплитудных сигналов в конце фильтрованного комплекса QRS (LAH Fd). Патологическими параметрами СУ-ЭКГ считали HF QRS-Dauer более 114 мс, RMS 40 менее 25 мкВ, LAH Fd более 38 мс.
Статистическая обработка и анализ полученных результатов проведены в системе статистического анализа Statistiсa (пакет прикладных программ Statistiсa фирмы StatSoft Inc., версия 6.0.). При оценке линейной связи между величинами вычисляли коэффициент парной корреляции Пирсона (r). При исследовании взаимосвязи между количественными признаками использовался ранговый коэффициент корреляции Спирмена (R). Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Все обследованные пациенты имели сохраненную систолическую функцию ЛЖ при нормальных показателях ФВ более 50% (табл. 2), но при этом у всех больных СД2 отметили ультразвуковые признаки ДД ЛЖ (табл. 3). Аномальная релаксация ЛЖ выявлена у 85% пациентов группы I и у 70% группы II, что статистически значимо выше в сравнении с группой III — 50,8% (p < 0,05). Следует отметить, что ДД ЛЖ была самой выраженной у больных СД2 в сочетании с АГ и ИБС: чаще регистрировались псевдонормальный (30,7%) и рестриктивный (18,5%) типы ДД ЛЖ при увеличении частоты клинических проявлений ХСН (86,2%).
Таблица 2
Морфофункциональные параметры сердца в группах исследования по данным эхокардиографии (М ± m)
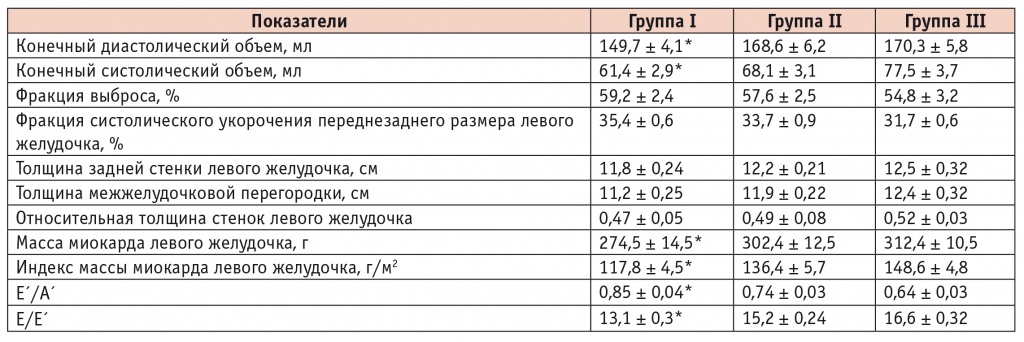
* Отличия группы I от групп II и III статистически значимы (р < 0,05).
Таблица 3
Анализ электрического и структурно-геометрического ремоделирования сердца в группах исследования, n (%)
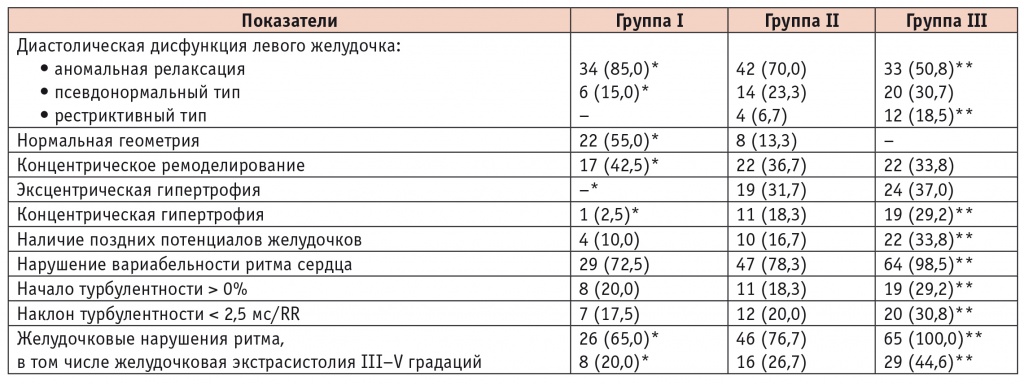
* Отличия группы I от групп II и III статистически значимы (р < 0,05).
** Отличия группы II и от группы III статистически значимы (р < 0,05).
Анализ структурно-геометрических показателей левых камер сердца показал, что в группах II и III в сравнении с группой I имело место нарастание дилатации полостей (конечного диастолического и систолического объема) и увеличение массы миокарда ЛЖ. Установлена корреляционная связь степени тяжести ДД ЛЖ с ФВ ЛЖ: r = –0,48 (р < 0,04); с индексом конечного диастолического объема: r = 0,51 (р = 0,02); с ИММ ЛЖ: r = 0,45 (р = 0,034).
Гипертрофия ЛЖ диагностирована у большинства пациентов группы II (86,7%), у всех больных группы III, в то время как в группе I — только у 45% пациентов (p < 0,05). Анализ индивидуальных данных об ОТС и ИММ ЛЖ позволил определить различные варианты его структурно-геометрического ремоделирования (см. табл. 3). Между группами обнаружены существенные расхождения в характере ремоделирования ЛЖ. В группе I нормальная геометрия отмечена у 22 (55,0%), концентрическое ремоделирование — у 17 (42,5%), концентрическая гипертрофия — у 1 (2,5%) больного.
При сочетании СД2 с АГ (группа II) преобладали концентрическое ремоделирование (36,7%) и эксцентрическая гипертрофия ЛЖ (31,7%). У 11 (18,3%) больных выявлена концентрическая гипертрофия ЛЖ.
В группе III частота различных вариантов ремоделирования ЛЖ была сопоставимой при отсутствии нормальной геометрии ЛЖ. Следует отметить, что именно у пациентов с эксцентрической (n = 24) и концентрической (n = 19) гипертрофией в сравнении с больными с концентрическим ремоделированием ЛЖ (n = 22) была выше частота встречаемости перенесенного инфаркта миокарда (соответственно 16, 17 и 2 пациента) и клинических проявлений ХСН (соответственно 95,8%, 100% и 63,6%).
Учитывая роль гемодинамических нарушений в развитии структурно-геометрических особенностей ремоделирования сердца провели корреляционный анализ параметров структурно-геометрического ремоделирования миокарда ЛЖ с показателями СМАД. Установлена корреляционная связь между недостаточной степенью ночного снижения АД и ОТС ЛЖ (r = 0,59; p < 0,002), патологическим повышением АД в ночные часы и ИММ ЛЖ (r = 0,64; p < 0,003), что указывает на значимость при формировании ремоделирования сердца у больных СД2 при сочетании с АГ не только гемодинамической перегрузки давлением, но и нарушений циркадного ритма АД. Выявлена связь длительности АГ с ИММ ЛЖ (r = –0,59; p < 0,05), с ОТС (r = –0,54; p < 0,05).
Учитывая значение электрического ремоделирования при структурно-геометрических изменениях ЛЖ, провели в собственном исследовании анализ показателей СУ-ЭКГ и ВРС.
Электрическая стабильность миокарда зависит преимущественно от синергизма двух отделов вегетативной нервной системы: симпатической и парасимпатической. Полученные данные свидетельствуют о снижении вагусной активности и нарушении баланса вегетативных влияний в пользу симпатического отдела вегетативной нервной системы. Наиболее низкие значения ВРС отмечены в группе III. Стандартное отклонение от средней длительности всех синусовых интервалов R-R (SDNN) в данной группе — 22,7 ± 3,2 мс, у 38 (58,5%) пациентов значение SDNN не превышало 20 мс. LF/HF — соотношение мощности спектра симпатического и парасимпатического отделов вегетативной нервной системы — составило 5,46 ± 0,31 усл. ед. У больных групп I и II показатели ВРС оказались сопоставимыми (см. табл. 3). В группе I нарушение показателя, отражающего суммарную активность вегетативных воздействий на сердечный ритм, LF/НF (7,84 ± 0,65 усл. ед.) и снижение SDNN менее 50 мс (41,8 ± 5,6 мс) отметили у 72,5% пациентов. В группе II нарушения нейрогуморальной регуляции, указывающие на повышенную симпатическую активность, диагностированы у 78,3% больных: SDNN — 43,7 ± 4,2 мс; LF/HF — 8,39 ± 0,72 усл. ед.
Патологические значения TS (TS < 2,5 мс/RR) и TО > 0% чаще наблюдались в группе III: соответственно у 30,8% и 29,2% пациентов. Выявлена обратная корреляционная связь значений ТО с ФВ ЛЖ (R = –0,497; p < 0,05), изменения TS с ФВ ЛЖ (R = 0,419; p < 0,05). Однако более убедительна связь параметров турбулентности с показателями диастолической функции ЛЖ: ТО с E´/A´ (R = –0,524; p < 0,01) и E/E´ (R = –0,588; p < 0,01); ТS с E´/A´ (R = 0,491; p < 0,05) и E/E´ (R = 0,553; p < 0,05).
Патологические изменения в миокарде сопровождаются различными нарушениями электрической активности сердца, и ППЖ, являясь отражением фрагментированной задержанной электрической активности, прогностически неблагоприятны в плане возникновения фатально опасных нарушений ритма. Частота регистрации патологических показателей СУ-ЭКГ в группе III (33,8%) была больше в сравнении с группой I (10%) и группой II (16,7%), р < 0,05.
Желудочковые нарушения ритма выявлены у всех больных группы III, статистически значимо выше в этой группе, чем в остальных, была частота регистрации желудочковой экстрасистолии высоких градаций (III–V градаций) — 44,6% (p < 0,05). Получена значимая связь желудочковой экстрасистолии IV–V градаций с HF QRS-Dauer (R = 0,694; p < 0,05), с LAH Fd (R = 0,5197; р < 0,05).
ОБСУЖДЕНИЕ
Распространенность СД признается экспертами ВОЗ неинфекционной эпидемией, при этом известно о связанных с ним кардиоваскулярных событиях. Частота ИБС среди больных СД2 выше в 2–4 раза, АГ — в 3 раза, чем среди лиц без этого заболевания. Сочетание ИБС и СД повышает вероятность сердечно-сосудистых осложнений. Течение ИБС часто заканчивается внезапной аритмической смертью, а среди больных СД риск такого исхода увеличивается в 2 раза [4]. Считаем, что у пациентов с СД при сопутствующих АГ и ИБС особая роль в сердечно-сосудистом континууме принадлежит электрическому ремоделированию миокарда. В замедлении развития макрососудистых осложнений, обусловленных метаболическими отклонениями и приводящих к прогрессированию атеросклероза, сердечно-сосудистым катастрофам, состоит главная задача при динамическом наблюдении за пациентами.
Несомненно, дисфункция ЛЖ является серьезным следствием ИБС и АГ, но у больных СД2 ДД сердца может опережать нарушение систолической функции ЛЖ и, более того, изолированно приводить к появлению симптомов ХСН. В нашем исследовании эхокардиографические признаки нарушения диастолической функции при сохраненной ФВ ЛЖ выявлены у всех больных СД2, однако при сочетании СД2 с сердечно-сосудистыми заболеваниями (АГ и ИБС) степень выраженности диастолических расстройств нарастала, что проявлялось в увеличении частоты псевдонормального и рестриктивного типов ДД в группах II и III: соответственно 23,3% и 6,7%; 30,7% и 18,5% (для всех случаев р < 0,05).
В основе формирования дисфункции ЛЖ и ХСН лежат процессы, связанные со структурными изменениями кардиомиоциотов на фоне хронической гипоперфузии, а также повышение диастолической жесткости и нарушение активной релаксации миокарда, реактивные изменения опорно-трофического остова, уменьшение диастолического наполнения и ремоделирование с сегментарными нарушениями структуры [8]. Полученные нами данные позволяют утверждать, что степень выраженности ДД ЛЖ при СД2 является прогностически значимым фактором в формировании ХСН: частота клинических проявлений ХСН в группе I — 17,5%, в группе III — 86,2% (p < 0,03).
Высокий риск развития кардиоваскулярных осложнений при нарушениях углеводного обмена связываем с развитием гипертрофии ЛЖ, его ремоделированием. Преобладание концентрического типа ремоделирования ЛЖ у пациентов групп I (42,5%) и II (36,7%) объясняется компенсаторным характером гипертрофии ЛЖ [2]. С другой стороны, увеличение частоты концентрической и эксцентрической гипертрофии ЛЖ у больных СД2 в сочетании с АГ и ИБС (соответственно 29,2% и 37,0%) может свидетельствовать об усилении структурных и геометрических изменений сердца, способствующих не только нарушению геометрической формы желудочка и увеличению напряжения его стенок, но и дальнейшему возрастанию миокардиального стресса, что сопровождается прогрессированием сердечной недостаточности.
Наши наблюдения указывают на один из важнейших факторов структурно-геометрического ремоделирования ЛЖ — циркадные колебания АД у больных СД2. Получена связь длительности АГ с ИММ ЛЖ (r = –0,59; p < 0,05), с ОТС (r = –0,54; p < 0,05). Активация симпатоадреналовой системы, стимуляция выработки ренина и ангиотензина II с последующим увеличением образования альдостерона способствуют трансформации гиперкинетического варианта гипертензии в объемзависимый, при этом гипертрофические и пролиферативные процессы, приводящие к концентрической гипертрофии ЛЖ, дополняются процессами перегрузки сердца объемом, что приводит к эксцентрическому ремоделированию ЛЖ [10].
Изменения диастолической функции могут служить надежным и чувствительным маркером как раннего, так и более позднего повреждения миокарда. Патологические изменения в миокарде сопровождаются различными нарушениями электрической активности сердца [6]. Анализ ППЖ позволяет оценить аритмогенный субстрат у больных СД2 с ДД ЛЖ. В группе III частота ППЖ выше в сравнении с группой I (соответственно 33,8% и 10,0%). На фоне инсулинорезистентности и гиперинсулинемии в условиях лимитированного коронарного кровотока присутствуют изменения на клеточно-тканевом уровне: гетерогенность сократительного миокарда вследствие чередования кардиомиоцитов с различной активностью оксиредуктаз, их диссеминированные повреждения, гипертрофия, атрофия и апоптоз; интерстициальный отек и явления кардиосклероза, нарушающие консолидацию клеток миокарда. Все эти процессы усиливают проявления негомогенности процессов деполяризации и способствуют формированию ППЖ.
Мы не исключаем, что возможной причиной возникновения фрагментированной электрической активности миокарда у больных групп I (10,0%) и II (16,7%) являются нарушения электрофизиологических свойств кардиомиоцитов, в том числе и вследствие повышения конечного диастолического давления, увеличения степени напряжения стенки ЛЖ.
Негомогенностью электрофизиологических свойств ткани объясняем корреляционную зависимость показателей СУ-ЭКГ: продолжительность фильтрованного QRS комплекса — HF QRS-Dauer, продолжительность замедленной фрагментации LAH Fd с желудочковой экстрасистолией высоких градаций. Негомогенность волны деполяризации миокарда создает условия для формирования аритмогенного субстрата и развития прогностически неблагоприятных желудочковых аритмий.
Считаем, что «болевые точки» дисфункции ЛЖ при СД2 — нарушения нейрогуморальной регуляции: рост альдостероновой и симпатической активности, уровня и активности ангиотензина II, брадикинина, уменьшение парасимпатической и барорецепторной активности [9]. Проведенный анализ показателей вегетативных воздействий на сердечный ритм указывает на повышенную симпатическую активность во всех группах при более выраженных изменениях у больных СД в сочетании с коронарной недостаточностью. Мы выявили положительную связь TO с параметрами СУ-ЭКГ: с продолжительностью фильтрованного QRS комплекса HF QRS-Dauer (r = 0,563; р < 0,05); амплитудой фрагментированной активности RMS (R = 0,472; р < 0,05); продолжительностью LAH Fd (R = 0,495; р < 0,05). Полученные данные позволяют утверждать, что направленность вегетативных изменений в регуляции синусового ритма у больных СД2 не столь однозначна: для определения неблагоприятного прогноза заболевания необходимо учитывать различные составляющие электрической нестабильности сердца.
ЗАКЛЮЧЕНИЕ
Влияние сопутствующей сердечно-сосудистой патологии (АГ, ИБС) при изучении особенностей структурно-функциональной перестройки левых отделов сердца у больных сахарным диабетом 2 типа с формированием дисфункции ЛЖ должно учитываться в прогнозировании кардиоваскулярного риска. Изменения диастолической функции могут служить чувствительным маркером как раннего, так и более позднего повреждения миокарда. Гипертрофия и ремоделирование ЛЖ с сегментарными изменениями структуры обусловливают нарушение диастолической функции ЛЖ, способствуют прогрессированию сердечной недостаточности и формированию электрической нестабильности миокарда.








