Синдром бронхиальной обструкции (БОС) на фоне инфекций нижних дыхательных путей распространен среди детей раннего возраста[1]. Около 30% детей в первые 3 года жизни имеют в анамнезе повторные эпизоды БОС, которые в большинстве случаев купируются к 6 годам[2–4]. Однако в школьном возрасте или во взрослой жизни БОС может вновь появиться после длительного периода ремиссии с последующим формированием бронхиальной астмы (БА)[5].
Известно, что повторные эпизоды БОС у детей, перенесших бронхиолит на первом году жизни, в 34–40% случаев сопровождаются развитием бронхиальной гиперреактивности и в 23–39% случаев — возникновением БА в дошкольном и школьном возрасте[6].
Для определения риска развития БА у детей раннего возраста с повторными эпизодами БОС созданы десятки клинических прогностических моделей, одной из которых является предиктивный индекс астмы (Asthma Predictive Index, API)[7, 8]. Чувствительность и специфичность индекса API как прогностической модели развития БА к 6-летнему возрасту составляют 27% и 96% соответственно[8].
Наряду с созданием клинических прогностических моделей идет поиск биомаркеров — предикторов появления БА. В качестве таких биомаркеров изучались эозинофилы крови, общий и специфические IgE, оксид азота в выдыхаемом воздухе[9]. Так, по данным систематического обзора, предикторами длительного персистирования бронхиальной обструкции, возникшей в раннем возрасте, являются эозинофилия, сенсибилизация к ингаляционным аллергенам, повышение уровня оксида азота в выдыхаемом воздухе[10].
Согласно исследованию Н.М. Anderson и соавт.[11], возрастание числа эозинофилов крови более 300 кл/мкл и сенсибилизация к ингаляционным аллергенам в 2-летнем возрасте в среднем втрое увеличивают шансы развития БА к 6 годам жизни.
В международном согласительном документе Global Strategy for Asthma Management and Prevention (2017) отмечено, что повышение уровня оксида азота в выдыхаемом воздухе у детей раннего возраста с повторными эпизодами бронхиальной обструкции может быть предиктором возникновения БА в школьном возрасте[12].
В качестве нового биомаркера — предиктора развития БА у детей — изучается сывороточный периостин, экспрессируемый эпителиальными клетками, фибробластами и клетками гладкой мускулатуры бронхов под влиянием Th2-опосредованных цитокинов — ИЛ-4 и ИЛ-13[13, 14]. Обнаружена связь между уровнем сывороточного периостина и риском формирования БА: двукратное повышение шансов развития в 6-летнем возрасте при содержании сывороточного периостина в первые 2 года жизни > 140 нг/мл[11].
Исследования возможности использования концентрации сывороточного периостина для оценки риска появления БА у детей с повторными эпизодами БОС единичны.
Цель исследования: изучить уровень сывороточного периостина у детей с повторными эпизодами БОС с положительным и отрицательным индексом API и у здоровых детей 3–4 лет.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено одномоментное исследование уровня сывороточного периостина с формированием трех независимых выборок: I выборка — дети с повторными эпизодами БОС и положительным индексом stringent API; II выборка — дети с повторными эпизодами БОС и отрицательным индексом stringent API; III выборка — здоровые дети.
Исследование проведено с июля по ноябрь 2018 г. на клинической базе ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России в отделении аллергологии и иммунологии КГБУЗ «Клиническая детская больница № 7» (Барнаул).
Критерии включения:
- возраст 3–4 года;
- >3 эпизодов БОС за прошедшие 12 мес (основная группа);
- I или II группа здоровья (контрольная группа);
- информированное добровольное согласие родителей/законных представителей на участие детей в исследовании.
Критерии исключения:
- любое острое заболевание;
- любое заболевание сердца, почек, костей.
Повторные эпизоды БОС диагностировались на основании зафиксированных в истории развития ребенка (форма 112/у) более 3 эпизодов острого обструктивного бронхита за прошедшие 12 месяцев (с июля 2017 г. по июль 2018 г.).
Информацию о группе здоровья участников контрольной группы подтверждали на основании сведений из истории развития ребенка (форма 112/у).
В исследование включали детей 3–4 лет с более чем тремя эпизодами БОС за прошедшие 12 мес, которые наблюдались у городского пульмонолога О.Ю. Беловой (КГБУЗ «Детская городская поликлиника № 1»). При формировании группы детей с БОС был применен метод простой случайной выборки. В список БОС вошли 135 детей, из которых на основании последовательности случайных чисел, сгенерированных на компьютере, произведен случайный отбор 100 детей. Их родители/законные представители были приглашены по телефону принять участие в исследовании, из них 94 дали согласие на участие. Во время визита после сбора анамнеза и осмотра из 94 детей 72 включили в исследование, 24 не включили в связи с несоответствием критериям включения или наличием критериев исключения.
Положительный индекс stringent API устанавливали на основании наличия одного большого критерия (врачебно-верифицированного атопического дерматита у ребенка, врачебно-верифицированной БА у матери и/или отца) или двух малых критериев (врачебно-верифицированного аллергического ринита у ребенка, эпизодов БОС вне острой респираторной инфекции, эозинофилии > 4%)[8].
Диагноз атопического дерматита верифицировали на основании модифицированных диагностических критериев J.M. Hanifin и G. Rajka[15]. Наличие БА у родителей выявляли в результате их опроса во время первого визита в отделение аллергологии и иммунологии КГБУЗ «Клиническая детская больница № 7». Диагноз аллергического ринита ставили при наличии двух симптомов заболевания (ринореи, затруднения носового дыхания, зуда в полости носа, повторяющегося чихания) продолжительностью ≥ 1 ч при уровнях специфических IgE в крови > 0,35 кЕ/л как минимум к одному из ингаляционных аллергенов: клещу домашней пыли Dermatophagoides pteronyssinus, перхоти кошки, перхоти собаки, пыльце березы, тимофеевки, полыни[16].
С целью формирования выборки здоровых детей на информационном стенде поликлиники ФГБОУ ВО «Алтайский государственный медицинский университет» было размещено объявление с приглашением принять участие в исследовании здоровых детей в возрасте 3–4 лет без хронических заболеваний (I или II группы здоровья) с указанием телефона контактных лиц. С ответственным исследователем связались родители/законные представители 31 ребенка. Во время визита после сбора анамнеза и осмотра отобраны 29 детей, соответствовавших критериям включения, 2 ребенка не были включены в связи с наличием критериев исключения.
Из 101 участника исследования 57 (56,4%) — мальчики, 44 (43,6%) — девочки. Статистически значимых различий по полу и возрасту между детьми с повторными эпизодами БОС и здоровыми не было.
Средний возраст детей с повторными эпизодами БОС составил 3,6 ± 0,3 года, контрольной группы — 3,8 ± 0,4 года (p > 0,05), мальчиков в группе детей с обструкцией было 40 (55,5%), в контрольной группе — 17 (58,6%) (р > 0,05). Из 72 детей с БОС у 39 отмечен положительный индекс stringent API, у 33 — отрицательный. Клиническая характеристика участников с БОС представлена в таблице.
Таблица
Клиническая характеристика пациентов с повторными эпизодами синдрома бронхиальной обструкции (БОС), n (%)
Взятие крови из вены для определения уровня сывороточного периостина, специфических IgE и эозинофилов проводилось однократно в объеме 5 мл в 3 пробирки (1 мл — для общего анализа крови, 3 мл — специфических IgE, 1 мл — периостина) в отделении аллергологии и иммунологии КГБУЗ «Клиническая детская больница № 7» (Барнаул).
Определение уровня сывороточного периостина. Кровь после взятия в течение 2 ч выдерживали при комнатной температуре (18–25 °С), далее образцы центрифугировали в течение 20 мин при 1000 об/мин. Полученную сыворотку хранили при –20 °С в течение месяца. Определение уровня сывороточного периостина проводили в лаборатории поликлиники ФГБОУ ВО «Алтайский государственный медицинский университет» (Барнаул) методом твердофазного ИФА (ELISA) с использованием реагентов (каталог НПО «Иммунотэкс», Россия; номер в каталоге — 9Е338А6327) и по протоколам Cloud-Clone Corp. (США). Аналитическая чувствительность метода < 0,056 нг/мл, коэффициент вариации, заявленный производителем, < 10%.
Определение специфических IgE. Кровь после забора центрифугировали 10 мин при 3000 об/мин. Полученную сыворотку хранили при 2–8 °С в течение не более 2 ч и затем транспортировали (в течение 20 мин) при 2–8 °С в вертикальном положении в офис лаборатории «Гемотест» (Барнаул), последующая транспортировка образцов в лабораторию «Гемотест» (Москва) осуществлялась самолетом в течение суток. Специфические IgE к шести ингаляционным аллергенам (клещу домашней пыли Dermatophagoides pteronyssinus, перхоти кошки, перхоти собаки, пыльце березы, тимофеевки, полыни) определяли методом иммунофлюоресценции c реагентами серии ImmunoCAP (Thermo Fisher Scientific, Швеция) на автоматическом анализаторе Phadia ImmunoCAP 250 (Phadia АВ, Thermo Fisher Scientific, Швеция).
Число эозинофилов в венозной крови оценивали на гематологическом анализаторе Mindray BС-5800 в лаборатории КГБУЗ «Клиническая детская больница № 7» (Барнаул).
Процедуры статистического анализа выполнялись с помощью пакета статистических программ SAS Statistical Software, версия 9.4 (SAS Institute Inc., США). Нормальность распределения количественных признаков в группах сравнения проверяли с использованием критерия Шапиро — Уилка. Описание количественных признаков выполнено с указанием медианы (25-й; 75-й процентили), за исключением возраста, который представлен как среднее и стандартное отклонение.
Для сравнения центральных параметров групп с нормальным распределением признаков применяли t-критерий Стьюдента (возраст), для сравнения параметров с ассиметричным распределением (результаты лабораторных исследований) — непараметрический критерий (U-критерий Манна — Уитни). Для сравнения частотных признаков в группах использовали критерий χ2 Пирсона.
Диагностическую ценность сывороточного периостина определяли путем ROC-анализа. Площадь под ROC-кривой (area under curve, AUC) 0,5–0,6 считали критерием неудовлетворительной информативности исследуемого показателя, 0,6–0,7 — слабой, 0,7–0,8 — удовлетворительной, 0,8–0,9 — хорошей, 0,9–1,0 — отличной информативности[17].
Исследование одобрено локальным независимым комитетом по этике при ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России (протокол № 11 от 17.10.2017 г.).
РЕЗУЛЬТАТЫ
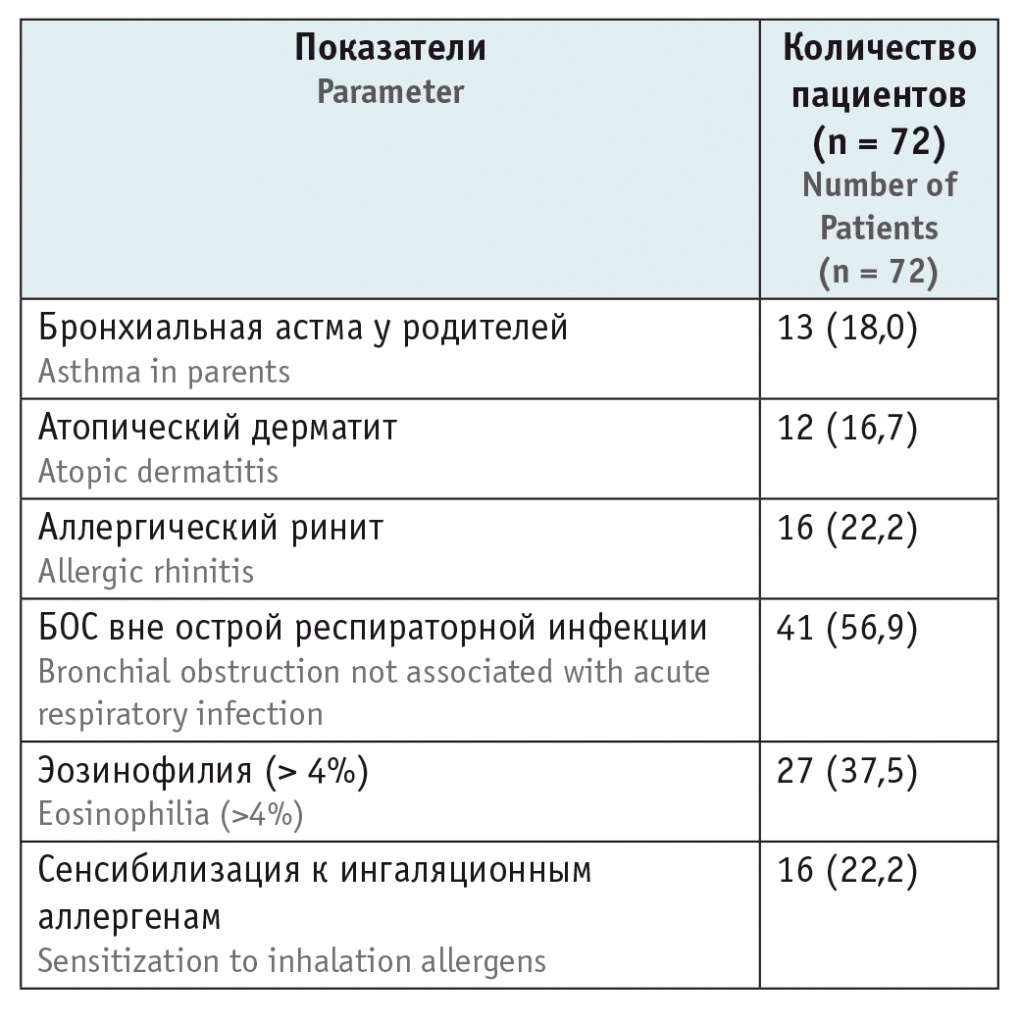
Статистически значимые различия в уровне сывороточного периостина между детьми с повторными эпизодами БОС и здоровыми не выявлены (рис. 1). Он составил 3,0 (1,8; 4,0) нг/мл у детей с БОС и 2,7 (1,7; 3,6) нг/мл у здоровых детей (p = 0,29).
Рис. 1. Уровень сывороточного периостина у детей с повторными эпизодами синдрома бронхиальной обструкции (БОС) и здоровых детей (медиана, 1-й и 3-й квартили)
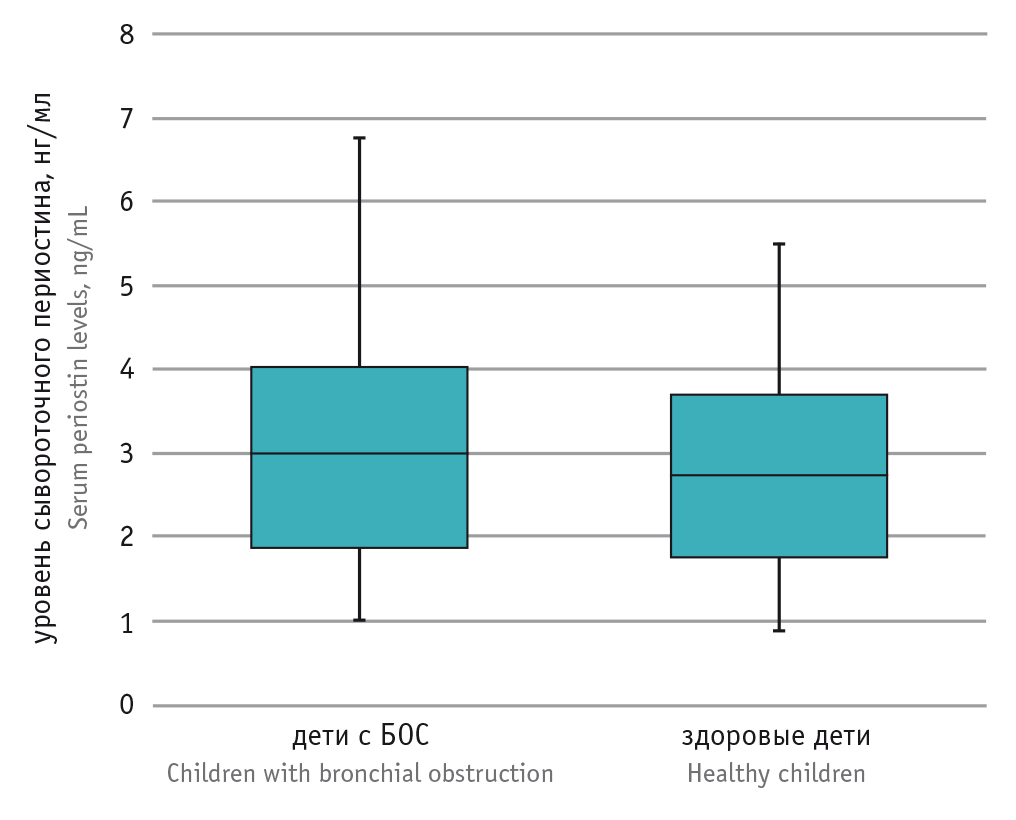
Для оценки диагностической эффективности концентрации сывороточного периостина проведен ROC-анализ (рис. 2). AUC — 0,56 (95%-ный ДИ: 0,41–0,68).
Рис. 2. ROC-анализ для сывороточного периостина
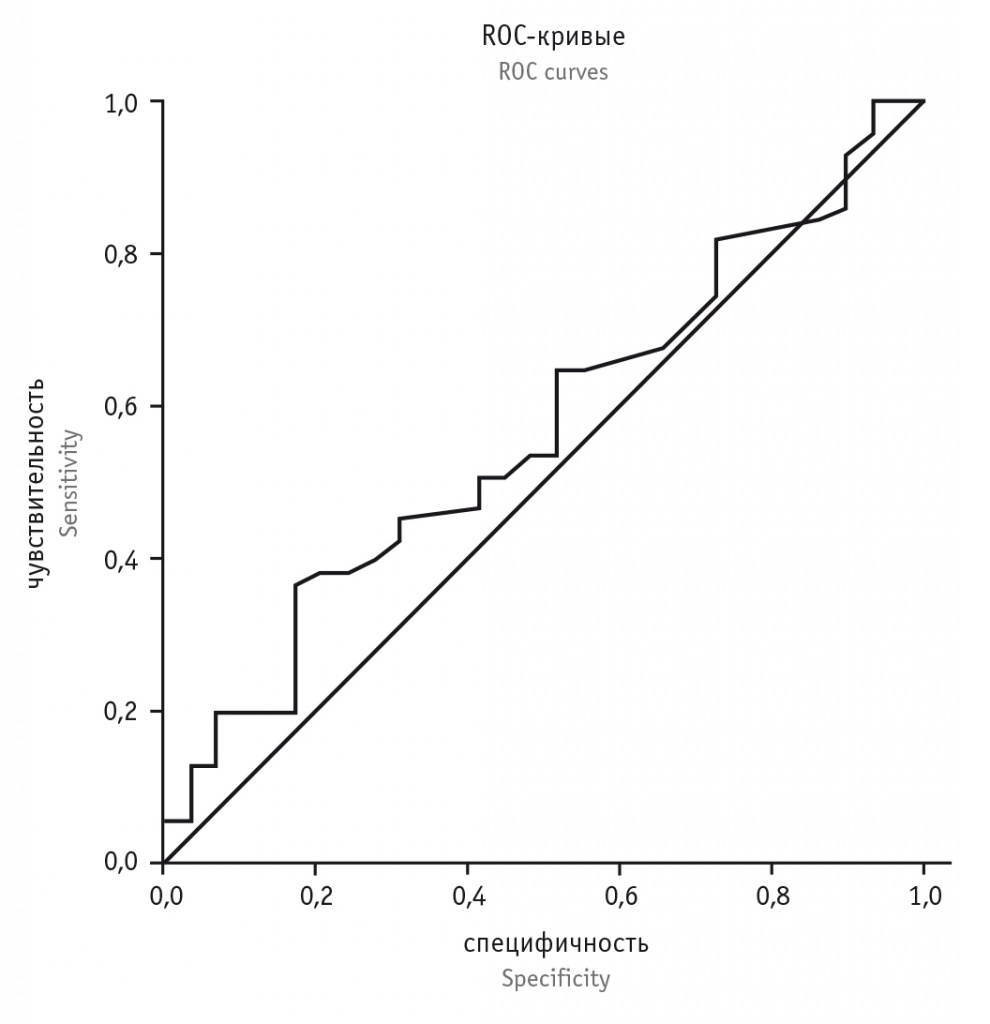
При сравнении содержания сывороточного периостина у участников с положительным и отрицательным индексом stringent API и у здоровых детей статистически значимые различия также не найдены (рис. 3). Уровень сывороточного периостина составил 2,5 (1,8; 4,0) нг/мл у детей с положительным индексом API, 3,2 (1,9; 4,0) нг/мл — с отрицательным, 2,7 (1,7; 3,6) нг/мл — у здоровых детей.
Рис. 3. Уровень сывороточного периостина у детей с повторными эпизодами синдрома бронхиальной обструкции с положительным и отрицательным Asthma Predictive Index (API) и у здоровых детей (медиана, 1-й и 3-й квартили)
ОБСУЖДЕНИЕ
Уровень сывороточного периостина у детей с повторными эпизодами БОС с положительным и отрицательным индексом stringent API и здоровых сверстников статистически значимо не отличается.
Cогласно исследованию J.A. Castro-Rodríguez и соавт.[8], почти у трети детей дошкольного возраста с повторными эпизодами БОС и положительным индексом stringent АРI к 6-летнему возрасту развивается БА, в связи с чем нами была выдвинута гипотеза о возможном увеличении содержания сывороточного периостина у детей этой категории. В случае его повышения можно было бы рассматривать сывороточный периостин как биомаркер — педиктор развития БА у детей с повторными эпизодами БОС. Однако наша гипотеза не подтвердилась. Статистически значимых различий в уровне сывороточного периостина между сравниваемыми группами не было.
При анализе базы данных Medline нами найдены лишь две публикации, посвященные определению уровня сывороточного периостина у детей дошкольного возраста с повторными эпизодами БОС. J.A. Castro-Rоdríguez и соавт. сравнили уровень сывороточного периостина у детей с положительным и отрицательным индексом API[18]. Здоровые дети в качестве контрольной группы в этом исследовании участия не принимали. Статистически значимые различия в концентрации сывороточного периостина между двумя группами не обнаружены (p = 0,9). При проведении ROC-анализа для сывороточного периостина AUC составила 0,50.
В. Коksal и соавт., как и мы, сравнили уровень сывороточного периостина у детей с повторными эпизодами БОС с положительным и отрицательным индексом API и у здоровых детей младше 4 лет[19]. Статистически значимые различия также не выявлены.
ЗАКЛЮЧЕНИЕ
Результаты нашего исследования согласуются с результатами ранее опубликованных работ. Полученные данные не позволяют рассматривать сывороточный периостин как потенциальный биомаркер — предиктор развития бронхиальной астмы (БА) у детей с повторными эпизодами синдрома бронхиальной обструкции (БОС). Однако все три исследования имеют одномоментный дизайн, что не позволяет дать точную оценку диагностической ценности содержания сывороточного периостина как предиктора развития БА при повторных эпизодах БОС, для изучения которой необходимо провести лонгитудинальное исследование.
Благодарности: коллектив авторов благодарит Леонова В.П., к. т. н., и сотрудников Центра «Биостатистика» за проведение статистического анализа данных, а также Белову О.Ю., пульмонолога КГБУЗ «Детская городская поликлиника № 1» (Барнаул), за оказанную помощь в проведении исследования.








