Данный обзор имеет своей целью освещение представлений о современных методах выявления антифосфолипидных антител (АФА) в крови. АФА — семейство антител, которые взаимодействуют с фосфолипидами, фосфолипидно-белковыми комплексами и фосфолипидсвязывающими, или кофакторными, белками. Патогенетически значимые АФА связываются со скрытым эпитопом кофакторных белков, т. е. связывание аутоантител и белков является конформационно-зависимым. Естественный антикоагулянт иммунорегулирующий белок β2-гликопротеин I — наиболее полно изученный кофактор АФА, который при взаимодействии с фосфолипидами изменяет конформацию и экспонирует неоэпитоп в домене 1[1]. Реже выявляются антитела к другим плазменным белкам, способным менять конформацию при взаимодействии с фосфолипидным бислоем, в том числе к протромбину и аннексину V.
Отдельно рассматривают АФА к отрицательно заряженным и нейтральным фосфолипидам, в том числе к кардиолипину, фосфатидилсерину, фосфатидилэтаноламину, аннексину, протромбину, фосфатидилглицеролу, фосфатидилинозитолу, фосфатидиловой кислоте, фосфатидилхолину и др. Однако АФА часто встречаются при инфекционных процессах, поэтому их обнаружение является низкоспецифичным.
Обычно АФА выявляют с помощью иммунометрических тестов, а также функционального коагуляционного теста, известного как тест на наличие волчаночного антикоагулянта (ВАК)[2]. Это целый комплекс коагуляционных тестов, выявляющий подавление фосфолипидзависимых коагуляционных реакций под действием антител при отсутствии дефицита факторов свертывания крови[3].
Имеются сведения о высокой частоте развития тромбозов и привычного невынашивания беременности у лиц с положительным результатом анализа на наличие АФА в сыворотке крови[4]. Основными тромбогенными механизмами считают взаимодействие АФА с системой плазменного гемостаза и системой антикоагулянтов, однако установлено также воздействие аутоантител на тромбоциты и эндотелиоциты.
Исследовано in vitro и in vivo множество моделей действия аутоантител, которые могут нарушить процесс коагуляции как напрямую, так и опосредованно — влияя на иммунные, стромальные, эндотелиальные, плацентарные клетки, что вызывает широкий спектр патогенных реакций. Отмечена способность АФА реагировать с фосфолипидсвязывающими белками на мембранах разных типов клеток, что приводит в конечном счете к их активации[4]. При ассоциированном с АФА невынашивании беременности они взаимодействуют с человеческим трофобластом, что обусловливает повреждение клеток и усиливает апоптоз, ингибирует пролиферацию, формирование синцития, снижает выработку хорионического гонадотропина, нарушает секрецию факторов роста и ослабляет естественные инвазивные свойства.
Определение уровня АФА входит в критерии диагностики системной красной волчанки (СКВ), разработанные Международной коллаборацией клиник по проблеме СКВ (англ. Systemic Lupus International Collaborating Clinics, SLIСС) и пересмотренные в 2012 г.[5], а также в критерии диагностики антифосфолипидного синдрома (АФС)[2]. Серологический маркер СКВ в рекомендациях SLIСС — уровень антител к кардиолипину. Для диагностики АФС выявляют ВАК и антитела (IgG и IgM) к кардиолипину, а также антитела (IgG и IgM) к β2-гликопротеину I. Диагноз АФС ставят при обнаружении антител (IgG/IgM) к кардиолипину и ВАК при повторном исследовании спустя 12 недель, причем в среднем или высоком титре (≥ 40 U или выше 99-го перцентиля), что позволяет исключить наличие транзиторных АФА.
Большинство исследователей отмечает высокую частоту выявления АФА при многих заболеваниях: аутоиммунных (первичном билиарном циррозе, аутоиммунных заболеваниях щитовидной железы, ревматоидном артрите, синдроме Шегрена, системной склеродермии, целиакии и саркоидозе), инфекционных (гепатите С, ВИЧ-инфекции, парвовирусной, микоплазменной, стрептококковой инфекции, туберкулезе), лимфопролиферативных и онкологических. Однако АФА также иногда обнаруживаются у здоровых людей (у 10–12% пожилых и 1–2% молодых), у которых их наличие не приводит к развитию тромбозов и невынашиванию беременности[6–10]. В связи с этим предполагается, что для запуска патогенетических механизмов недостаточно наличия АФА — необходимо дополнительное воздействие, которое усугубляет тромбогенный эффект аутоантител[11]. Такое воздействие оказывают факторы сердечно-сосудистого риска (например, артериальная гипертензия, СД и ожирение), приобретенного тромботического риска (например, курение, оральная контрацепция и беременность), генетические факторы гиперкоагуляции (например, мутация в гене фактора V Лейдена или в гене фактора II, а также в генах протеинов C и S) и острые инфекции. Кроме того, действие АФА может быть обусловлено их эпитопной специфичностью. Недавно было показано, что антитела к β2-гликопротеину I подразделяются на антитела к домену 1, которые связаны с клиническими проявлениями АФС, и антитела к домену 4/5, которые чаще выявляются при инфекционных заболеваниях и ассоциированы с развернутой картиной АФС[12, 13]. В настоящий момент метод выявления патогенетически значимых АФА так и не разработан.
Таким образом, при определении риска развития тромбоза большое значение имеет спектр АФА. В нескольких исследованиях продемонстрирована тесная связь между спектром выявляемых АФА (ВАК, антитела к кардиолипину и β2-гликопротеину I) и клиническими проявлениями АФС. Так, V. Pengo и соавт. показали, что одновременное обнаружение нескольких АФА позволяет точнее определить риск развития тромбоэмболии или выкидыша[14]. Пациенты, у которых выявлены одновременно антитела к кардиолипину и β2-гликопротеину I в среднем или высоком титре и ВАК, относятся к группе крайне высокого риска развития клинических проявлений.
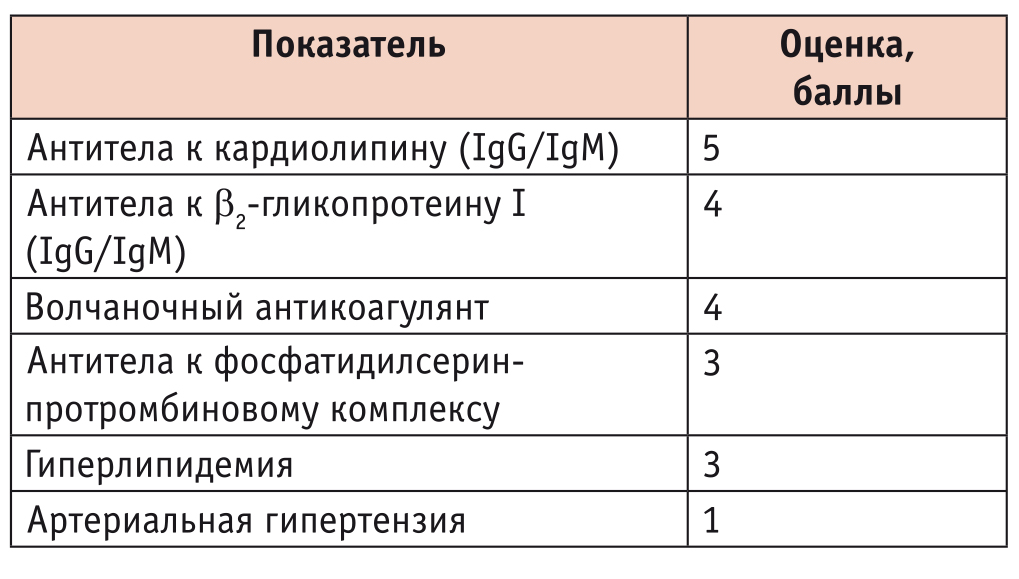
В попытках количественно оценить вероятность развития тромбозов K. Otomo и соавт. в 2012 г. разработали диагностический комплекс, включающий 5 коагуляционных тестов для выявления ВАК и 6 ИФА-тестов для выявления антител (IgG/IgM) к кардиолипину, β2-гликопротеину I, фосфатидилсерин-протромбиновому комплексу[15]. Для количественной оценки риска тромбоза S. Sciascia и соавт. в 2013 г. предложили шкалу GAPSS (англ. Global Anti-Phospholipid Syndrome Score)[16]. Она включает анализ нескольких комбинаций независимых факторов риска тромбоза, уточнение сердечно-сосудистых факторов риска, определение спектра АФА, а также других аутоантител (табл. 1). Шкала GAPSS позволяет рассматривать АФА не только как диагностический маркер АФС и СКВ, но и как предиктор развития тромбозов и патологии беременности.
Таблица 1
Шкала оценки риска тромбоза при антифосфолипидном синдроме (Global Anti-Phospholipid Syndrome Score)[16]
ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
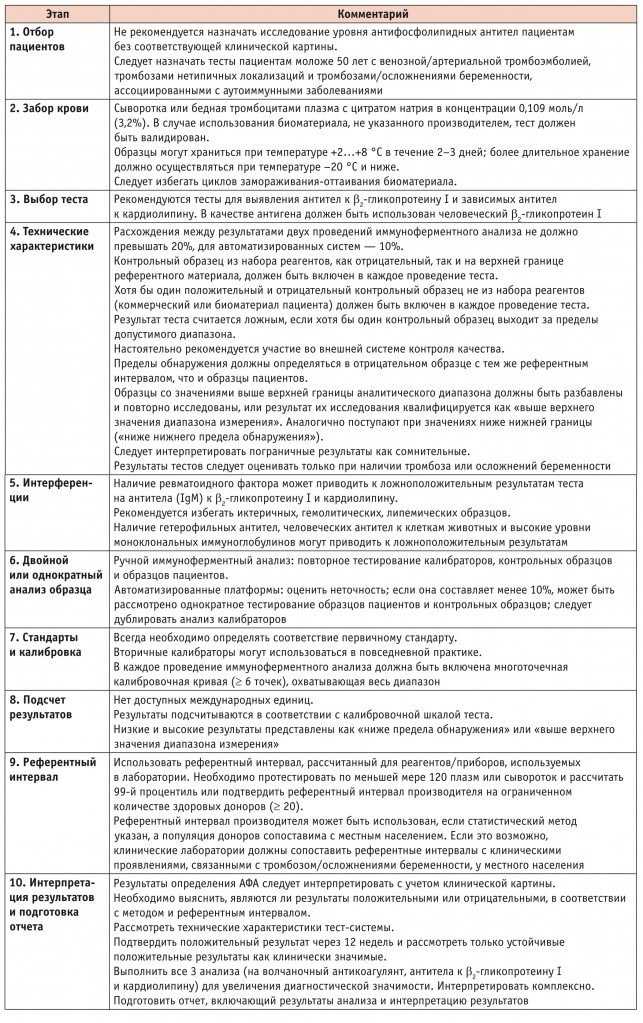
В большинстве клинических лабораторий АФА выявляют методом ИФА с помощью специальных тест-систем [17]. В 2014 г. опубликованы рекомендации по определению уровня АФА методом количественного ИФА (табл. 2). Они содержат информацию о типе анализируемой пробы, особенностях тестов, расчета референтного интервала и интерпретации результатов, но некоторые вопросы их практического использования остаются без ответа[18].
Таблица 2
Рекомендации Научного комитета по стандартизации Научного комитета по стандартизации (Международного общества тромбозов и гемостаза) (Scientific Standardization Committee of the International Society of Thrombosis and Haemostasis) по выявлению антифосфолипидных антител с помощью твердофазных тест-систем[18]
Очевидно, что особенности сбора, хранения и обработки образцов биоматериала для ИФА менее критичны, чем для коагуляционных тестов. Однако результаты определения антител к β2-гликопротеину I и кардиолипину, полученные с помощью разных тест-систем в разных лабораториях, варьируют, несмотря на попытки стандартизации процесса тестирования. Различия в результатах возникают из-за методологических проблем при выполнении анализов, особенностей калибровки и отсутствия консенсуса в интерпретации положительных и отрицательных результатов. В своем недавнем исследовании мы проанализировали степень совпадения результатов применения двух тест-систем зарубежного производства для измерения уровней антител к β2-гликопротеину I и кардиолипину методом ИФА. В исследовании участвовали пациенты с ранним (развившимся в возрасте до 50 лет) острым некардиоэмболическим инсультом, с рецидивирующими тромбозами глубоких вен нижних конечностей, а также с привычным невынашиванием беременности (n = 127). Результаты применения тест-систем для выявления антител к β2-гликопротеину I совпали в 70% случаев, антител (IgG и IgM) к кардиолипину — соответственно в 88% и 70%. При сопоставлении количественных результатов применения тест-систем разных производителей для выявления АФА методом ИФА каппа Коэна составила 0,045 для результатов выявления антител к β2-гликопротеину I, 0,061 и 0,068 — соответственно для антител (IgM и IgG) к кардиолипину. Таким образом, степень совпадения результатов применения тест-систем разных производителей, популярных в российских лабораториях, оказалась низкой[19]. Так как высокая вариабельность результатов и низкая специфичность теста обусловливают спорную клиническую значимость АФА, целесообразно оценить преимущества новых методов, лишенных этих недостатков.
В течение последних лет были разработаны новые методы выявления АФА — методы твердофазного ИФА. Они основаны на новом подходе к сорбции антигена, обеспечивающем большую плотность антигена на твердофазном носителе. Связывание молекул β2-гликопротеина I в твердой фазе имеет решающее значение, поскольку определяет конформационное изменение белка, необходимое для связывания аутоантител.
ХЕМИЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ
Автоматизированный хемилюминесцентный анализ считается альтернативой методу ИФА, но имеет ряд важных преимуществ[20]. Антитела, присутствующие в образце, связываются с твердой фазой, представленной магнитными частицами, которые покрыты антигеном. При добавлении реагентов, которые вызывают хемилюминесцентную реакцию, испускаемый свет измеряется оптической системой прибора. Этот сигнал прямо пропорционален концентрации АФА в образце. Результаты сравнения диагностических характеристик хемилюминесцентного анализа и планшетного ИФА при выявлении АФА позволили сделать ряд заключений[21, 22]. Во-первых, полностью автоматизированные и компьютеризированные анализаторы значительно сокращают время работы. Во-вторых, хотя хемилюминесцентный анализ и менее чувствителен по сравнению с ИФА, он более эффективен для диагностики АФС. Это можно объяснить особенностями твердой фазы для сорбции антигена, поскольку, в отличие от полистероловых ИФА-планшетов, магнитные частицы обеспечивают большую площадь поверхности и плотность сорбции антигена. Кроме того, широкий диапазон концентраций АФА, определяемых с помощью автоматических анализаторов, обусловлен особенностями хемилюминесцентной реакции анализа, которая позволяет добиться очень высокой точности при измерении высоких титров АФА. Таким образом, в диагностике АФС хемилюминесцентные анализаторы демонстрируют чувствительность, достигающую 100%, при специфичности 72,3%[22].
МУЛЬТИПЛЕКСНЫЙ ЛАЙН-ДОТ
Мультиплексный лайн-дот (МЛД), а также мультиплексные методы с применением магнитных частиц способны обеспечить одновременное выявление нескольких АФА[23]. Особенность МЛД — использование гидрофобной мембраны из поливинилидендифторида. В отличие от твердой фазы, обычно имеющей слабый отрицательный заряд, пористая структура мембраны обладает высоким сродством к гидрофобной части фосфолипидов, что приводит к более плотному их распределению на поверхности мембраны, которая взаимодействует с кофакторами и специфическими аутоантителами. Это позволяет приблизить реакцию in vitro к физиологическим условиям связывания аутоантител и антигена, которые происходят in vivo.
В нашем недавнем исследовании мы проанализировали диагностическую ценность МЛД в постановке серологического диагноза АФС. Мы собрали биоматериал пациентов с тромбозами и невынашиванием беременности (n = 127)[24] и использовали тест-системы для выявления антител к кардиолипину и β2-гликопротеину I методом ИФА, МЛД — для выявления антител к кардиолипину, β2-гликопротеину I, аннексину V, протромбину, фосфатидной кислоте, фосфатидилглицеролу, фосфатидилинозитолу, фосфатидилхолину, фосфатидилсерину, фосфатидилэтаноламину. При анализе частоты выявления средних и высоких титров антител к кардиолипину и β2-гликопротеину I метод МЛД оказался вдвое чувствительнее ИФА. В общей когорте пациентов чаще всего обнаруживались антитела к β2-гликопротеину I, фосфатидилсерину, кардиолипину, аннексину V, фосфатидной кислоте; у пациентов с тромбозом глубоких вен нижних конечностей — антитела к фосфатидной кислоте (40%), фосфатидилсерину (33%), аннексину V (22,1%), протромбину (7,4%); у пациентов с острым инсультом — антитела к фосфатидной кислоте (46,2%), фосфатидилсерину (37,2%), аннексину V (13,3%), фосфатидилинозитолу (8,9%), протромбину (8,9%), фосфатидилглицеролу (6,7%); у пациенток с акушерской патологией — антитела к аннексину V (26%), фосфатидилхолину (15,9%), фосфатидилглицеролу (13,6%), фосфатидной кислоте (13,5%), протромбину (9,4%), фосфатидилинозитолу (6,8%), фосфатидилэтаноламину (4,5%). У пациентов с тромбозом глубоких вен нижних конечностей и острым инсультом значительно чаще обнаруживались антитела (IgG и IgM) к фосфатидной кислоте и фосфатидилсерину (точный критерий Фишера, p = 0,0093, OD = 0,2355; p = 0,0044, OD = 0,2308).
Мы использовали МЛД для выявления АФА в группе пациенток с акушерской патологией и проанализировали спектр обнаруженных антител. Для этого мы разделили пациенток с первичным АФС на группы:
- с положительным результатом анализа на ВАК, антитела к кардиолипину и β2-гликопротеину I;
- с положительным результатом анализа на ВАК и антитела к β2-гликопротеину I и отрицательным результатом анализа на антитела к кардиолипину;
- с положительным результатом анализа на один из видов антител (ВАК, антитела к кардиолипину или β2-гликопротеину I).
Метод МЛД выявляет больше пациентов с положительным результатом анализа на все 3 вида антител, позволяя более эффективно оценить риск развития патологии беременности и выделить группу наибольшего риска осложнений.
Еще одно преимущество этого теста для выявления АФА — возможность обнаружения антител к домену 1 β2-гликопротеина I. После связывания β2-гликопротеина I с отрицательно заряженными иммобилизованными анионными фосфолипидами посредством домена 5 домен 1 образует «верхнюю» часть открытой формы β2-гликопротеина I, которая взаимодействует с АФА. Благодаря высокой плотности гидрофильных участков фосфолипидов на мембране МЛД домены 4 и 5 участвуют в связывании иммобилизованных фосфолипидов и более не доступны для взаимодействия с АФА[25, 26].
Наши данные указывают на то, что МЛД для выявления АФА можно рекомендовать как эффективную мультипараметрическую тест-систему для одновременного полуколичественного обнаружения спектра АФА в одном образце. Уникальные свойства МЛД позволяют рассматривать его как инструмент для оценки риска развития клинических проявлений АФС.
ЗАКЛЮЧЕНИЕ
Информативность тест-систем для обнаружения антител к кардиолипину и β2-гликопротеину I методом иммуноферментного анализа в диагностике антифосфолипидного синдрома остается спорной ввиду сложности их стандартизации. В настоящем обзоре мы оценили возможности новых методов выявления антифосфолипидных антител, преимущества которых заключаются в улучшении параметров сорбции антигенов, автоматизации, мультиплексном подходе. Новые методы могут способствовать повышению точности диагностики аутоиммунных заболеваний.








