На момент написания этой статьи COVID-19 поразил более 103 млн человек во всем мире с летальным исходом у более 2 млн человек, общая летальность составляет 2,16%. Россия находится на четвертом месте по заболеваемости COVID-191.
С начала распространения новой коронавирусной инфекции практически сразу были выделены заболевания, ассоциированные с высоким риском летальных осложнений. В эту группу включены хронические заболевания: АГ, ожирение, СД, сердечно-сосудистые болезни, заболевания почек и печени. У пациентов с указанными патологиями наиболее часто наблюдались тяжелое течение и летальный исход COVID-19[1].
Столкновение двух глобальных пандемий — COVID-19 и СД 2 типа (СД2) — привело к мрачным результатам: СД2 является второй по частоте сопутствующей патологией при COVID-19[2]. Сочетание СД, ожирения и АГ увеличивает риски летального исхода почти в 5 раз. Метаанализ исследований, описывающих характеристики пациентов в зависимости от степени тяжести COVID-19 в Китае, показал, что СД в 2–3 раза повышал вероятность неблагоприятных исходов болезни[3].
Эти связи между диабетом и худшим исходом при вирусных инфекциях не являются неожиданными, поскольку гипергликемия пагубно сказывается на контроле виремии и воспаления, усугубляя заболеваемость и смертность у таких пациентов.
Был проведен систематический обзор статей с метаанализами. Поиски проводились в Pubmed и Scopus (апрель 2020 г. — февраль 2021 г.), включены эпидемиологические и статистические данные по распространению новой коронавирусной инфекции.
Целью данного обзора стала систематизация сведений о распространенности СД среди пациентов, перенесших новую коронавирусную инфекцию, об особенностях активации вирусных механизмов и каскадах патологических реакций в организме. Это позволит понять особенности течения COVID-19 у больных СД и ответить на вопросы о возможностях управления гликемией на фоне COVID-19.
ОСОБЕННОСТИ ЭПИДЕМИОЛОГИИ, ТЕЧЕНИЯ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ У ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ
Коронавирусы (coronaviridae) — это большое семейство РНК-содержащих вирусов, способных инфицировать как животных (их естественных хозяев), так и человека. Официальное название инфекции, вызванной новым коронавирусом, —COVID-19 (Coronavirus disease 2019). Международный комитет по таксономии вирусов 11 февраля 2020 г. присвоил официальное название возбудителю инфекции — SARS-CoV-2.
Природным резервуаром SARS-CoV-2 являются летучие мыши. Основным источником инфекции становится больной человек, находящийся в инкубационном периоде заболевания. Инкубационный период составляет от 2 до 14 дней. Клинические особенности течения и распространения заболевания директивно сформировали 14-дневную концепцию соблюдения карантина.
Передача SARS-CoV-2 происходит в основном воздушно-капельным путем при тесном или прямом контакте с источником.
Выделение вируса от больного может начаться за 48 часов до появления клинических симптомов, и скорость выделения увеличивается в первые 1–3 дня от начала болезни. Длительность заболевания составляет менее 12 дней при легком течении и более 2 недель при тяжелом.
Наиболее уязвимой для SARS-CoV-2 стала старшая возрастная группа пациентов (старше 65 лет). Самый высокий риск госпитальной смерти имеют пациенты старше 80 лет[4].
В большинстве стран также показаны значительные гендерные различия в течении COVID-19. У мужчин наблюдаются более тяжелое течение заболевания и повышенная смертность во всех возрастных группах[5].
Наиболее частыми сопутствующими заболеваниями были АГ (56,6%), ожирение (41,7%) и СД (33,8%) [6].
Частота СД среди пациентов с COVID-19 варьирует в разных странах и составляет от 11% до 45%[7]. В крупных исследованиях выявлено, что диабет чаще встречался у пациентов с тяжелым течением заболевания (16,3%), чем с легким (6,9%)[7]. C. Huang и соавт.[6]сообщали, что в госпитализации в отделения интенсивной терапии нуждались 72% больных COVID-19 с сопутствующими заболеваниями, включая диабет, и только 37% без сопутствующих патологий.
Наличие СД увеличивает риск госпитальной смерти в 2,85 раза[6]. Для сравнения: риск госпитальной смерти больных онкогематологического профиля выше в 5,35 раза, а пациентов с ожирением — в 3,2 раза. В крупном эпидемиологическом исследовании Китайского центра по контролю за заболеваниями смертность от COVID-19 при диабете выросла до 7,3%, что значительно выше, чем при отсутствии каких-либо сопутствующих заболеваний (0,9%)[8].
После проникновения вируса в организм ему необходимо найти «ключ» для входа в клетки и начала размножения. Таким «ключом» стал рецептор ангиотензинпревращающего фермента 2 типа (АПФ2). АПФ2 — это интегральный трансмембранный белок, закрепленный на апикальной поверхности клетки, с каталитическим доменом, расположенным на внеклеточной стороне клетки, который может расщепляться и высвобождаться в кровоток с помощью ADAM17 (белок 17, содержащий дезинтегрин и металлопротеиназный домен)[9].
Белок-спайк, поверхностный гликопротеин вируса, играет наиболее важную роль в прикреплении, слиянии и проникновении вируса. Он состоит из короткого внутриклеточного хвоста, трансмембранного якоря и большого эктодомена, который включает субъединицу S1, связывающуюся с рецептором, и субъединицу S2, сливающуюся с мембраной. Субъединица S1 связывается с рецептором АПФ2 на клеточной поверхности для проникновения в клетку-хозяина. Вторая субъединица, S2, взаимодействует с сериновой протеазой (TMPRSS2) для расщепления шипа, а затем — с фурином для высвобождения пептида и слияния шипа. Все эти процессы облегчают проникновение вируса в клетки. РНК из вирусного генома высвобождается в цитоплазму, и происходит репликация вируса.
Доказано, что без рецепторов TMPRSS2 невозможно инфицирование и проявление вирионных свойств вируса[9].
Проникновение вируса в клетку вызывает воспалительную реакцию с привлечением Т-хелперов, продуцирующих провоспалительные цитокины, которые являются пусковыми факторами в развитии цитокинового «шторма» с быстрым прогрессированием полиорганной недостаточности[5].
АПФ2 экспрессируется не только в альвеолярных эпителиальных клетках легких и верхних дыхательных путей, но также в поджелудочной железе, сердце, эндотелии, эпителии канальцев почек и кишечника.
Клиническое течение коронавирусной инфекции очень вариативно и включает широкий спектр симптомов. Заболевание может протекать бессимптомно, в легкой, среднетяжелой и тяжелой форме, включая тяжелую вирусную пневмонию, острый респираторный дистресс-синдром (ОРДС) с дыхательной недостаточностью и смертельным исходом.
КЛИНИЧЕСКАЯ КАРТИНА ЗАБОЛЕВАНИЯ
Клинически заболевание переходит из одной стадии в другую, формируя характерный симптомокомплекс.
Первая стадия, или легкая фаза, обычно длится 7 дней с симптомами, характерными для инфекции верхних дыхательных путей. Могут также появиться неспецифические симптомы, такие как аносмия, агевзия и желудочно-кишечные проявления. В 80% случаев заболевание завершается выздоровлением.
Вторая стадия встречается примерно у 15% пациентов. Проявляется она ухудшением состояния с 7–10-го дня в виде появления одышки, кашля и снижения сатурации кислорода с признаками и симптомами, указывающими на прогрессирование инфекции нижних дыхательных путей. Лабораторная оценка показывает увеличение уровней воспалительных маркеров, таких как СРБ, ферритин и D-димер, что свидетельствует о воспалительной активности и протромботическом компоненте заболевания. Кроме того, КТ грудной клетки может продемонстрировать двусторонний периферический легочный инфильтрат в виде четко определенного паттерна «матового стекла», что указывает на развитие вирусной пневмонии.
Только у 5% пациентов заболевание прогрессирует до третьей стадии: тяжелой пневмонии с ухудшением респираторного состояния, гипоксемией и лихорадкой. С патофизиологической точки зрения эта фаза характеризуется гиперактивностью воспалительного иммунного ответа, способствующей цитокиновому «шторму», что приводит к гиперцитокинемии, в основном за счет ИЛ-6 и ИЛ-2 и ФНО-α.
Гиперцитокинемия вызывает повреждение эндотелия с последующей активацией каскада коагуляции, состояние гиперкоагуляции с тромбоэмболическими осложнениями. Лабораторно эта стадия характеризуется цитопенией и повышенным содержанием D-димера. Развивается яркая киническая картина ОРДС. На КТ грудной клетки наблюдаются двусторонние помутнения в виде «матового стекла» легких с возможными сопутствующими очагами консолидации.
Следующее серьезное осложнение — сепсис, прогрессирующий до синдрома полиорганной недостаточности. Системное воспаление, вызванное SARS-CoV-2, а также гиперцитокинемия и гиперкоагуляция приводят к повреждению миокарда с повышением уровней тропонина и N-концевого прогормона натрийуретического пептида головного мозга (NT-proBNP) и, как следствие, к сердечно-сосудистым осложнениям.
ОСОБЕННОСТИ ТЕЧЕНИЯ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ У ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ
У пациентов с СД выявлен ряд особенностей, обусловливающих усиленные вирулентные свойства коронавирусной инфекции и влияющих на клиническое течение заболевания.
- У пациентов с СД увеличено время выведения вируса.
- Экспрессия АПФ2 повышена у пациентов с СД в поджелудочной железе, что объясняет гипергликемическую реакцию на фоне COVID-19[9].
- При СД отмечено повышение уровня фурина, который представляет собой мембраносвязанную протеазу 1 типа и участвует в проникновении и репликации вируса в клетках[9].
- Хроническое метаболическое воспаление жировой ткани при СД опосредует повышенное содержание ИЛ-6 и СРБ. Это ускоряет цитокиновое воспаление на фоне вирусной инвазии. Клинически в наблюдательных исследованиях отмечено, что у пациентов с СД фаза цитокинового «шторма» начиналась через 24–48 часов от начала заболевания. Применение ингибиторов гиперактивного иммунного воспаления[9] рассматривается у пациентов с СД в качестве приоритетного лечения.
- Больные СД имеют более высокие исходные концентрации ферритина сыворотки и D-димера, а также индекс свертывания, что обусловливает высокий риск гиперкоагуляционного синдрома
- СД ассоциирован с высоким риском присоединения бактериальной инфекции. Быстрые виражи уровня СРБ при появлении пневмонических очагов говорят о необходимости упреждения инфекционно-бактериального процесса.
В большинстве случаев у больных СД зафиксировано легкое течение COVID-19 (до 85%). В наблюдательных исследованиях[10] показано, что среднее время от появления первого симптома до госпитализации составляет примерно 10 дней (6–19). Сообщается о значительно более высокой частоте утомляемости и одышки у пациентов с СД, чем у лиц без него: 38,0% против 31,4% и 20,5% против 15,4% соответственно. Двустороннее поражение легких также регистрировалось чаще у больных СД.
По результатам лабораторных исследований, у пациентов с СД2 значительно чаще наблюдались лимфопения (44,5% против 32,6%) и высокое соотношение лейкоцитов (11,3% против 6,6%) в периферической крови, чем при отсутствии СД. Повышение уровней СРБ (57,0% против 42%), прокальцитонина (33,3% против 20,3%), D-димера (50,5% против 33,3%) также чаще обнаруживалось в группе СД2, чем в группе без диабета[10].
Как подтверждение гиперреактивности иммунной системы у пациентов с СД2 чаще встречались ОРДС (16,9% против 7,2%), острое повреждение сердца (7,3% против 3,0%), септический шок (3,8% против 1,0%)[10].
Наличие СД в анамнезе определяет не только клиническую картину, но и более интенсивное комплексное лечение. У пациентов с СД отмечена более высокая потребность в антибиотиках (61,3% против 56,9%), системных кортикостероидах (29,4% против 22,8%), гипотензивных препаратах (45,1% против 21,1%), а также им чаще требовались вазопрессорная поддержка (7,7% против 2,2%), ингаляция кислорода (76,9% против 61,2%), неинвазивная (10,2% против 3,9%) и инвазивная вентиляция (3,6% против 0,7%) легких[10].
В клинических исследованиях показано, что на тяжесть течения COVID-19 влияет не сам факт наличия СД, а степень его компенсации.
Гипергликемия стала сильным диагностическим и прогностическим фактором неблагоприятных исходов COVID-19. Вираж уровня гликемии порой является единственным первым симптомом вирусной инвазии. Гипергликемия на старте заболевания — неблагоприятный диагностический признак, она опосредует в дальнейшем среднетяжелое и тяжелое течение. Каждые 2 ммоль/л высокой гликемии при поступлении в стационар на 15% увеличивают риск тяжелого течения и продолжительность госпитализации примерно на сутки[11].
После анализа влияния гипергликемии на прогноз течения COVID-19 выявлено, что некомпенсированный СД (пациенты с исходным уровнем гликированного гемоглобина более 7,5%)[11] был ассоциирован с более тяжелым течением COVID-19 и высоким риском летального исхода (1,95 против 1,31 соответственно)[5].
В процессе лечения коронавирусной инфекции важно поддерживать целевые показатели гликемии. У больных с хорошо контролируемым гликемическим состоянием (гликемическая вариабельность в пределах 3,9–10 ммоль/л) заболевание было менее тяжелым и смертность среди них ниже, чем у лиц с гипергликемией более 10 ммоль/л.
Острая гипергликемия может привести к аномальному воспалительному и иммунному ответу, способствующему развитию и прогрессированию ОРДС у пациентов с COVID-19[12].
Прогрессирование коронавирусной инфекции вызывает повышенную секрецию контринсулярных гормонов, глюкокортикоидов и катехоламинов, что приводит к повышению уровня глюкозы в крови, его аномальной вариабельности и развитию диабетических осложнений. У пациентов с СД часто регистрируются диабетический кетоацидоз или гиперосмолярное гипергликемическое состояние[13].
Поэтому оптимальное управление гликемией имеет решающее значение для улучшения исхода COVID-19. Однако критическое состояние пациентов ограничивает применение ряда сахароснижающих препаратов (табл. 1).
Таблица 1
Сахароснижающие препараты, при приеме которых на фоне лечения COVID-19 требуются контроль и наблюдение при сахарном диабете 2 типа
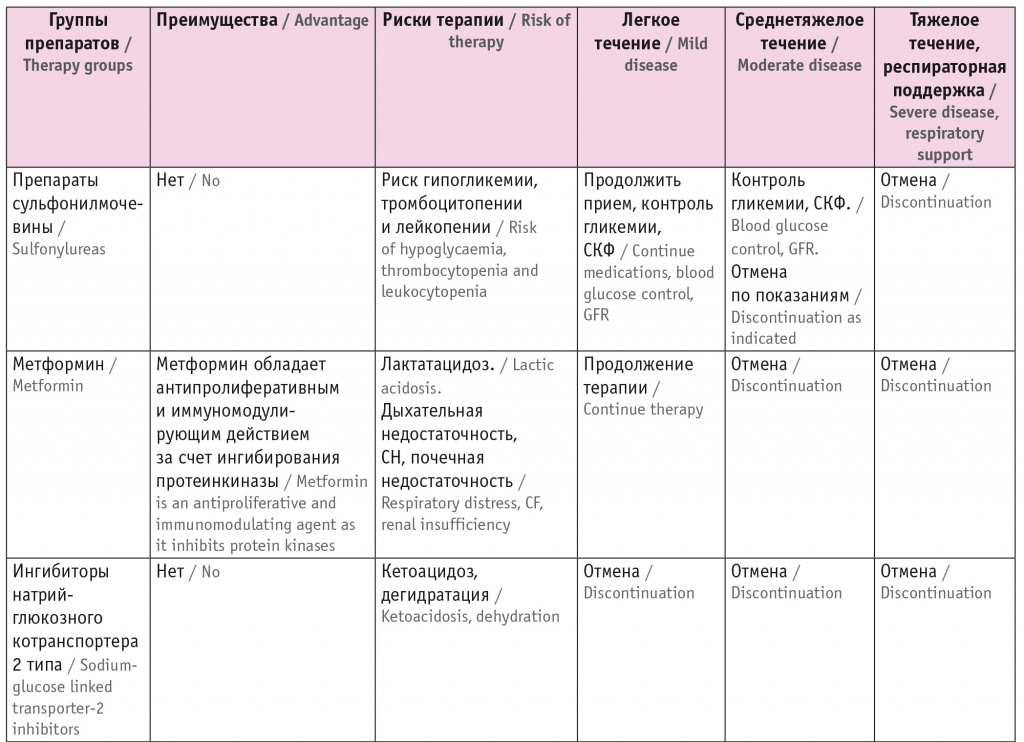
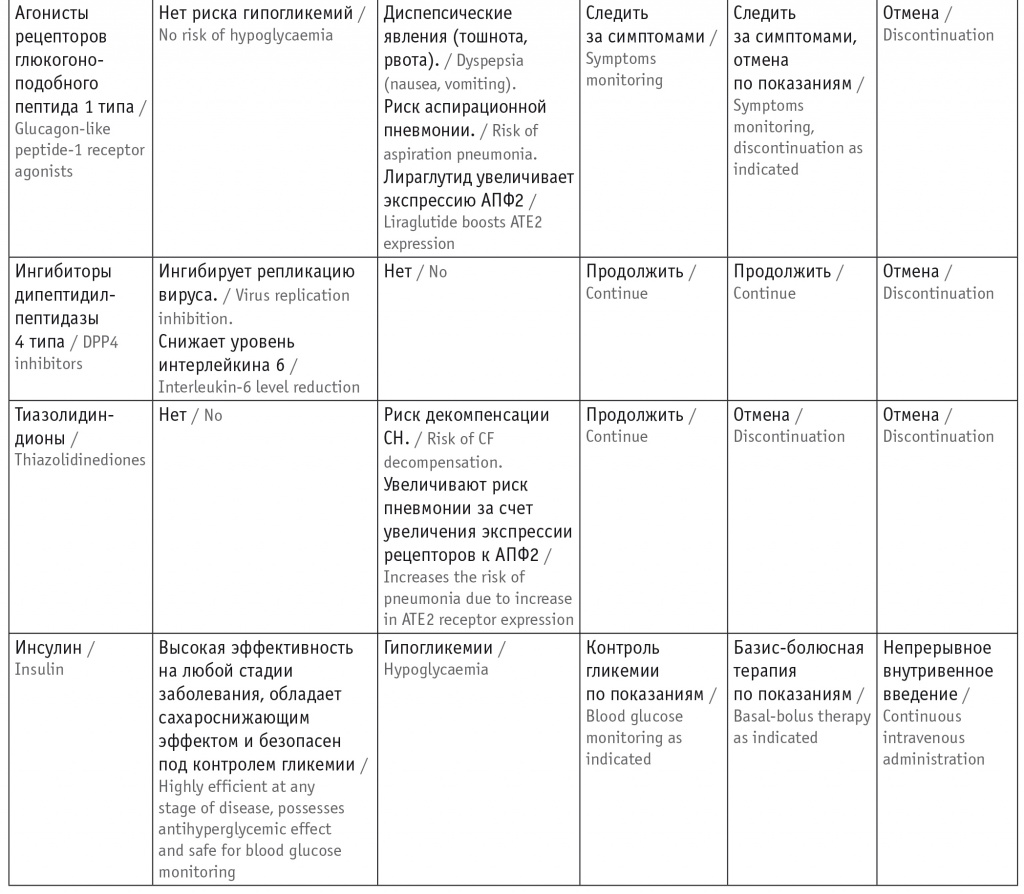
Примечание: АПФ2 — ангиотензинпревращающий фермент 2 типа, СКФ — скорость клубочковой фильтрации, СН — сердечная недостаточность.
САХАРОСНИЖАЮЩАЯ ТЕРАПИЯ У ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ И COVID-19
На старте изучения заболевания в связи с поражением альвеолярных клеток, развитием дыхательной недостаточности и быстрого прогрессирования пневмонии было рекомендовано ограничение приема метформина. По мере получения новой информации у метформина выявлены иммуномодулирующие свойства, а также возможность предотвращать проникновение вируса в клетки-мишени[14]. Поэтому продолжение его приема на начальных стадиях заболевания является предпочтительным. Абсолютным противопоказанием для назначения метформина остается крайне тяжелое состояние пациентов с сопутствующим сепсисом или тяжелыми нарушениями функции печени и почек.
В группу небезопасных препаратов попали ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ2) в связи с риском развития эугликемического кетоацидоза и дегидратации. Наиболее опасен прием иНГЛТ2 для пациентов, у которых назначение данной терапии изначально было необоснованно. В связи с риском дегидратации на фоне гипертермии прием иНГЛТ2 необходимо отменить уже на старте заболевания.
Препараты из группы агонистов рецепторов глюкогоноподобного пептида 1 типа (арГПП-1) ограничены в применении в связи с развитием диспепсических явлений: тошноты, рвоты. Для уменьшения риска дегидратации пациентам рекомендовано их отменить[14].
Наиболее нейтральными оказались ингибиторы дипептидилпептидазы 4 типа (иДПП4) и препараты сульфонилмочевины. Они стали альтернативными средствами контроля гликемии при необходимости отмены иНГЛТ2 или метформина.
Безопасной и эффективной остается инсулинотерапия. Однако следует учитывать риски гипогликемии и проводить тщательный контроль гликемии.
МЕДИКАМЕНТОЗНЫЙ ПОДХОД И ВЕДЕНИЕ ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ
Ряд вышеперечисленных особенностей фактически формирует этапы диагностических мероприятий, медикаментозные подходы и варианты терапии для пациентов с СД, а также диктует правила контроля и коррекции гликемии на фоне течения COVID-19 (табл. 2).
Таблица 2
Целевые показатели гликемического контроля
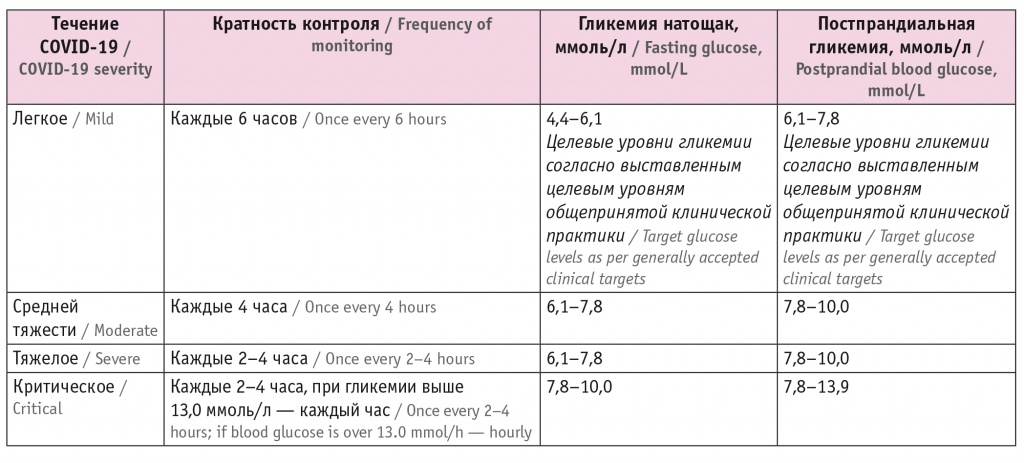
Терапевтические алгоритмы ведения пациентов с СД и COVID-19 включают в себя противовирусную терапию, коррекцию гиперкоагуляции, контроль гипериммунной реакции и назначение упреждающей антибактериальной терапии по показаниям.
При легком течении коронавирусной инфекции пациент с СД изолируется и продолжает лечение амбулаторно. Большинство больных с легким течением инфекции и целевыми показателями углеводного обмена могут продолжать прием своей стандартной схемы антигипергликемических препаратов[9].
Особенности лечения в амбулаторных условиях
- Целевая гликемия соответствует утвержденным индивидуальным показателям, согласно правилам общепринятой клинической практики.
- Следует рекомендовать контролировать гликемию каждые 4–6 часов.
- Больному нужно увеличить объем потребляемой жидкости до 2–3 литров в сутки с учетом сопутствующих заболеваний, не менее 100 мл жидкости каждый час.
- Пациенту необходимо рационализированное и сбалансированое питание, достаточное потребление калорий, дробное употребление углеводов. Не голодать.
- К терапии следует добавить энтеросорбенты (при невыраженной интоксикации, диспепсических явлениях).
- Необходимо продолжить ранее назначенное лечение СД с учетом профиля безопасности принимаемых препаратов.
- Их всех сахароснижающих препаратов рекомендовано отменить иНГЛТ2 из-за риска обезвоживания и эугликемического кетоацидоза.
- Нужно продолжить лечение метформином. Дозы других сахароснижающих средств, таких как препараты сульфонилмочевины и инсулин, могут быть изменены в зависимости от уровня глюкозы в крови.
- Необходимо информировать пациента, что нельзя корректировать и/или отменять самостоятельно компоненты сахароснижающей терапии.
- При гликемии выше 13–15 ммоль/л показаны коррекция сахароснижающей терапии, контроль содержания кетонов в моче.
Пациенты со среднетяжелым течением COVID-19 имеют риск декомпенсации СД. Госпитализация показана всем больным СД со среднетяжелым и тяжелым течением COVID-19. Каждому пациенту, доставленному в приемное отделение стационара, следует провести КТ органов грудной клетки для диагностики пневмонии вирусного генеза.
Особенности лечения при среднетяжелом течении COVID-19[15]
- ВАЖНО! Вираж уровня гликемии и выраженная инсулинорезистентность являются предикторами развития тяжелого течения коронавирусной инфекции. Это определяет необходимость раннего перевода на инсулинотерапию.
- Целевой уровень гликемии определяется тяжестью состояния пациента и течением заболевания. При среднетяжелом течении COVID-19 целевой уровень гликемии — 6,1–10,0 ммоль/л.
- Контроль гликемии проводится каждые 2–4 часа, контроль содержания кетонов в моче — 1–2 раза в день.
- С первого дня пребывания в стационаре — ежедневный контроль кислотно-щелочного состояния, уровней лактата, СРБ, ИЛ-6, D-димера, ферритина.
- Регидратационная инфузионная терапия.
- Отменить иНГЛТ-2, арГПП-1, метформин.
- Возможно продолжить прием препаратов сульфонилмочевины, иДПП4 с учетом профиля безопасности.
- При гликемии выше 15,0 ммоль/л нужно добавить инсулин-изофан (человеческий генно-инженерный) или аналог инсулина длительного действия.
- При стойком повышении гликемии выше 15,0 ммоль/л более 24 часов показан перевод на базис-болюсную инсулинотерапию.
- При назначении специфической терапии COVID-19 (противовирусной, иммуномодулирующей), а также антибактериальной при присоединении вторичной инфекции необходимо учитывать их побочные эффекты и влияние на течение СД, а также на особенности гликемического контроля.
Тяжелое течение COVID-19 характеризуется прогрессированием дыхательной, а в дальнейшем и полиорганной недостаточности. В этом случае проводится лечение в условиях отделения реанимации и интенсивной терапии с респираторной, нутритивной и, по показаниям, вазопрессорной поддержкой. Ведение таких пациентов с СД имеет ряд особенностей[16].
- При тяжелом течении COVID-19 целевой уровень гликемии может быть 7,8–11,9 ммоль/л.
- Контроль гликемии проводится ежечасно при показателях выше 13,0 ммоль/л или каждые 3 часа при значениях ниже 13,0 ммоль/л.
- Контроль содержания кетонов в моче — 2 раза в день.
- Контроль концентраций электролитов крови и лактата, газообмена, рН — 2 раз в день.
- Отменяются все ранее принимаемые сахароснижающие препараты.
- Все пациенты переводятся на подкожное или в/в введение инсулина[16].
- Проводится инфузионная дезинтоксикационная терапия.
- При назначении специфического лечения COVID-19 (антибактериального, терапии моноклональными антителами и глюкокортикоидами), а также при высоком риске сепсиса необходимо учитывать влияние лечения и тяжелых осложнений на течение СД и на особенности гликемического контроля.
Кроме контроля гликемического статуса, у больного проводится основная терапия, направленная на элиминацию вируса и на борьбу с осложнениями коронавирусной инфекции.
Всем пациентам с СД требуется медикаментозное лечение, согласно стадиям заболевания:
- симптоматическая терапия;
- противовирусная терапия;
- терапия для коррекции гипериммунного статуса;
- антикоагулянтная терапия (табл. 3)[16];
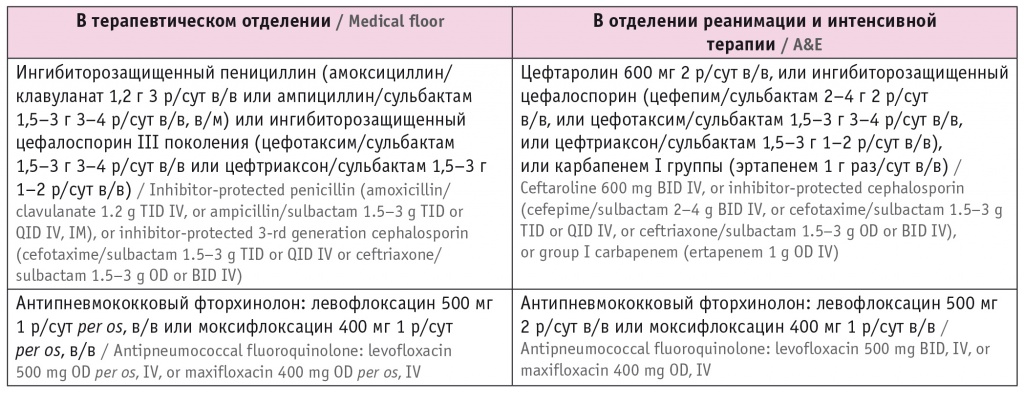
- превентивная антибактериальная терапия (по показаниям)[17] (табл. 4).
Таблица 3
Антикоагулянты для лечения COVID-19
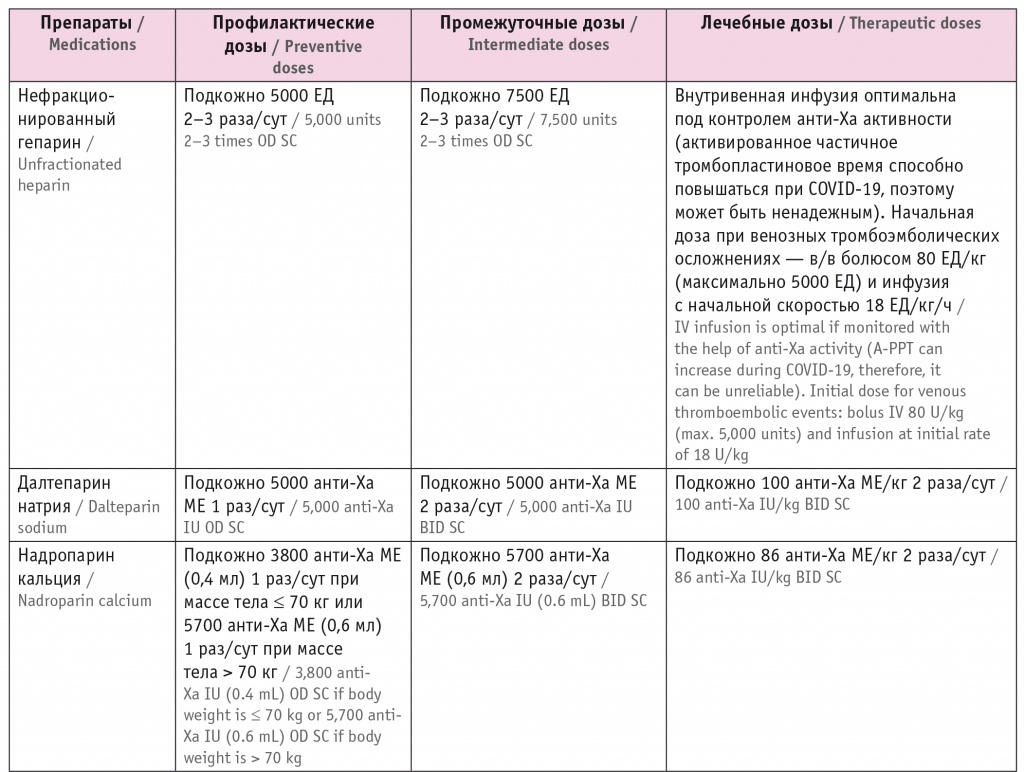
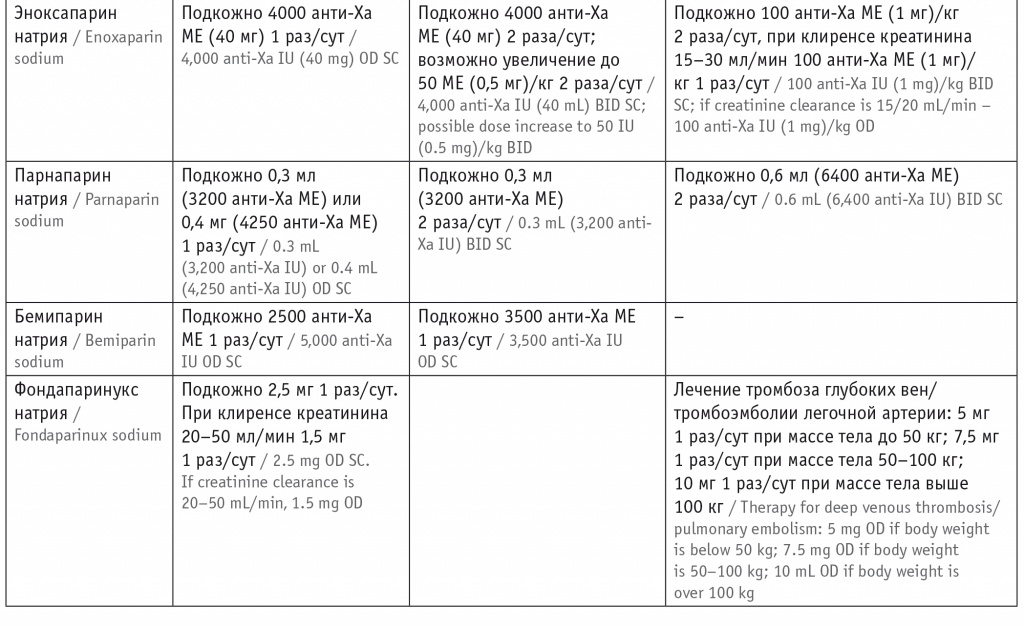
Таблица 4
Схемы антибактериальной терапии, применяемые у пациентов с сахарным диабетом
На стадии вирусной инвазии и инкубационного периода показано назначение противовирусной и симптоматической жаропонижающей терапии с адекватной гидратацией организма.
В настоящее время следует выделить несколько препаратов, которые могут быть использованы при лечении COVID-19. К ним относятся фавипиравир, ремдесивир, умифеновир[16]. Согласно современным представлениям о патогенезе COVID-19, применение препаратов, рекомендуемых для этиотропной терапии, целесообразно начинать не позднее 7–8-го дня от начала болезни (появления первых симптомов). Проведение противовирусной терапии допустимо как в амбулаторных условиях, так и в стационаре.
Среди препаратов, применяющихся для лечения COVID-19, следует отметить противомалярийное средство гидроксихлорохин. Он был эффективен у пациентов с легкой и среднетяжелой формой COVID-19 при назначении в течение первых 3–5 дней заболевания. Использование гидроксихлорохина у пациентов с тяжелым течением заболевания неэффективно[15].
С момента подтверждения вирусной инвазии всем пациентам с СД показано назначение антикоагулянтов в терапевтических дозах в силу высокого протромбогенного риска у таких больных. Амбулаторно назначаются пероральные антикоагулянты из-за простоты приема таблетированных форм (ривароксабан или дабигатрана этексилат).
При амбулаторном назначении антикоагулянтов следует уделять особое внимание наличию противопоказаний (прежде всего, выраженной почечной недостаточности) и оценке риска кровотечений. Длительность применения антикоагулянтов при амбулаторном лечении COVID-19 неясна, и, по-видимому, оно может продолжаться до 30 суток в зависимости от динамики клинического состояния пациента[16]. Контроль тромбогенности и риска тромботических осложнений проводится по уровням D-димера и фибриногена, по протромбиновому времени и количеству тромбоцитов.
Больные со среднетяжелым и тяжелым течением заболевания подлежат обязательной госпитализации. Следует помнить, что у пациентов с СД при прогрессировании заболевания быстрее начинается цитокиновый «шторм». С первого дня госпитализации у пациентов с СД ежедневно должны проводиться контроль активности воспалительного процесса (общего клинического анализа крови, уровней СРБ, D-димера, ферритина, ИЛ-6) и динамическая оценка рентгенологического статуса.
У больных СД продолжают этиотропное и антикоагулянтное лечение с переводом на парентеральные схемы введения.
При подозрении на гиперцитокинемию и поражение паренхимы легких более 50% показано назначение препаратов-корректоров гипериммунного статуса: ингибиторов рецепторов ИЛ-6 тоцилизумаба (сарилумаба) или ингибиторов ИЛ-1β (канакинумаба).
Показателями агрессивности провоспалительных цитокинов являются[16]:
- SpO2 ≤ 93%, одышка в покое;
- температура тела > 38°C в течение 5 дней или возобновление лихорадки на 5–10-й день болезни после «светлого промежутка»;
- уровень СРБ ≥ 9N или рост уровня СРБ в 3 раза на 8–14-й день заболевания;
- число лейкоцитов < 3,0 × 109/л;
- абсолютное число лимфоцитов < 1,0 × 109/л;
- уровень ферритина в крови ≥ 250 нг/мл;
- уровень ИЛ-6 > 40 пк/мл.
При применении тоцилизумаба у пациентов с СД развивается инсулинорезистентность, требующая увеличения доз инсулина в 2–3 раза от исходных. Необходимо помнить, что при назначении вышеперечисленных генно-инженерных биологических препаратов повышается риск вторичной бактериальной инфекции. Сочетанное назначение данной терапии с антибактериальными препаратами для пациентов с СД является патогенетически оправданным в связи с двойным риском присоединения бактериального компонента.
Однако наибольшую эффективность показали глюкокортикостероиды (ГКС). Они угнетают все фазы воспаления, синтез широкого спектра провоспалительных медиаторов, увеличение концентраций которых в рамках цитокинового «шторма» ассоциируется с неблагоприятным прогнозом при COVID-19 и риском развития ОРДС. Для проявления полного эффекта ГКС необходимо несколько часов[16].
Не рекомендуется использовать ГКС для лечения легкой и умеренной форм COVID-19, в том числе в амбулаторных условиях. Наибольшую и доказанную эффективность препараты показали при лечении пациентов в отделениях интенсивной терапии на фоне респираторной поддержки. Внутривенное введение дексаметазона больным при респираторной поддержке значимо снижало риск смертельного исхода. Их применение показано также в сочетании с ингибиторами рецептора ИЛ-6 и ИЛ-1β.
Максимальная доза ГКС применяется в течение 3–4 суток, а затем снижается при стабилизации состояния (купировании лихорадки, уменьшении концентраций СРБ, ферритина, АЛТ, АСТ, лактатдегидрогеназы в крови). Снижение дозы ГКС начинается при условии уменьшения уровня ферритина сыворотки крови не менее чем на 15%[15].
Применение ГКС у пациентов с СД влечет за собой гипергликемические реакции, в связи с чем повышение доз инсулина является ожидаемым и обязательным компонентом терапевтического вмешательства.
В период реконвалесценции после двукратного подтверждения отсутствия элиминации вируса для пациентов с СД необходимо предусмотреть наблюдение специалистами узкого профиля. Больные должны быть обеспечены сахароснижающими препаратами и инсулином на весь период амбулаторного долечивания и соблюдения режима изоляции.
После выписки из стационара пациенты получают ряд рекомендаций для выполнения на амбулаторном этапе наблюдения.
Сахароснижающая терапия
- Большинство пациентов выписываются из стационара с назначением базис-болюсной инсулинотерапии. Инсулинорезистентность и необходимость высоких доз инсулина могут сохраняться до 14–45 дней после выписки.
- Через 7–14 дней после выписки показано возобновление приема метформина для снижения инсулинорезистентности и потребности в инсулине.
- Применение и возобновление приема иНГЛТ2 может быть отсрочено до 30 дней в связи с высоким риском кетоацидоза.
- ациенты должны наблюдаться эндокринологом в динамическом режиме для своевременной коррекции терапии: перевода на комбинированные схемы лечения (пероральные сахароснижающие препараты + базальный инсулин) или возобновления пероральной сахароснижающей терапии с полной отменой инсулина.
Антибактериальная терапия прекращается согласно применяемой схеме. Чаще всего из-за длительности лечения в стационарных условиях прием антибиотиков длится только во время пребывания в стационаре.
Антикоагулянтная терапия
- После выписки пациентов из стационара антикоагулянтная терапия в качестве продленной профилактики может быть рассмотрена при сохраняющемся повышенном риске венозных тромбоэмболических осложнений и низком риске кровотечений в случаях, когда не требуются лечебные дозы антикоагулянта по другим показаниям. Продленная профилактика осуществляется в течение 14 дней после выписки из стационара. Имеется доказательная база для профилактических доз эноксапарина и ривароксабана как антикоагулянтов для продленной профилактики.
- Пациенты пожилого возраста, больные, лечившиеся в блоке интенсивной терапии, с активным злокачественным новообразованием, тромбоэмболией легочной артерии в анамнезе, сохраняющимся выраженным ограничением подвижности, концентрацией D-димера в крови > 2 раз выше верхней границы нормы остаются кандидатами для более продолжительной профилактики — до 30–45 дней после выписки.
ЗАКЛЮЧЕНИЕ
СД является одним из факторов риска тяжелого течения и смерти при COVID-19, поэтому пациенты с СД требуют особого внимания и своевременной адекватной помощи как на амбулаторном этапе, так и в стационаре. Не менее важна организация долгосрочного наблюдения за больными СД после перенесенного COVID-19 для снижения риска связанных с диабетом осложнений.
Поступила: 18.02.2021
Принята к публикации: 29.03.2021
______________
1 WHO Coronavirus (COVID-19) Dashboard. URL: https://covid19.who.int/ (дата обращения — 15.02.2021).








