К понятию посменной работы относят работу в ночные смены, вечерние смены и с ротацией смен [13]. Доказательства того, что посменная работа является не только причиной инсомнии, но и фактором риска развития метаболического синдрома (МС), получены D. De Bacquer и соавт. в ходе шестилетнего проспективного наблюдения за рабочими со сменным графиком трудовой деятельности [7]. Патофизиологические факторы, которые при посменной работе вызывают постоянную инсомнию и МС, активно изучаются [3, 12]. Связующим звеном между посменной работой, инсомнией и МС является мелатонин. Существует гипотеза о разрушении циркадианных ритмов при сменном графике под влиянием освещения, моделирующего дневное. Фотоны искусственного света воздействуют на эпифиз и подавляют выработку мелатонина. Мелатонин является главным внутренним синхронизатором циркадианных ритмов и принимает активное участие в регуляции сна, сосудистого тонуса и процессов метаболизма. Учитывая данный факт, можно предположить, что нарушение секреции мелатонина — раннее и ключевое событие: вначале развивается расстройство синтеза мелатонина, далее нарушаются циркадианные ритмы, а потом манифестируют клинические проявления в виде нарушений сна и создаются предпосылки к развитию МС [2, 10].
Таким образом, существуют физиологически обусловленные доводы в пользу применения мелатонина для коррекции инсомнии при посменной работе. Вопрос заключается в том, реализуется ли влияние экзогенного мелатонина на циркадианные ритмы и метаболизм при использовании его как гипнотика [8]. В связи с этим целью работы было изучение эффективности и плейотропных свойств препарата мелатонина (Циркадин), используемого для коррекции инсомнии при посменной работе у мужчин с МС.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе Городского эндокринологического центра г. Ростова-на-Дону сотрудниками кафедры внутренних болезней № 3 Ростовского государственного медицинского университета Минздрава России.
На первом этапе проводили сравнительный анализ суточной секреции мелатонина у мужчин со сменным (группа «А») и дневным (группа «С») графиками работы.
Оценка эффективности применения препарата экзогенного мелатонина замедленного высвобождения — Циркадина в коррекции инсомнии у мужчин с посменной работой и МС была проведена на втором этапе исследования. Через 3 недели испытуемые группы «А» методом случайного отбора (метод конвертов) были разделены на две равные подгруппы: «А1» и «А2». К терапии у пациентов подгруппы «А1» добавили экзогенный мелатонин замедленного высвобождения (Циркадин) в дозе 2 мг/сут, испытуемым подгруппы «А2» план лечения не изменили. Режим приема мелатонина (Циркадина): 2 мг (1 таблетка) не на пустой желудок за 20 минут до сна, примерно в одно и то же время (около 23.00). Перед работой в ночную смену препарат не применяли, т. е. существовал перерыв в его приеме в течение суток. Через 12 недель после назначения мелатонина (Циркадина) была проведена сравнительная оценка состояния участников двух подгрупп [11].
При этом всем участникам группы «А» на I этапе назначали антигипертензивную терапию с применением иАПФ (эналаприл) и блокаторов кальциевых каналов (амлодипин), гиполипидемическую терапию (аторвастатин). Кроме того, всем испытуемым были рекомендованы сон с 23.00 (при работе в дневную смену) и снижение калорийности пищи. Пациенты вели дневник, в котором отмечали уровень артериального давления (АД), калорийность питания, режим освещенности, время отхода ко сну.
Все мужчины давали письменное информированное согласие на участие в исследовании. Протокол исследования одобрен локальным независимым этическим комитетом Ростовского государственного медицинского университета Минздрава России согласно Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и Правилам клинической практики в Российской Федерации, утвержденным приказом Минздрава России от 19.06.2003 № 266.
Особенности суточной секреции мелатонина в группе «А» изучали у 26 мужчин в возрасте 40–59 лет, работавших в ночные смены более 6 лет и страдавших нарушениями сна и МС. Выбор когорты испытуемых осуществляли в ходе профилактических осмотров на промышленных предприятиях г. Ростова-на-Дону и был обусловлен высоким риском развития сердечно-сосудистых осложнений в указанной возрастной категории, резким нарушением секреции мелатонина при старении (после 60 лет) и слабой изученностью влияния эстрогенов на секрецию мелатонина [12].
Группа «С» (n = 23) послужила контрольной и была составлена из лиц, признанных при диспансеризации практически здоровыми и работавших только по дневному графику.
Критерии включения в группу «А»:
-
стаж работы при сменном режиме труда свыше 6 лет;
-
окружность талии ≥ 94 см;
-
АД ≥ 130/85 мм рт. ст.;
-
холестерин липопротеидов высокой плотности (ХС ЛПВП) в плазме крови ≤ 1,03 ммоль/л;
-
триглицериды в плазме крови ≥ 1,7 ммоль/л;
-
глюкоза в плазме крови натощак ≥ 5,6 ммоль/л, через 2 часа после нагрузки при проведении перорального глюкозотолерантного теста более 7,8 ммоль/л.
Критерии включения в группу «С»:
-
работа только по дневному графику;
-
окружность талии менее 94 см;
-
АД менее 130/85 мм рт. ст.;
-
ХС ЛПВП в плазме крови более 1,03 ммоль/л;
-
триглицериды в плазме крови менее 1,7 ммоль/л;
-
глюкоза в плазме крови натощак менее 5,6 ммоль/л, через 2 часа после нагрузки при проведении перорального глюкозотолерантного теста ≤ 7,8 ммоль/л.
Критерии исключения для обеих групп:
-
применение глюкокортикоидов, диуретиков, β-блокаторов более одного месяца перед исследованием;
-
инсульт, инфаркт миокарда, онкологические заболевания в анамнезе;
-
хроническая болезнь почек с нарушением азотовыделительной функции;
-
хроническая сердечная недостаточность I–IV функционального класса;
-
клинически значимые гиперкортицизм, гипотиреоз;
-
симптоматические артериальные гипертензии (АГ).
Клинические характеристики групп и подгрупп представлены в таблицах 1 и 2.
Таблица 1
Клинические характеристики групп сравнения
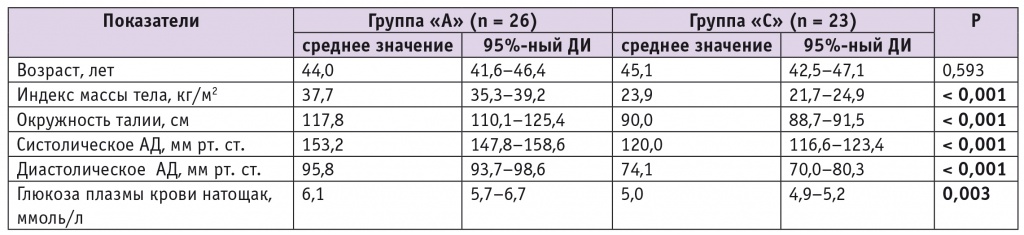
Примечание. В таблице 1 и далее: АД — артериальное давление; ДИ — доверительный интервал.
Таблица 2
Клиническая характеристика подгрупп сравнения, исходные данные
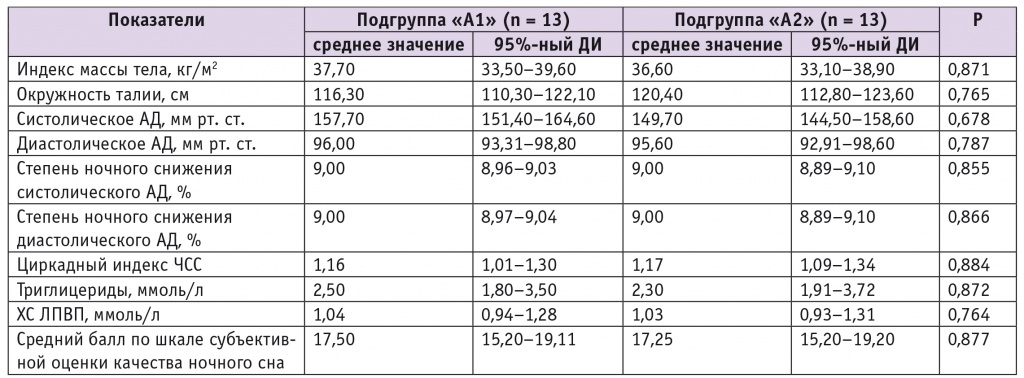
Примечание. ХС ЛПВП — холестерин липопротеидов высокой плотности; в таблице 2 и далее: ЧСС — частота сердечных сокращений.
Все испытуемые были опрошены по специально разработанной анкете для сбора анамнеза и оценки нарушений режима освещенности и по анкете субъективной оценки качества ночного сна [4].
Все участники групп «А» и «С» прошли комплексное обследование, включавшее рутинные клинические и биохимические тесты, а также исследование уровня 6-сульфатоксимелатонина (6-СОМТ) в моче и суточное мониторирование АД и ЭКГ по Холтеру в течение 24 часов.
Методика исследования 6-СОМТ. Мелатонин, циркулирующий в крови, метаболизируется в печени. Вначале он подвергается 6-гидроксилированию, затем конъюгации с сульфатом, далее экскретируется с мочой. У человека основным метаболитом мелатонина является 6-СОМТ. Концентрация этого метаболита в плазме крови и моче отражает качественные и количественные аспекты секреции мелатонина [6].
О дневном уровне секреции мелатонина судили по концентрации 6-СОМТ в моче, собранной с 7.00 до 19.00, о ночном уровне — по концентрации 6-СОМТ в моче, собранной с 19.00 до 7.00. Суточную секрецию определяли по сумме ночной и дневной концентрации 6-СОМТ в моче. Пиковая секреция мелатонина в 3.00 соответствовала концентрации 6-СОМТ в моче, которую пациент собирал в 4.00 [6].
Всех исследуемых просили соблюдать привычный ритм труда и отдыха, а также привычный световой режим в течение времени наблюдения. Испытуемые группы «А» проводили сбор мочи в те сутки, когда они не работали в ночную смену. В течение суток пациенты, введенные в исследование, собирали мочу в раздельные емкости: с 7.00 до 19.00 и с 19.00 до 7.00 следующего дня. Сбор мочи в 4.00 осуществлялся в ночь, следовавшую за сбором суточной мочи. Ночью пациенту рекомендовали не включать электрический свет и собирать анализы при сумеречном свете с целью исключить подавление продукции мелатонина ярким светом. Исследование проводили с ноября по декабрь — в месяцы, когда длительность светового дня минимальна для данной географической широты.
Для прямого количественного определения уровня мелатонина использовали набор 6-Sulfatoxymelatonin ELISA Kit (BÜHLMANN, Швейцария).
Суточное мониторирование АД и ЭКГ проводили с использованием аппарата «Cardiospy — холтеровская система ЭКГ», версия программного обеспечения — V4.04.RC13b (Labtech Ltd, Венгрия). Продолжительность мониторирования составляла 24 часа, интервалы при измерении АД и записи ЭКГ — 30 минут. Пациентам рекомендовали находиться в привычной для них обстановке, соблюдать обычный световой режим и время отхода ко сну. Мониторирование осуществляли в течение суток, свободных от ночных смен.
Программное обеспечение статистической обработки результатов исследования составляли системы статистического анализа данных Statistica versions 7.0, 8.0 (StatSoft, США), Microsoft Excel 2007 и MedCalc version 7.4.2.0.
Статистическую обработку результатов выполняли с расчетом числа наблюдений (n), необходимого для получения достоверных средних и относительных величин:
n = t2 × σ2/Δ2,
где t — критерий достоверности;
σ — среднее квадратичное отклонение;
Δ — доверительный интервал (предельная ошибка).
Выборочную совокупность проверяли на нормальность распределения согласно критерию Колмогорова — Смирнова. Для выборок с нормальным распределением использовали параметрический t-критерий Стьюдента для двух независимых выборок. В других случаях сравнение относительных величин с оценкой статистической значимости различий выполняли, используя критерий Пирсона (χ2) с поправкой Йейтса на непрерывность. Статистические методы были выбраны с учетом возможности их применения для малых (n < 30) выборок [1]. Различия считали статистически значимыми при р < 0,05. Для оценки эффективности лечения и в связи с уменьшением групп был применен критерий Уилкоксона. Для количественных признаков в сравниваемых группах оценивали средние арифметические и среднеквадратичные (стандартные) ошибки среднего с расчетом доверительного интервала (ДИ). Данные представлены в тексте как среднее значение и ДИ.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В ходе исследования установлено, что средняя суточная концентрация 6-СОМТ в группе «А» составила 59,1 нг/мл (95%-ный ДИ: 45,3–72,8) и не отличалась от аналогичного показателя в контроле (74,1 нг/мл; 95%-ный ДИ: 68,1–77,7; р = 0,077). В группе «А» дневная концентрация 6-СОМТ была значимо выше таковой в контроле, ночная — ниже (табл. 3). В обеих группах наблюдения зарегистрировано сохранение повышенного уровня 6-СОМТ в моче в 4.00 (см. табл. 3).
Таблица 3
Концентрация 6-сульфатоксимелатонина в моче в выделенных группах, нг/мл
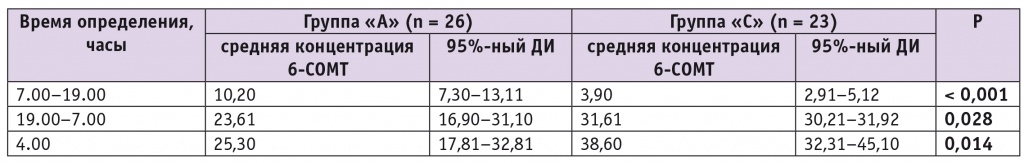
Примечание. 6-COMT — 6-сульфатоксимелатонин.
Однако уровень метаболита мелатонина в 4.00 был статистически значимо ниже в группе мужчин с МС и сменным характером труда (р = 0,014), т. е. имел место феномен снижения пикового выброса мелатонина в группе исследования. Для определения причинно-следственных отношений были оценены риски развития различных компонентов МС с расчетом отношения шансов (ОШ) и ДИ. Установлено, что снижение пиковой секреции мелатонина повышает риск развития абдоминального ожирения (ОШ = 1,80; 95%-ный ДИ: 0,8–3,7), АГ (ОШ = 1,68; 95%-ный ДИ: 0,8–3,7), гипертриглицеридемии (ОШ = 1,48; 95%-ный ДИ: 0,7–2,1) и к снижению ХС ЛПВП (ОШ = 1,78; 95%-ный ДИ: 0,9–2,6) при p < 0,05.
Нарушения сна были выявлены у всех испытуемых группы «А». Средний балл по шкале субъективной оценки качества ночного сна свидетельствовал о пограничной инсомнии (17 баллов; 95%-ный ДИ: 11–23) (см. табл. 2). Нарушения сна коррелировали с ночной и пиковой концентрацией мелатонина (r = –0,47 и r = –0,41 соответственно; в обоих случаях p < 0,005). При проведении множественного регрессионного анализа значение коэффициента множественной корреляции (R) составило 0,4 с регрессионным В-коэффициентом на уровне –0,413 (p < 0,05) и F-критерием Фишера, равным 4,5, что можно расценить как ухудшение качества сна на фоне нарушенной секреции мелатонина.
После 12 недель лечения были получены и оценены следующие результаты.
В подгруппе принимавших мелатонин (Циркадин) («А1») отмечено улучшение сна у 12 из 13 участников, что подтвердилось повышением среднего балла по шкале субъективной оценки качества ночного сна с 17,50 до 22,50 (см. табл. 3, табл. 4). В подгруппе без применения мелатонина (Циркадина) («А2») к окончанию срока лечения улучшение качества сна отметили только трое участников. У этих пациентов средний балл по шкале субъективной оценки качества ночного сна повысился до 22,0, а в целом по подгруппе «А2» он составил 19,25, что свидетельствовало о сохранении пограничных нарушений сна.
Таблица 4
Сравнительный анализ показателей гемодинамики и качества ночного сна при двух видах терапии
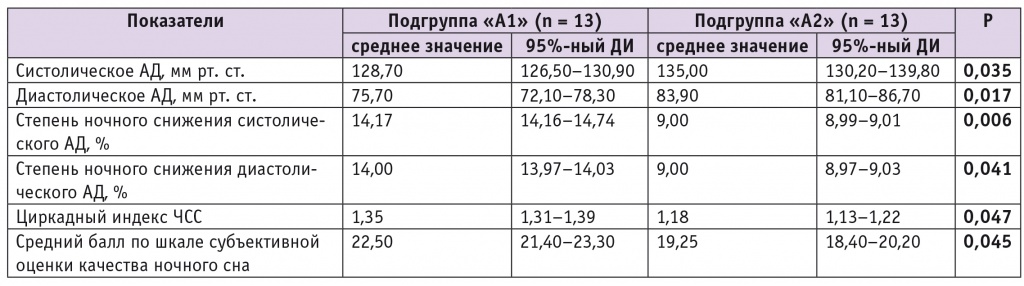
В подгруппе «А1» наблюдали дополнительные эффекты действия препарата мелатонина (Циркадин). Первый эффект был связан с улучшением циркадианных показателей гемодинамики. Так, у этих испытуемых были достигнуты целевые значения АД и степени его ночного снижения как для систолического, так и для диастолического давления. Кроме этого, наблюдалось снижение ригидности циркадианного профиля сердечного ритма, о чем свидетельствовала положительная динамика циркадного индекса, определяемого как соотношение между средней дневной ЧСС и средней ночной ЧСС (см. табл. 3, 4). В противоположность этому, в подгруппе «А2»» на фоне нормализации АД не было зарегистрировано достоверного снижения ночного АД и улучшения циркадного индекса (см. табл. 3, 4).
Вторым важным дополнительным эффектом добавления препарата мелатонина (Циркадин) к лечению пациентов явилось улучшение метаболических показателей. Так, в подгруппе «А1» уровень триглицеридов снизился до целевого (1,52 ммоль/л; 95%-ный ДИ: 1,12–1,97), а ХС ЛПВП возрос до целевого (1,28 ммоль/л; 95%-ный ДИ: 1,18–2,07). В подгруппе «А2» уровень триглицеридов остался высоким (2,10 ммоль/л; 95%-ный ДИ: 1,86–2,54; p = 0,037 в сравнении с «А1»), а ХС ЛПВП — низким (1,10 ммоль/л; 95%-ный ДИ: 1,05–1,86; p = 0,018 в сравнении с «А1»). Интересная особенность выявлена при анализе веса и окружности талии пациентов: вес снизился в обеих подгруппах, но только в подгруппе «А1» наблюдали уменьшение окружности талии пациентов до 108,06 см (95%-ный ДИ: 98,3–110,7; p = 0,035 в сравнении с исходной).
При приеме мелатонина (Циркадин) в течение 12 недель было зафиксировано два нежелательных явления без достоверной связи с применением препарата. Первое из них состояло в подъеме температуры, появлении заложенности носа и головной боли. Диагностировано ОРЗ, которое разрешилось через 5 суток и не потребовало отмены препарата. Второе нежелательное явление заключалось в появлении мышечного спазма и боли в шее. Диагностирован миозит, разрешившийся через 6 суток и также не потребовавший отмены препарата.
Эффективность применения мелатонина (Циркадина) иллюстрирует клинический случай. Пациент М., работавший наладчиком оборудования, со стажем работы посменно 8 лет обратился по поводу подъемов АД, нарушения процессов запоминания. Из анамнеза выяснено, что в течение 5 лет отмечалось нарастание веса, появилась слабость. При осмотре: ИМТ — 33,8 кг/м2, АД — 166/94 мм рт. ст., тоны сердца ритмичные, дыхание везикулярное. Живот без особенностей. Периферических отеков нет. Выявлена инсомния (18 баллов по шкале субъективной оценки качества ночного сна), данных в пользу апноэ сна при анкетировании не обнаружено. Результаты суточного мониторирования АД: среднесуточное давление — 148/92 мм рт. ст., степень ночного снижения АД — 9%, циркадный индекс — 1,17. Биохимические показатели: триглицериды — 2,7 ммоль/л, ХС ЛПВП — 0,82 ммоль/л.
Были назначены низкокалорийная диета с ограничением жиров, режим дня с обязательным отходом ко сну в дни, свободные от ночных смен, не позже 23.00, физические нагрузки (до 10 000 шагов в сутки), амлодипин 10 мг/сут, эналаприл 10 мг/сут, мелатонин (Циркадин) 2 мг за 20 минут до сна (в 22.30).
Спустя 12 недель качество сна улучшилось: средний балл по шкале субъективной оценки увеличился до 24, что свидетельствовало об отсутствии инсомнии. Вес снизился: ИМТ — 29,8 кг/м2. Нормализовались АД и показатели циркадности: при суточном мониторировании АД среднесуточное давление — 130/70 мм рт. ст., степень ночного снижения АД — 10%, циркадный индекс — 1,35; триглицериды — 1,6 ммоль/л; ХС ЛПВП — 1,1 ммоль/л. Таким образом, комплексная терапия вкупе с нормализацией образа жизни позволила своевременно скорректировать факторы риска сердечно-сосудистых осложнений у пациента.
ОБСУЖДЕНИЕ
Важнейшим результатом нашей работы было выявление нивелирования физиологических различий между уровнями ночной и дневной секреции и уменьшения пиковой секреции мелатонина в 3 часа ночи, характерных для мужчин со сменным характером работы и МС. О секреции мелатонина при посменной работе существуют различные данные. Одни свидетельствуют о его повышении, другие о снижении [9, 12]. Последние публикации подтверждают, что нарушения секреции мелатонина не столько количественные, сколько качественные (отсутствует его пиковый выброс) [16].
Именно процесс нарушения ритма секреции мелатонина важен для понимания патогенеза инсомнии и развития МС при посменной работе. Главная функция мелатонина заключается в синхронизации физиологических процессов организма человека с условиями окружающей среды, что осуществляется путем воздействия на метаболизм и гемодинамические показатели. Основной внешний синхронизатор циркадианной системы — свет — предотвращает секрецию мелатонина, и супрахиазмальные ядра активируют симпатическую систему, контролирующую утренний метаболизм. В это время плазменные уровни эпинефрина, норэпинефрина, глюкозы повышаются, что ведет и к росту АД, и к ускорению ЧСС. Кроме того, фотоэндокринная система увеличивает чувствительность тканей к инсулину в течение всего активного периода. В момент наступления темноты ингибирующее влияние света на супрахиазмальные ядра заканчивается и начинается активная выработка мелатонина. В это же время происходит блокирование симпатической нервной системы, контроль метаболизма переходит к парасимпатической системе [5].
Длительное воздействие искусственного освещения приводит к тому, что организм получает информацию, которая идет вразрез с собственными циркадианными ритмами. Данные процессы разрушают ритмичную смену активности симпатической и парасимпатической систем и способствуют развитию феномена «автономного конфуза», т. е. активации симпатической системы, в то время как все клеточные механизмы подготовлены к работе в условиях активности парасимпатической системы. Развивается симпатикотония, которая является причиной как нарушений сна, так и развития МС [12].
Другой причиной формирования МС может являться нарушение экспрессии генов времени. Молекулярные исследования последнего десятилетия выявили прямую связь между генами часов и регуляцией метаболизма, включая гомеостаз глюкозы, синтез липидов, адипогенез [10, 15]. Два основных гена циркадианной системы (Clock, Bmal) участвуют в дневной регуляции уровней глюкозы и триглицеридов, а ген Bmal I регулирует синтез липидов и адипогенез [14].
Мелатонин вызывает ритмическую экспрессию генов часов в периферических органах через свои рецепторы. На сегодняшний день известны два вида мембранных рецепторов (М1 и М2) и ядерный рецептор NMRS [5]. Ядерный рецептор к мелатонину относится к семейству RORS — разновидности рецепторов, которые встречаются практически в любом органе и ткани. Существует мнение, что через эти рецепторы мелатонин способен вызывать экспрессию генов времени. Недавние эксперименты показали, что ритмическое воздействие мелатонина на культуру адипоцитов вызывает соответствующую ритмическую экспрессию генов часов (Clock, Bmail), т. е. мелатонин можно рассматривать как регулятор жизнедеятельности жировых клеток. Экспрессия этих генов обеспечивает также активацию генов, регулирующих гомеостаз глюкозы, активность адипоцитов, гепатоцитов, активатора ингибитора плазминогена и деятельность сердца и печени [13, 14].
В нашем исследовании мы нашли подтверждение этим данным. Так, было установлено, что снижение пиковой секреции мелатонина приводит к статистически значимому (p < 0,05) увеличению риска развития абдоминального ожирения (в 2 раза), АГ (в 1,8 раза), гипертриглицеридемии (в 1,5 раза), снижению уровня ХС ЛПВП (в 1,8 раза). И препарат мелатонина замедленного высвобождения (Циркадин), соответствующий естественному циркадианному ритму, не только способствует коррекции инсомнии, но и обладает дополнительными свойствами, подобными действию эндогенного мелатонина.
ЗАКЛЮЧЕНИЕ
Мы подходим к пониманию того, насколько важен нормальный ритм секреции мелатонина, который является гормональным посредником, передающим данные об изменениях окружающей среды внутренним органам, что и обеспечивает соответствие физиологических процессов организма времени суток. Учитывая факты, изложенные в настоящей статье, можно объяснить выявленные плейотропные эффекты препарата мелатонина (Циркадин) механизмом замедленного высвобождения мелатонина, что моделирует физиологический ритм гормона и, вероятно, оказывает действие, схожее с действием эндогенного мелатонина [8, 10].
Осознавая пагубность нарушений освещенности и посменной работы в отношении формирования метаболического синдрома и обусловливаемого им последующего развития сердечно-сосудистых осложнений, следует расширить исследования по изучению влияния посменной работы на организм, а также плейотропных эффектов мелатонина с замедленным высвобождением (Циркадина).








