Рак шейки матки (РШМ) — распространенная форма злокачественных новообразований у женщин, которая остается важной медицинской и социальной проблемой, далекой от окончательного решения во всем мире, в том числе в экономически развитых странах.
В структуре причин смерти женщин в России в 2012 г. наибольший удельный вес имели злокачественные новообразования молочной железы (17,1%). Новообразования шейки матки (ШМ) составили 4,7%, заняв при этом первое место среди женщин в возрасте от 30 до 39 лет (24,0%). Высокие показатели смертности от РШМ наблюдаются и среди женщин моложе 30 лет (8,9%) [2].
Развитию РШМ предшествует предрак, или цервикальная интраэпителиальная неоплазия (cervical intraepithelial neoplasia, CIN), — морфологические изменения тканей c признаками патологического размножения клеток с атипией. По степени выраженности патологических морфологических изменений и клинических проявлений выделяют три основные формы CIN: легкую (CIN I), среднюю (CIN II) и тяжелую (CIN III). Известно, что при отсутствии отягощающих факторов интраэпителиальные поражения легкой степени (low-grade squamous intraepithelial lesion, LSIL) в течение 3–5 лет регрессируют в 30–60% наблюдений [37]. В то же время у 10–30% женщин, имеющих нормальную цитологическую картину цервикального эпителия и являющихся носительницами ДНК ВПЧ высокого онкогенного риска, наблюдается прогрессирование CIN I до CIN III и карциномы in situ, а у 1,5% развивается инвазивный РШМ [29, 31].
На трансформацию латентного носительства ВПЧ в неоплазию ШМ влияют такие факторы, как гормональный дисбаланс, частая смена сексуальных партнеров, хронические инфекционно-воспалительные заболевания генитального тракта, травматизация тканей ШМ во время абортов, родов и диагностических выскабливаний, иммунодефицитные состояния [19]. Роль длительного приема оральных контрацептивов в повышении риска возникновения неоплазий и РШМ в настоящее время окончательно не установлена [25, 28].
Общепризнано, что главным этиологическим фактором CIN и РШМ является инфицирование цервикального эпителия высокоонкогенными штаммами ВПЧ. ДНК ВПЧ высокого онкогенного риска (преимущественно 16-го и 18-го типов) обнаруживают в 50–80% образцов умеренной и тяжелой дисплазии плоского эпителия ШМ и в 90% образцов инвазивного РШМ [32].
Различают два способа существования ВПЧ в инфицированной клетке:
1) продуктивная (пермиссивная) инфекция, при которой ДНК ВПЧ находится в инфицированной клетке в эписомальном состоянии;
2) непродуктивная, или трансформирующая (непермиссивная), инфекция, при которой ДНК вируса встраивается в геном инфицированной клетки.
Продуктивная инфекция обратима. При ее благополучном исходе у многих ВПЧ-инфицированных наступает ремиссия. В этом случае в процессе активной репродукции вируса экспрессия онкогенов Е6 и Е7 регулируется белковым продуктом гена Е2 — репрессором их транскрипции — и носит умеренный характер [5].
Продуктивная ВПЧ-инфекция, при которой ДНК ВПЧ находится в инфицированной клетке в эписомальной форме, гистологически характеризуется как CIN I–II. Практически любой тип вируса, поражающий эпителий ШМ, может быть обнаружен при CIN I, и все они вызывают однотипные гистологические и цитологические изменения. До тех пор, пока не обнаружены фигуры атипичных митозов, указывающие на анеуплоидность (диагностический признак злокачественности), невозможно отличить повреждения эпителия ШМ, вызванные низкоонкогенными типами ВПЧ, от повреждений, вызванных высокоонкогенными типами. Появление анеуплоидности, клеточной атипии, митотической активности соответствует CIN II или CIN II+ [6].
В отличие от продуктивной ВПЧ-инфекции, инфицирование эпителиальной клетки по второму типу является первым шагом к ее опухолевому перерождению и часто заканчивается развитием цервикальной карциномы (рис.). Поэтому данная форма существования ВПЧ в клетке имеет второе название — трансформирующая ВПЧ-инфекция. В результате включения вирусной ДНК в геном клетки-хозяина происходит частичная потеря вирусного генетического материала, но обязательно сохраняются, а затем гиперэкспрессируются ключевые вирусные онкогены Е6 и Е7. Эти события влекут за собой изменения метаболизма инфицированной вирусом клетки, направленные на ее опухолевую трансформацию и малигнизацию.
Рис. Встраивание дезоксирибонуклеиновой кислоты вируса папилломы человека (ДНК ВПЧ) в хромосому инфицированной клетки, синтез онкобелка Е7 [5].
Примечание: А ― встраивание ДНК ВПЧ в хромосому; Б ― активное деление клетки с интегрированной копией вирусной ДНК, формирование клона опухолевых клеток, синтезирующих онкобелки Е6 и Е7
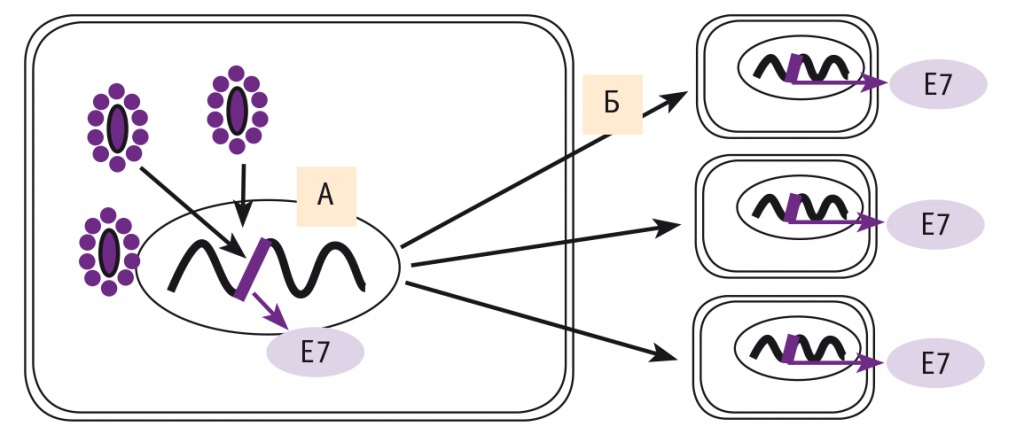
ВПЧ-инфекция, при которой ДНК ВПЧ высокого онкогенного риска интегрирована в геном клетки-хозяина, гистологически диагностируется как CIN II–III. Повышенная продукция вирусных онкогенов Е6 и Е7 при трансформирующих CIN инициирует запуск целого комплекса внутриклеточных молекулярных механизмов, которые направлены на подчинение интересов инфицированной клетки реализации малигнизирующих свойств проникшего в нее ВПЧ. При этом усиливается клеточное деление, т. е. наблюдается патологическая гиперпролиферация, нарушаются механизмы апоптоза, клеточной адгезии, ДНК-репарации, индуцируются процессы хромосомной нестабильности, развивается выраженная иммуносупрессия [27].
В ДНК клетки-хозяина происходят множественные эпигенетические модификации (аномальное метилирование, модификация гистонов хроматина, экспрессия проканцерогенных микроРНК), приводящие к функциональному выключению генов опухолевой супрессии и, как следствие, к усиленной опухолевой трансформации инфицированных клеток вирусом.
Таким образом, интеграция ДНК ВПЧ высокого онкогенного риска в геном инфицированных эпителиальных клеток ШМ и последующая гиперэкспрессия онкогенов Е6 и Е7 фактически означают начало процессов цервикального канцерогенеза [5].
АНОМАЛЬНАЯ ГИПЕРПРОЛИФЕРАЦИЯ КЛЕТОК, ИНФИЦИРОВАННЫХ ВИРУСОМ ПАПИЛЛОМЫ ЧЕЛОВЕКА
Общеизвестно, что в основе развития неопластического процесса лежат бесконтрольное клеточное деление (клеточная пролиферация) и дисрегуляция нормального клеточного цикла.
Достоверно установлено, что онкобелки Е6 и Е7 ВПЧ высокого онкогенного риска, блокируя остановку клеточного цикла в начальной G-фазе (нормальная реакция организма на повреждение ДНК, вызванное инфицирующим агентом), индуцируют аномальный переход в S-фазу цикла. Примечательно, что способностью отменять остановку клеточного цикла в случае повреждения ДНК обладают исключительно высокоонкогенные штаммы ВПЧ, в частности ВПЧ-16. Низкоонкогенные штаммы ВПЧ (ВПЧ-6) подобным свойством не обладают. Данный факт был установлен независимо в разных лабораториях [23].
На скорость клеточной пролиферации важнейшее влияние оказывает гормональный фон. Гиперэстрогения играет ключевую роль в развитии гиперпластических и опухолевых процессов в гормонзависимых органах и тканях репродуктивной системы. Доказано, что ВПЧ-зависимая патологическая пролиферация в тканях ШМ, как и аномальная гиперпролиферация в других эстрогензависимых тканях, в значительной степени определяется нарушением метаболизма эстрогенов [30].
Основной пул эндогенных эстрогенов утилизируется в печени посредством монооксигеназной системы цитохромов Р-450, катализирующей образование гидроксипроизводных эстрадиола. CYP1A2 окисляет эстрогены до 2-гидроксиэстрона (2-ОНЕ1). В меньшей степени этот фермент участвует в 4-гидроксилировании. CYP1B1 способствует образованию 4-гидроксиэстрогенов, которые обладают более низкой активностью, чем эстрадиол, но могут повреждать ДНК клетки и приводить к мутациям. CYP3A4 окисляет эстрогены до 16α-гидроксиэстрона (16α-ОНЕ1).
16α-ОНЕ1 как мощный агонист эстрадиола обладает в несколько раз большей биологической активностью, чем свободные фракции эстрогенов, и относится к категории «агрессивных» гормонов, имеющих проканцерогенный эффект. Показано, что этот эффект обусловлен образованием прочных ковалентных связей 16α-ОНЕ1 с ядерными эстрогеновыми рецепторами. Есть также сведения о генотоксических свойствах 16α-ОНЕ1 [15]. В то же время 2-ОНЕ1 практически не влияет на клеточную пролиферативную активность, действуя как слабый агонист эстрадиола (низкоактивный эстроген), а в некоторых опытных моделях даже как антиэстроген. При повышении уровня 2-ОНЕ1 наблюдается тенденция к гибели опухолевых клеток и предупреждению их дальнейшего образования.
Изучение функций этих двух метаболитов позволило выявить однозначную прямую связь между уровнем 16α-ОНЕ1 и риском развития опухолей в эстрогензависимых тканях и заключить, что отношение 2-ОНЕ1 к 16α-ОНЕ1 является универсальным биомаркером и надежным диагностическим критерием риска и прогноза развития эстрогензависимых опухолей. Отношение 2-ОНЕ1 к 16α-ОНЕ1 должно быть более 2 : 1 [9].
В норме в эпителиальных клетках ШМ не происходит конверсии эстрадиола в 16α-ОНЕ1. При инфицировании ДНК ВПЧ изменяет программу работы клеток [18]. Установлено, что гиперпродукция 16α-ОНЕ1 увеличивает злокачественный потенциал ВПЧ-инфицированных эпителиальных клеток [36]. В эпителиальных клетках ШМ, содержащих ВПЧ-16, эстрадиол конвертируется в 16α-ОНЕ1 в 200 раз более активно, чем в 2-ОНЕ1, что, в свою очередь, приводит к патологической пролиферации ВПЧ-инфицированных клеток.
В итоге всех вышеперечисленных процессов формируется «порочный патогенетический круг»: проникший в клетку высокоонкогенный ВПЧ через образование «агрессивного» эстрогена 16α-ОНЕ1 обеспечивает пролонгированный эффект гормона — индуктора пролиферации, создавая благоприятные условия для развития опухоли, а образовавшийся прочный комплекс «гормон — рецептор», в свою очередь, стимулирует повышенную экспрессию вирусных онкогенов и онкобелков Е6 и Е7, которые активируют процессы опухолевого роста и малигнизации [4].
АПОПТОЗ
Программированная клеточная гибель, или апоптоз, является физиологическим процессом, который в комплексе с клеточной дифференцировкой и пролиферацией поддерживает гомеостаз на тканевом и соматическом уровнях. В норме апоптоз служит для удаления клеток, претерпевших неопластическую трансформацию либо имеющих генетические или иные нарушения, способные привести к развитию рака. В частности, это относится к развитию предраковых процессов и РШМ, при которых, как доказано в последние годы, ведущую роль играет папилломавирусная инфекция. Показано, что активность пролиферации клеток возрастает по мере повышения степени CIN; одновременно с этим увеличивается и количество клеток, подвергшихся апоптозу [34].
АНОМАЛЬНЫЕ ЭПИГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ
Напомним, что эпигенетическая регуляция — это эволюционный механизм, посредством которого обеспечиваются наследуемые изменения в спектре экспрессии генов, не связанные с изменениями в структуре ДНК. Так, известно, что набор генов одного индивидуума содержит абсолютно идентичную информацию. Однако клетки различных органов и тканей, имея полученный по наследству одинаковый набор хромосом, в процессе развития и функционирования экспрессируют различные гены. Экспрессия генов — процесс, в ходе которого наследственная информация от гена преобразуется в функциональный продукт — РНК или белок.
Существуют три основных способа эпигенетического регулирования. Ключевой механизм — это метилирование ДНК. Такое метилирование происходит по цитозиновому остатку под действием фермента ДНК-метилтрансферазы (DNMT) в строго определенных участках гена — так называемых динуклеотидных островках CpG, — которые содержатся в промоторной области подавляющего большинства генов. Промоторное метилирование приводит к снижению экспрессии гена вплоть до его полной инактивации («эпигенетического молчания»). Многие неспецифические факторы и условия, в которых находится организм (воспаление, стресс, плохая экология, консерванты), приводят к аномальной активации DNMT.
К настоящему моменту накоплена обширная информация, подтверждающая роль аномального ДНК-метилирования в возникновении и прогрессии злокачественных опухолей человека. Напротив, ингибирование DNMT приводит к блокированию гиперметилирования вновь синтезированных молекул ДНК, в результате чего снижается общий уровень метилирования генома и реэкспрессируются «молчащие» гены, что влечет за собой синтез кодируемых ими белков и восстановление утраченной функции [20].
Процессы аномального ДНК-метилирования, запускающие превращение цервикальных неоплазий в злокачественные образования, индуцируются высокоонкогенными штаммами ВПЧ, проникшими в геном клетки-хозяина. Это подтверждается экспериментально установленным фактом активации фермента DNMT вирусными онкобелками Е6 и Е7. Так, показано, что онкобелок Е6 ВПЧ-16 опосредованно повышает активность DNMT1 через ингибирование опухоль-супрессорного белка р53, а онкобелок Е7 ВПЧ-16 напрямую связывается с ферментом DNMT1 и активирует его [13].
Онкобелки Е6 и Е7 сообщают генетическую нестабильность инфицированным клеткам за счет эпигенетических модификаций, в том числе посредством активирования ДНК-метилирования [38]. Метилирование генов опухолевой супрессии приводит к функциональной блокаде кодируемых ими белков, отвечающих за противоопухолевую защиту клетки.
Обратимость аномальных эпигенетических модификаций делает опосредующие ее ферменты крайне привлекательными лекарственными мишенями при разработке таргетных эпигенетических препаратов. Ключевой такой мишенью обоснованно считают DNMT.
В настоящее время накоплен огромный массив экспериментальных данных, не оставляющий сомнений в том, что опухолевая трансформация в ВПЧ-инфицированных клетках цервикального эпителия сопровождается индукцией массовых эпигенетических изменений, в результате которых резко понижается уровень экспрессии генов опухолевой супрессии. Причем рост частоты эпигенетических аномалий отмечается при переходе патологического неопластического процесса от стадии LSIL к стадии high-grade squamous intraepithelial lesion (HSIL). В многочисленных исследованиях установлено, что по мере прогрессии цервикальных неоплазий от LSIL (CIN I) к HSIL (CIN II–III) резко повышается уровень метилирования большой группы генов, ответственных за регуляцию базовых биологических процессов, опосредующих канцерогенез, таких как клеточная пролиферация (клеточный цикл), дифференцировка, выживаемость (апоптоз), ДНК-репарация, клеточная адгезия, метастазирование, ангиогенез, гормональный ответ. В то же время показано, что в образцах ШМ при диагнозе LSIL уровень промоторного метилирования указанных генов или незначительно превышает норму, или полностью ей соответствует [12, 17, 33, 35, 39].
В 2006 г. группой российских авторов была проведена работа по изучению метилирования панели опухоль-супрессорных генов в образцах ткани ШМ у женщин без гинекологических заболеваний, в биоптатах пациенток с CIN III и в смежных с CIN III участках цервикса (расположенных рядом, но отграниченных здоровой тканью) [3]. При диспластических процессах в цервикальной ткани (в том числе в образцах ткани, смежной с дисплазией) был выявлен аномально высокий уровень метилирования трех из шести исследуемых генов. В то же время у женщин без гинекологических заболеваний наблюдали невысокий уровень метилирования генов-супрессоров.
Другое отечественное исследование проводилось с целью разработки патогенетически обоснованного подхода к формированию групп повышенного онкологического риска с учетом выявления метилирования генов-супрессоров опухолевого роста у пациенток с доброкачественными и предраковыми процессами ШМ для выбора последующей оптимальной тактики лечения [8]. Были обследованы 127 женщин репродуктивного возраста с морфологически верифицированными доброкачественными и предраковыми заболеваниями ШМ, стратифицированными по виду поражения: первая группа (n = 42) — женщины с доброкачественными заболеваниями ШМ (цервицитом, эндометриозом ШМ, лейкоплакией); вторая (n = 33) — пациентки с CIN I; третья (n = 27) — женщины с CIN II; четвертая группа (n = 25) — больные с CIN III.
Результаты исследования продемонстрировали прямую корреляцию между метилированием маркерных опухоль-супрессорных генов и прогрессированием CIN. Было показано, что при повышенном уровне метилирования генов противоопухолевой защиты вероятность прогрессии CIN повышается в 21 раз. Авторы исследования заключили, что с помощью анализа статуса метилирования исследованных опухоль-супрессорных генов можно облегчить раннюю диагностику злокачественного процесса и прогнозировать динамику его развития, а также выбрать оптимальный вариант терапии, направленной на восстановление активности кодируемых этими генами белков противоопухолевой защиты.
ЛЕЧЕНИЕ
Очевидно, что тормозящее действие на ход предраковых процессов можно оказать, влияя на базовые биологические процессы, лежащие в основе канцерогенеза, в частности блокируя патологическую клеточную пролиферацию, стимулируя апоптоз трансформированных клеток, а также деметилируя гены противоопухолевой защиты [24]. В плане предотвращения развития карцином ШМ перспективными следует считать терапевтические подходы, при которых оказывается воздействие на основные механизмы цервикального канцерогенеза, — ингибирование экспрессии онкогена Е7 ВПЧ, подавление синтеза 16α-ОНЕ1 и аномального ДНК-метилирования.
К настоящему времени известны природные соединения, блокирующие развитие гипер- и неопластических процессов в эпителиальных тканях, высокая эффективность которых доказана в экспериментальных и клинических исследованиях. Показано, что такие вещества обладают множественной противоопухолевой активностью, т. е. влияют на несколько ключевых механизмов процесса канцерогенеза, в то же время не оказывая токсического воздействия на организм. Одним из подобных соединений является индол-3-карбинол (I3C). Многочисленные данные литературы, посвященной изучению I3C, касаются его противоопухолевой активности в эстрогензависимых органах и тканях (молочных железах, эндометрии и ШМ), для которых характерно циклическое изменение уровня клеточной пролиферативной активности [11, 16, 21].
Первые результаты были получены L. Jin и соавт. на модели трансгенных мышей с интегрированным в геном ВПЧ-16, получавших 17β-эстрадиол [26]. Одна группа животных дополнительно получала I3C в физиологических дозах в течение 60 дней, вторая группа была контрольной. К концу исследования (через 6 месяцев от начала терапии) в группе приема I3C только у 8,3% мышей развился РШМ, тогда как в контрольной группе РШМ имели 76% животных, а у остальных 24% мышей контрольной группы была обнаружена выраженная дисплазия цервикального эпителия.
В исследовании in vitro и in vivo показано, что I3C [5]:
-
снижает уровень экспрессии онкобелка Е7, препятствуя гормонзависимой пролиферации инфицированных клеток;
-
нормализует метаболизм эстрадиола в клетках, инфицированных ВПЧ, блокируя образование канцерогенного метаболита 16α-ОНЕ1;
-
вызывает индукцию апоптотических процессов ВПЧ-инфицированных клеток;
-
ингибирует фермент DNMT.
Противоопухолевая активность I3C как средства профилактики и лечения CIN подтверждена в международном плацебо-контролируемом исследовании [14]. В нем участвовали пациентки с гистологически подтвержденной CIN II–III, которые были рандомизированы на две группы. Первая группа получала плацебо, вторая — I3C в дозе 200 или 400 мг/день перорально в течение 12 недель. Результаты исследования показали, что ни у одной из 10 женщин первой группы по истечении 12 недель не наблюдалось полной регрессии CIN, в то время как у 3 из 8 пациенток, получавших I3C в дозе 200 мг/день, и у 4 из 9 принимавших препарат в дозе 400 мг/день была обнаружена полная регрессия CIN.
Полный регресс CIN и улучшение отмечены у 88% участниц группы I3C. Регрессия CIN была доказана с использованием гистологического метода исследования. Этот протективный эффект был подтвержден величиной ОР, равного 0,50 (р = 0,023) для дозы препарата 200 мг/день и 0,55 (р = 0,032) для дозы 400 мг/день, что означает снижение риска в 2 раза [14].
Заслуживает также внимания исследование О. Н. Юсуповой, целью которого являлось изучение эффективности I3C в лечении CIN I [10]. Пациентки были рандомизированы на три группы, в каждую вошли 60 женщин. Группа I получала местное лечение низкоинтенсивным полупроводниковым лазером, группа II — терапию с использованием I3C. Участницы контрольной группы лечение не получали.
Наблюдение за женщинами с дисплазией ШМ легкой степени в течение 6 месяцев выявило прогрессирование участков поражения в 15% случаев, у 13,3% женщин был отмечен регресс и у 71,7% — персистенция. Применение низкоинтенсивного лазерного излучения при лечении CIN I дало положительный эффект у 73,4% женщин, регресс был отмечен в 26,7% наблюдений. Использование I3C у 83,4% пациенток с CIN I привело к положительному результату, регресс имел место в 31,7% наблюдений.
В последние годы появились работы, свидетельствующие о том, что из веществ природного происхождения помимо I3C направленно регулировать активность опухоль-супрессорных генов, отвечающих за противоопухолевую защиту организма, и тем самым оказывать патогенетическое профилактическое действие в отношении развития предраковых и раковых состояний ШМ способен флавоноид эпигаллокатехин-3-галлат (EGCG). В первую очередь это касается регуляции аномальных эпигенетических модификаций. В исследовании 2003 г. отмечено, что EGCG подавляет аномальное метилирование, т. е. является ингибитором фермента DNMT [22]. Как отмечено нами выше, восстановление активности метилированных («молчащих») опухоль-супрессорных генов сопровождается активацией противоопухолевой защиты клетки, что позволяет снизить риск озлокачествления.
Комбинация соединений I3C и EGCG присутствует на российском фармацевтическом рынке в виде средства Промисан — эффективного дополнения программы ведения пациенток с CIN как при консервативной, так и при оперативной тактике. Прием Промисана позволяет осуществить не только направленное воздействие на патогенетические механизмы развития папилломавирусной инфекции, но и таргетную активацию экспрессии опухоль-супрессорных генов, обеспечивающих противоопухолевую защиту организма. Схема терапии: 2 капсулы Промисана 2 раза в день в течение 6 месяцев — подтвердила свою терапевтическую эффективность в лечении пациенток с CIN [1, 7].
ЗАКЛЮЧЕНИЕ
Резюмируя все вышесказанное, следует отметить, что использование новых терапевтических подходов, в основе которых лежит воздействие на ключевые молекулярные механизмы патологических процессов в тканях шейки матки (ШМ), позволит практическому врачу выбрать рациональную тактику ведения пациенток с ВПЧ-ассоциированными заболеваниями (применение природных соединений с противоопухолевой активностью в качестве монотерапии или в комбинации с физиохирургическими методами), значительно снизить количество неблагоприятных исходов cervical intraepithelial neoplasia (CIN) и воспрепятствовать трансформации CIN в рак ШМ.








