Первую операцию с использованием эндопротеза при аневризме брюшной аорты выполнил харьковский хирург и изобретатель Н. Л. Володось в 1987 г. В том же году он произвел эндопротезирование (англ. stent-grafting) аневризмы нисходящей грудной аорты, использовав только бедренный доступ. В 1991 г. J. C. Раrodi и соавт. [28] осуществили эндоваскулярное протезирование аневризмы брюшной аорты путем трансфеморального введения и фиксации стент-графта в полости аневризмы под рентгенологическим контролем.
Ранее варианты лечения были ограничены выжидательной тактикой, контролем АД с динамическим наблюдением и открытой хирургической коррекцией. Высокий уровень периоперационных осложнений при открытой операции обусловил определение четких показаний к хирургическому вмешательству: размер аневризмы более 5,5 см по наружному диаметру, рост аневризмы более чем на 1 см в год, сопутствующая патология и другие обстоятельства, указывающие на возможный риск разрыва аневризмы [7, 18, 35]. При появлении возможности эндопротезирования аневризмы брюшной аорты (англ. EndoVascular Aneurysm Repair — EVAR) были разработаны новые принципы отбора пациентов на операцию.
Многочисленные исследования показали, что при EVAR значительно сокращается продолжительность пребывания пациента в стационаре, а также уменьшается число периоперационных осложнений по сравнению с открытой операцией [2, 9, 12, 13, 19, 24, 26, 34]. Хотя нередко у пациентов с неподходящей морфологией аневризмы отдавалось предпочтение открытой операции [30].
Пациентам, которые обращаются для лечения впервые выявленной аневризмы брюшной аорты без предварительного обследования, необходимо выполнять исследование грудного отдела, чтобы исключить сопутствующую аневризму грудной аорты. Визуализация перед открытой операцией позволяет оценить размер аневризмы и скорость ее роста для определения необходимости проведения вмешательства, а также дает возможность получить дополнительную информацию об анатомических вариантах аневризмы, что помогает избежать осложнений во время операции.
При отборе больных на EVAR требуется точное предоперационное обследование с оценкой морфологии аневризмы, ее размера и сосудистых доступов [39, 41]. При определении возможности EVAR первично оценивается морфология проксимальной шейки — сегмента от нижней почечной артерии до проксимальной границы аневризмы. Неблагоприятная анатомия шейки аневризмы была самой частой причиной невозможности выполнения EVAR в прошлом [1, 3, 43].
Минимальные требования для стандартных эндопротезов по проксимальной (аортальной) шейке:
1) диаметр шейки более 17 мм и менее 32 мм;
2) угол между супраренальной аортой и юкстаренальной аортой менее 60°;
3) угол между юкстаренальной аортой и длинником аневризматического мешка менее 60-90°;
4) длина шейки более 10 мм;
5) тромботические наложения менее 50% окружности шейки;
6) расширение шейки менее чем на 3 мм на протяжении 10 мм в каудальном направлении от почечных артерий;
7) кальциноз менее 50% окружности шейки [1, 3, 43].
Для традиционного EVAR размер шейки более 15 мм в длину и менее 30 мм в диаметре является идеальным для обеспечения адекватного прилегания и фиксации проксимальной части эндопротеза. Хотя в последние годы стали доступны новые устройства, которые либо имеют непокрытую проксимальную часть, позволяющую размещать эндопротез непосредственно в проекции ветвей аорты, либо обладают готовыми дополнительными браншами для верхней брыжеечной или почечных артерий [1]. Эти устройства известны как браншированные или фенестрированные (с готовыми браншами для висцеральных артерий и с отверстиями под висцеральные артерии соответственно). Наличие пристеночного тромба или кальциноза более 50% окружности аорты в проксимальной области шейки аневризмы аорты связано с повышенным риском появления эндолика (протекания) 1-го типа, а также миграции эндопротеза [4, 43].
Дистальная зона имплантации, как правило, находится в общей подвздошной артерии. С появлением устройств нового поколения диаметр общей подвздошной артерии до 20 мм стали считать оптимальным для EVAR [40]. Минимальный размер наружной подвздошной артерии должен быть более 7 мм для безопасной доставки эндопротеза [15, 21].
При эндопротезировании аневризмы брюшной аорты возможны следующие осложнения: эндолик, миграция эндопротеза, перегиб и тромбоз браншей, инфицирование эндопротеза и почечная недостаточность. Наиболее серьезным осложнением является продолжающееся расширение аневризматического мешка, оно может привести к разрыву даже после успешного EVAR [33]. Самое частое осложнение EVAR — формирование эндолика, которое может внести свой вклад в расширение и разрыв аневризматического мешка [31]. Хотя для техники EVAR характерна низкая периоперационная смертность [8], возможность осложнений и потребность в повторных вмешательствах остается [9, 19, 26], поэтому необходим пожизненный мониторинг.
Конечная цель эндоваскулярного лечения — предотвратить разрыв аневризмы, поэтому последующие исследования являются наиболее полезным инструментом для оценки результатов и дают возможность снизить процент осложнений в отдаленном периоде наблюдения. Успех отражается в стабильности размеров аневризмы или регрессии с течением времени [42]. Основные параметры, на которые необходимо обращать внимание при последующей визуализации: диаметр аневризмы аорты, обнаружение и классификация эндоликов, а также выявление морфологических изменений эндопротеза [17]. Методы визуализации следует оценивать по их эффективности в получении и трактовке этих данных, а также по их безопасности, в том числе с учетом использования ионизирующего излучения и потенциально нефротоксичных контрастных препаратов.
КТ имеет превосходное пространственное разрешение, высокую проникающую способность и широкую доступность. Она получила признание в качестве «золотого стандарта» как для предварительной оценки возможности EVAR, так и для оценки результатов эндоскопических и открытых операций. Ее недостатками являются использование ионизирующего излучения и контрастного вещества, а также более высокая стоимость по сравнению с УЗИ.
Нет необходимости в проведении КТ в раннем послеоперационном периоде после открытых операций при аневризме брюшной аорты. После открытой операции рекомендуется проводить КТ регулярно в течение 5 лет для обнаружения дегенерации аневризмы аорты в проекции почечных и подвздошных артерий, а также для оценки проходимости протеза или состояния анастомозов [23].
После EVAR другая ситуация: необходим более активный режим наблюдения, включающий в себя КТ с контрастированием через 1, 6 и 12 месяцев после выполнения процедуры, а далее ежегодно. При отсутствии неблагоприятных исходов при раннем обследовании после EVAR интенсивность и частоту наблюдений можно менять [14, 29, 37]. По сравнению с обычной рентгенконтрастной ангиографией КТ с контрастированием может иметь более высокую чувствительность в выявлении эндоликов после EVAR (рис. 1, 2) [4].
Рис. 1. Мультиспиральная компьютерная томограмма, проведенная после эндопротезирования аорты. Стрелкой указан эндолик 2Б типа. Фото авторов
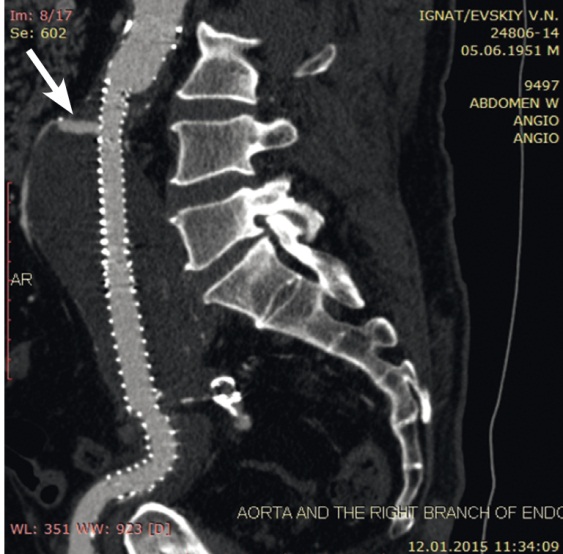
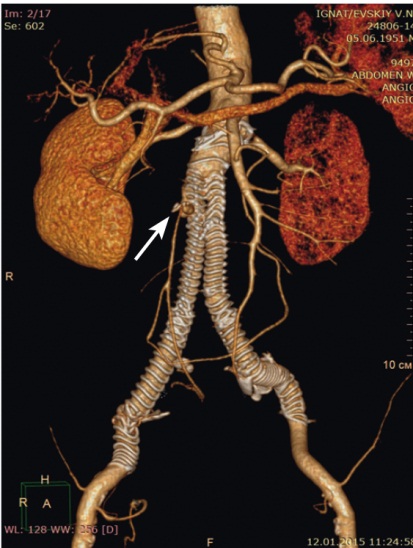
Рис. 2. Мультиспиральная компьютерная томограмма в режиме 3D-реконструкции, проведенная после эндопротезирования аорты. Стрелкой указан эндолик 2Б типа. Фото авторов
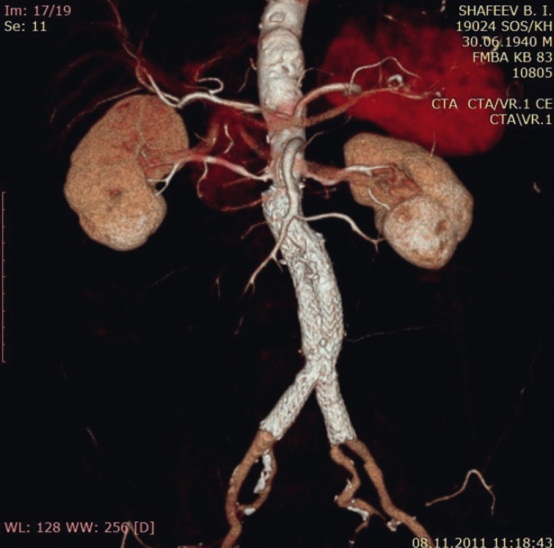
КТ может быть выполнена как единое (в артериальной фазе), двухфазное (неконтрастное и в артериальной фазе или в артериальной и отсроченной фазах) или трехфазное исследование (неконтрастное, в артериальной и отсроченной фазах). Для уменьшения суммарной дозы излучения предлагается устранять артериальную фазу [25], однако есть мнение, что необходимо устранить отсроченные фазы [20, 22]. Предложено также использовать неконтрастную фазу только на первом месяце послеоперационного наблюдения [36]. Есть сообщения о получении изображений только в замедленной фазе с двойной энергией КТ, с реконструкцией виртуальных неконтрастных изображений (рис. 3) [38].
Рис. 3. Мультиспиральная компьютерная томограмма брюшной аорты и ее ветвей, проведенная через 5,5 года после эндопротезирования аорты. Фото авторов
Первоначально в большинстве исследований для оценки результатов EVAR использовался максимальный диаметр аневризмы [16]. Этот метод был ненадежным из-за значительной вариабельности его измерений разными специалистами [10]. Анализ объема был признан в качестве более надежного метода для определения успеха процедуры [5, 32]. В целях снижения излучения и контрастной экспозиции некоторые авторы предложили использовать последовательный анализ объема аневризмы аорты с неконтрастной КТ как скрининг-тест для контроля после EVAR [6, 9, 27]. У пациентов, которым контрастные вещества противопоказаны, измерения объема аневризмы аорты при неконтрастной КТ также дают ценную информацию [11].
Потенциально неблагоприятные последствия для здоровья, связанные с воздействием рентгеновского излучения, являются важным фактором при принятии решения о необходимой для исследования процедуре.
ЗАКЛЮЧЕНИЕ
Операция эндопротезирования (EVAR) является революционным методом, который изменил подход к лечению аневризм брюшной аорты. Правильный выбор пациента после тщательной оценки предоперационной компьютерной томограммы имеет первостепенное значение для успешного выполнения EVAR.
Компьютерная томография позволяет с высокой точностью определить протекание (эндолики) после операции EVAR, но консенсус по оптимальному протоколу такого исследования не достигнут из-за использования ионизирующего излучения и потенциально нефротоксичных контрастных препаратов.








