ВВЕДЕНИЕ
Несостоятельность швов анастомоза (НША) — наиболее грозное и опасное для жизни осложнение в абдоминальной хирургии. По данным различных авторов, оно является причиной послеоперационных гнойных осложнений в 0,5–20% случаев, из которых 20–64% имеют летальный исход. Несмотря на прогресс в технике выполнения операций на верхних отделах ЖКТ и в лечении послеоперационных инфекционных осложнений, эти цифры за последние 15 лет значительных изменений не претерпели[1–3].
Общими факторами риска развития дефекта соустья называют системные изменения организма, способные нарушить течение репаративных процессов в области пищеводно-желудочно-кишечного анастомоза, среди которых наиболее часто встречаются случаи СД, механической желтухи, кахексии и гипопротеинемии вследствие неполноценного питания, уремии, интоксикации и др.
В основе развития данного осложнения лежит совокупность причин, основной из которых следует считать нарушение хирургической техники при формировании анастомоза. Кроме этого, частота возникновения НША зависит от таких факторов, как выбор вида шва и шовного материала, степень загрязнения операционной раны и травматизации тканей, точность сопоставления краев стенок органа и др. Все эти факторы могут оказывать влияние на степень нарушения микроциркуляции ткани и микробную проницаемость в области соустья[1, 4]. Возраст пациента, антибиотикопрофилактика, применение репарантов и стимуляторов перистальтики не оказывают значимого влияния на сроки формирования анастомоза[1].
«Ранние» несостоятельности возникают на вторые–третьи сутки после оперативного вмешательства и связаны в большинстве случаев с техническими ошибками формирования анастомоза. Проявляется данное осложнение развитием перитонита, который носит диффузный характер, что связано с отсутствием отграничения области анастомоза от остальных отделов брюшной полости. «Поздние» дефекты анастомоза проявляются на седьмые–десятые сутки после операции. К этому времени местные сращения уже сформированы, образуются гнойные затеки и «карманы», что обусловливает латентное течение осложнения[2, 3].
Традиционно основным методом лечения полных дефектов стенки ЖКТ является хирургическое вмешательство. Вместе с тем в последние годы спектр новых и инновационных методов лечения таких состояний быстро расширяется, и теперь в арсенале специалистов есть множество нехирургических вариантов лечения, которые применяются по определенным показаниям. Ранее считалось, что эффективность этих методов невысока, однако сейчас на первое место выходят малоинвазивные методики лечения данной патологии[5].
Существует большой выбор вариантов эндоскопического лечения НША: использование биоадгезивных клеев, биологического свищевого обтуратора, вакуум-аспирационной терапии (ВАТ); наложение эндоскопических лигирующих колец; формирование эндоскопического шва с помощью лигатуры или клипс и их комбинаций и вариаций; применение специальных насадок на эндоскоп типа Apollo Overstitch (США), позволяющих накладывать швы на дефект стенки органа без перехода на лапаротомию; закрытие дефекта с помощью окклюдера межпредсердной перегородки. Каждый из этих методов имеет достоинства, а также ограничения в использовании[6–8].
Первые сообщения о применении нового метода лечения несостоятельности анастомозов с использованием эндоскопической системы для ВАТ относятся к 2006 году [9]. Публикации, в которых описано клиническое использование данного метода, носят единичный характер, в них приведен анализ небольшого количества клинических наблюдений, а рандомизированные многоцентровые исследования на сегодняшний день отсутствуют[3, 5, 6, 10, 11].
Установлено, что неудачи в использовании метода вакуумной терапии связаны с большими сложностями доставки полиуретановой губки с дренажной трубкой к зоне несостоятельности[5, 7, 12]. В связи с этим мы разработали несколько усовершенствованных методик эндоскопической локальной вакуумной терапии при данной патологии, которые использовали в различных комбинациях в зависимости от характера дефекта стенки в зоне НША[10, 13]. Для иллюстрации успешного применения локальной вакуумной терапии при НША приводим одно из клинических наблюдений.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент (19 лет) находился на обследовании и лечении в другом лечебном учреждении, где при ЭГДС от 18.05.2020 в кардиальном отделе желудка, по задней стенке, ближе к малой кривизне, выявлен четко отграниченный участок слизистой с яркой гиперемией до 20 мм в наибольшем измерении с нарушенной архитектоникой ямок эпителия при осмотре в узком спектре света. При гистологическом исследовании биопсийного материала была выявлена низкодифференцированная перстневидноклеточная аденокарцинома. Пациенту выполнили 07.07.2020 комбинированную проксимальную субтотальную резекцию желудка с резекцией нижнегрудного отдела пищевода с лимфодиссекцией D2.
Из представленной выписки установлено, что ранний послеоперационный период протекал без осложнений. Через 7 дней после операции было произведено рентгенологическое исследование пищевода с водорастворимым контрастом — признаков затека контрастного вещества за пределы анастомоза не выявлено. На следующий день были удалены назоинтестинальный зонд и дренаж из средостения. Пациент начал питаться через рот самостоятельно по диете № 1.
Однако 16.07.2020 у пациента появились боли в межлопаточной области, а на следующий день болевой синдром распространился на левую половину грудной клетки, при аускультации дыхание над легкими слева отсутствовало. На обзорной рентгенограмме органов грудной клетки определялось тотальное затемнение всей левой плевральной полости. Выполнено ее дренирование и налажена активная аспирация. Установлен зонд в культю желудка для питания. Пациент переведен в ФГБУ «ГВКГ им. Н.Н. Бурденко» 21.07.2020 в крайне тяжелом состоянии.
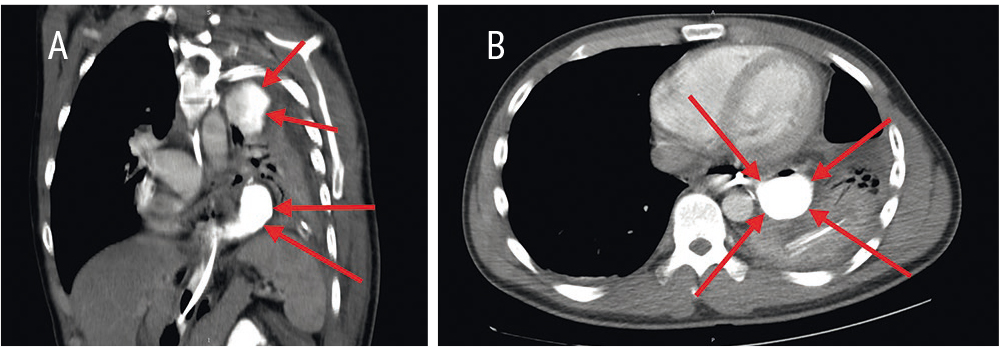
В тот же день пациенту выполнили КТ органов грудной клетки и брюшной полости, которая показала зонд в пищеводе, проведенный через зону анастомоза в культю желудка. В левой плевральной полости, интимно прилегая к зонду, визуализировался неправильно округлой формы затек контрастного вещества 50 мм × 45 мм, и прослеживалась его связь с зондом. По задней и латеральной поверхностям верхней доли левого легкого была отмечена группа патологических коллекторов, имевших формы от линзовидной до овоидной и максимальный размер до 90 мм × 45 мм, с контрастным содержимым и высокой вероятностью связи с нижним затеком. «Стенки» затеков были утолщены. Нижняя доля левого легкого на этом уровне коллабирована (рис. 1).
Рис. 1. А ― компьютерная томограмма грудной клетки во фронтальной проекции (стрелками указаны полости гнойных затеков); B ― компьютерная томограмма грудной клетки в поперечном сечении на уровне VIII–IX Th. Все иллюстрации в статье предоставлены коллективом эндоскопического отделения ФГБУ «ГВКГ им. Н.Н. Бурденко»
С диагностической и лечебной целью 22.07.2020 была выполнена торакоскопия в сочетании с эзофагоскопией. При торакоскопии в плевральной полости выявлено до 350 мл гнойного выпота с пищевыми массами. Произведена санация с разделением всех сращений между легким и париетальной плеврой. Плевра была контактно кровоточива и по всей поверхности покрыта плотным фибринозно-гнойным налетом.
Перфорационное отверстие удалось диагностировать только при выполнении эзофагогастроскопии и при выведении нитиноловой струны через зону несостоятельности в плевральную полость. На расстоянии 40 см от резцов была визуализирована зона эзофагогастроанастомоза: по его окружности определялись множественные лигатуры, плотные пленки фибрина, 3/4 окружности анастомоза занимал полностенный дефект стенки соустья с двумя раздельными полостями, покрытыми налетом фибрина, в просвете которых имелось значительное количество пищевых масс.
По результатам обследования установлен основной диагноз: рак (перстневидноклеточный) кардиоэзофагеального перехода II типа, по классификации Зиверта — Штейна (T1bG3C4L0V0N0M0). Операция от 07.07.2020 — комбинированная проксимальная субтотальная резекция желудка с резекцией нижнегрудного отдела пищевода с лимфодиссекцией D2.
Осложнения: субтотальная несостоятельность пищеводно-желудочного анастомоза. Эмпиема левой плевральной полости. Гнойный медиастинит. Сепсис.
По данному случаю был проведен консилиум, на котором обсуждалась тактика лечения. Учитывая тяжелое состояние пациента, распространенность гнойно-воспалительного процесса в плевральной и брюшной полостях, было принято решение проводить эндоскопическую ВАТ.
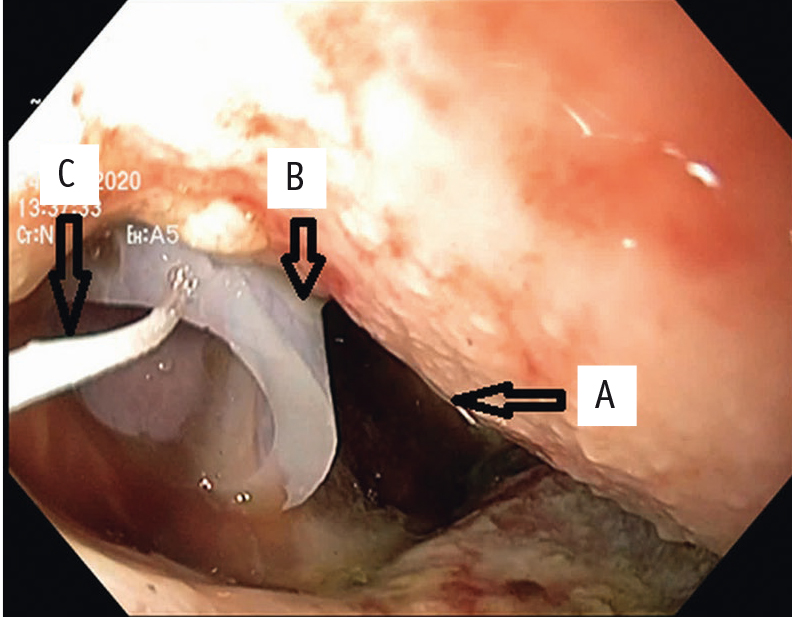
На начальном этапе лечения в тонкую кишку пациенту установили полимерный зонд для питания. На первых сеансах мы использовали методику установки системы для ВАТ по нити-проводнику, запатентованную в ФГБУ «ГВКГ им. Н.Н. Бурденко». Через наружный плевральный дренаж, установленный к полости затека, под эндоскопическим контролем были проведены биопсийные щипцы вместе с прочной синтетической метровой нитью (рис. 2).
Рис. 2. Эндофото. Полость затека с дренажной трубкой и проведенной через нее нитью-проводником.
Примечание: А ― полость затека, B ― дренажная трубка, C ― нить-проводник
Щипцы с нитью ввели в полость затека, где нить захватили с помощью эндоскопического зажима и вместе с эндоскопом вывели через рот наружу. На этой нити фиксировали вакуумно-аспирационную систему, состоящую из сформированной в соответствии с размерами полости полипропиленовой губки и термопластичного назогастрального зонда 12-14Fr (рис. 3). Затем подтягивали конец нити, установленной в дренажной трубке, и помещали губку в полость затека.
Рис. 3. Система для вакуумной аспирационной терапии

Правильность установки системы контролировали эндоскопически и рентгенологически. Далее дренажную трубку вакуумно-аспирационной системы выводили через носовой ход, фиксировали подшиванием к перегородке носа. К трубке подсоединяли вакуумный аспиратор в режиме разрежения 100–110 мм рт. ст. Губку заменяли через 3–5 суток.
В связи с наличием недренированной полости затека мы дополнительно использовали другую методику установки системы для аспирационной терапии. Применяли специальную шинирующую каркасную двухкомпонентную силиконовую трубку наружным диаметром 20 мм и длиной 50 см. Через наружный компонент трубки устройство для ВАТ низводили с помощью толкателя в полость затека (рис. 4).
Рис. 4. Эндофото. Шинирующая каркасная силиконовая трубка, введенная в полость затека

Затем с помощью эндоскопа контролировали расположение губки и при необходимости корректировали. Дренажную трубку вакуумно-аспирационной системы выводили через другой носовой ход, фиксировали и подключали к вакуумному аспиратору. Таким образом, пациенту производили санирующую вакуумно-аспирационную терапию одновременно из двух раздельно лежащих полостей.
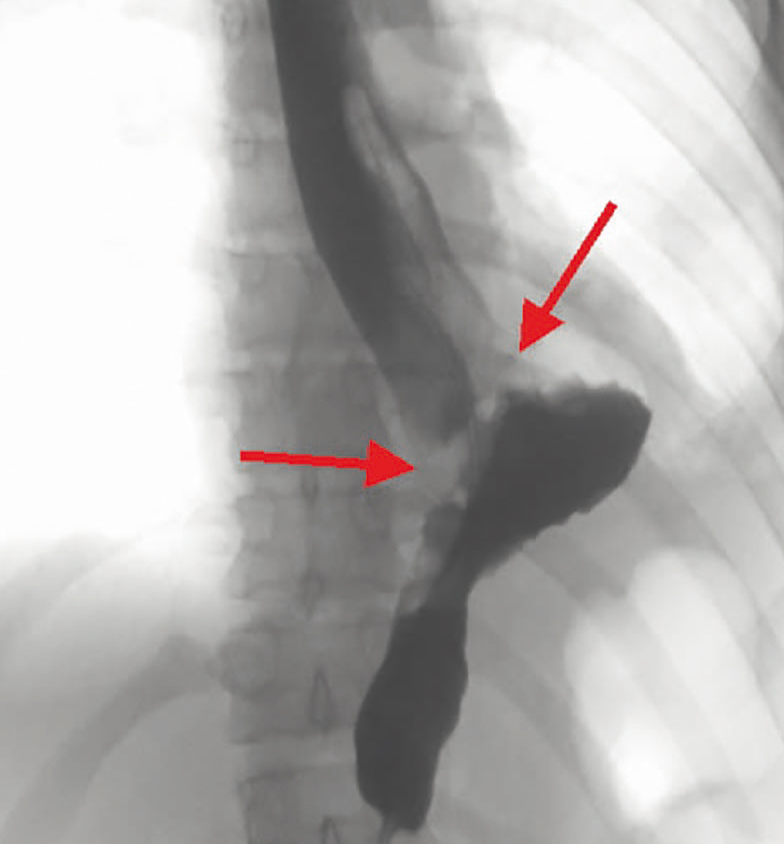
До полного восстановления герметичности анастомоза пациенту потребовалось 10 сеансов поочередной и последовательной переустановки вакуумно-аспирационной системы. На контрольной ЭГДС от 31.08.2020 после удаления аспирационной системы визуализировались вновь сформированные стенки соустья между пищеводом и желудком, ткани в данной зоне представлены нежными рубцами с грануляциями (рис. 5). На обзорной рентгеноскопии пищевода затеков контрастного вещества за пределы органа не определялось (рис. 6).
Рис. 5. Эндофото. Вновь сформированная линия соустья после курса лечения
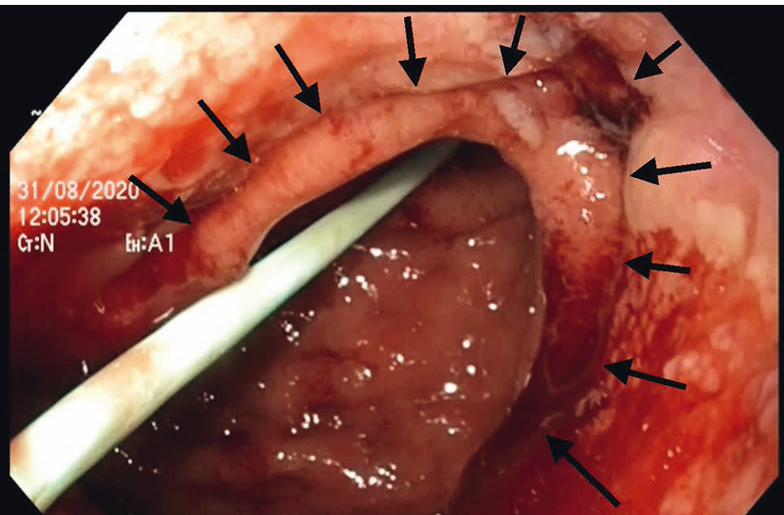
Рис. 6. Контрастная рентгенография пищевода после курса лечения
К моменту окончания лечения состояние пациента удовлетворительное. Питание самостоятельное по диете № 5. Лабораторные показатели в пределах референсных значений. Общее количество койко-дней — 45. Пациент переведен в реабилитационное отделение филиала госпиталя.
ОБСУЖДЕНИЕ
При выборе оптимального метода лечения пациента с субтотальной несостоятельностью швов эзофагогастроанастомоза учитывали несколько факторов, из которых основными являлись необходимость дренирования гнойно-септического очага в плевральной полости, полноценная нутритивная поддержка и главное — выбор метода восстановления целостности анастомоза.
Рассматривали несколько методов лечения данного патологического состояния[7, 12]. Рекомендованную хирургами тактику выключения анастомоза из пассажа пищи (формирование «питательной» еюностомы) в комбинации с установкой проточно-промывной системы сочли невозможной в связи с ее низкой эффективностью и высоким риском развития осложнений. Закрытие дефекта клипсами типа OVESCO или с помощью сшивающих устройств было невозможно ввиду большого размера дефекта, поздних сроков начала лечения и гнойно-септических осложнений. Использование клеевых композиций также сочли невозможным в связи с большой протяженностью линии НША. Эти же обстоятельства не позволяли применить методику установки покрытого саморасширяющегося металлического стента.
Опыт использования метода локальной вакуумной терапии в гнойной хирургии мягких тканей показал значимое уменьшение размеров полостей, сокращение отека окружающих тканей, возможность эффективного контроля отделяемого и удаления инфекционного компонента. Все это повышает регенераторные способности ткани, способствует повышению метаболической активности, увеличивает приток крови, что стимулирует формирование грануляционной ткани[9]. В связи с этим мы выбрали оптимальный в подобной ситуации метод лечения — эндоскопическую вакуумную терапию[8, 14–17].
В период с 2017 по 2020 годы в нашей клинике прошли лечение 14 пациентов с дефектами стенки полых органов. В связи с крайне низкой эффективностью и травматичностью мы не использовали ни в одном из случаев методику установки полипропиленовой губки параллельно эндоскопу. Для лечения большинства пациентов мы применяли оригинальную методику ВАТ, которая могла быть осуществлена при наличии наружного дренажа, установленного в полость затека. При его отсутствии и в случаях ранней диагностики несостоятельности анастомоза мы использовали методику введения аспирационной системы с помощью силиконовой двухкомпонентной шинирующей трубки, которая также показала высокую эффективность и низкую травматичность. Во всех случаях удалось достигнуть положительного результата, при котором отмечено полное восстановление целостности (полого) органа. Для этого потребовалось от 3 до 13 сеансов замены вакуумно-аспирационной системы и от 27 койко-дней до 81 койко-дня.
ЗАКЛЮЧЕНИЕ
Опыт выполнения ВАТ при лечении пациента с субтотальной несостоятельностью швов пищеводно-желудочного анастомоза показал высокую эффективность и безопасность данного метода. Комплексное лечение пациента в условиях отделения интенсивной терапии позволило полностью восстановить герметичность дискредитированного анастомоза полого органа и купировать гнойно-воспалительный процесс в плевральной полости и средостении. Результаты применения данного метода лечения позволили нам сформулировать следующие выводы:
- эндоскопическая ВАТ является эффективным, органосохраняющим, доступным и безопасным методом лечения, особенно при обширных и поздних несостоятельностях анастомозов;
- при наличии нескольких недренируемых гнойных полостей возможно одномоментно использовать две и более системы вакуумной терапии с различными методиками доставки;
- при отработанной методике доставки вакуумно-аспирационной системы сеанс ее замены занимает не более 20 минут;
- обязательным условием является решение вопроса о нутритивной поддержке и дренировании гнойно-септического очага;
- успех лечения пациентов с НША возможен только при тесном сотрудничестве с врачами смежных специальностей.
Благодарность: выражаем большую признательность за помощь в организации и осуществлении методики вакуумно-аспирационной терапии начальнику Главного военного клинического госпиталя имени академика Н.Н. Бурденко доктору медицинских наук, профессору, член-корреспонденту РАН, генерал-майору медицинской службы Крюкову Евгению Владимировичу.
Поступила: 16.02.2021
Принята к публикации: 14.04.2021








