В последние годы растет интерес ученых к эозинофильным заболеваниям ЖКТ. Это связано с увеличением распространенности атопических заболеваний и изучением методов влияния на их течение. Сейчас эксперты говорят о том, что статистические данные в 2,8–3,9 раза меньше истинной распространенности атопии в мире.
Аллергические заболевания — бич не только современного мира. Клинические проявления аллергических реакций на пищу описаны в истории медицины множеством самых именитых врачей. Известно, что в египетских летописях, датированных 2540 г. до нашей эры, найдено описание смерти фараона Менеса, который скончался от аллергического шока после укуса осы (пчелы). В работах гениального Гиппократа (V век до нашей эры) описаны кожные и желудочно-кишечные реакции на употребление некоторых продуктов, в частности молока.
Термин «аллергия» появился только в середине прошлого века. В основном акцент был сделан на группу IgE-зависимых состояний: атопический дерматит, поллиноз, бронхиальную астму, пищевую аллергию.
Согласно международным и российским рекомендациям, пищевая аллергия — это особая реакция на пищевые компоненты, которая опосредована иммунологическим механизмом. Важно отметить, что реакции могут быть не только специфически IgE-опосредованными, но и IgE-не опосредованными, то есть клеточно-опосредованными, и также смешанными (IgE и клеточно-опосредованными). По данным исследований, пищевая аллергия носит IgE-зависимый характер только в 30% случаев, что значительно затрудняет диагностику[1]1. В работах последних лет указано, что атопический марш (иначе известный как аллергический) относится к естественному развитию аллергических проявлений и начинается в уже в раннем возрасте[2]. По данным профессора Е.А. Корниенко и соавт., у трети детей с атопическими заболеваниями есть гастроинтестинальное поражение с той или иной степенью эозинофилии[3].
Ранее термин «атопия» ассоциировали с гиперчувствительностью, опосредованной специфической IgE-зависимой реакцией. Сейчас стало ясно, что в контексте марша IgE является патофизиологическим медиатором только некоторых, но не всех аллергических заболеваний. Атопический марш представляет собой стереотипное прогрессирование состояний, которые имеют общие генетические и экологические предрасполагающие факторы.
Эти состояния разделяют иммунологическую особенность воспалительной реакции, включающей развитие антиген-специфических Т-хелперов типа 2, образование специфичных для аллергена молекул IgE, активацию гранулоцитов и такие клинические признаки, как образование слизи и отек[2]. Классически атопический марш начинается с атопического дерматита и прогрессирует до IgE-опосредованной пищевой аллергии, астмы и/или аллергического ринита, эозинофильных поражений ЖКТ. По данным D.A. Hill и соавт., опубликованным в 2018 г., развитие эозинофильного эзофагита (ЭоЭ) является поздним проявлением атопического марша[4].
До сих пор требуют ответа несколько вопросов, касающихся терминологии, диагностики и лечения эозинофильных гастроинтестинальных заболеваний (ЭГИЗ) у детей.
1. Какое количество эозинофилов, обнаруженных в желудке и двенадцатиперстной кишке, достаточно для постановки диагноза ЭГИЗ — эозинофильных гастрита (ЭоГ) и энтерита (ЭоЭт)?
2. Какой код по МКБ-10 использовать?
3. Как лечить ЭГИЗ у ребенка раннего возраста?
В феврале 2022 г. в журнале Clinical Gastroenterology and Hepatology опубликованы Международные согласительные рекомендации по номенклатуре эозинофильных желудочно-кишечных заболеваний, в которых определены диагностические критерии для каждого отдела эозинофильного поражения ЖКТ. Принят термин «эозинофильные желудочно-кишечные заболевания» (eosinophilic gastrointestinal diseases)2.
В России в настоящее время нет общепринятого документа, однако термин «эозинофильные гастроинтестинальные заболевания» авторам кажется наиболее удобным в использовании. К группе ЭГИЗ относят ЭоЭ, ЭоГ, ЭоЭт и эозинофильный колит. Во избежание путаницы не рекомендовано использование термина «эозинофильный гастроэнтерит»3, при сочетанном поражении желудка и тонкой кишки целесообразно применять два термина: ЭоГ и ЭоЭт.
Наиболее хорошо изучен патогенез ЭоЭ, как у взрослых, так и у детей. В помощь практическому врачу разработаны и внедрены в практику в 2018 г. клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и терапии ЭоЭ. Однако эозинофильные поражения желудка, тонкой и толстой кишки до настоящего момента не имеют четко определенных морфологических критериев, что значительно затрудняет диагностику и выбор тактики терапии.
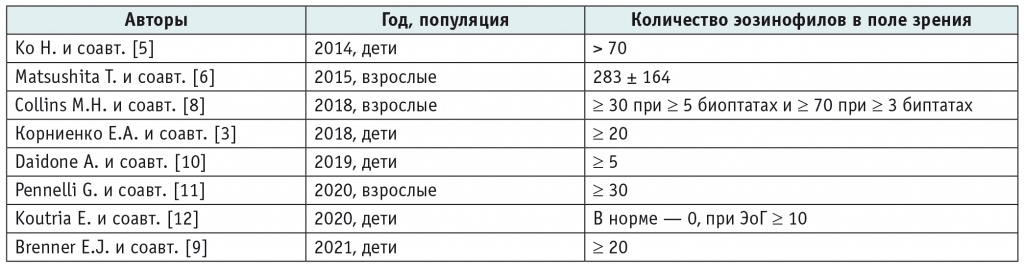
До настоящего времени нет регламентирующего документа, позволяющего с высокой точностью поставить диагноз эозинофильного поражения отделов ЖКТ ниже пищевода. В работе H. Ko и соавт. (2014) в качестве диагностического критерия для постановки диагноза ЭоГ принята инфильтрация слизистой желудка более 70 эозинофилов в поле зрения. Из всех обследованных детей (средний возраст — 7,5 года) у 30 отмечена яркая клиническая картина гастрита, у 50% из них было сочетанное эозинофильное поражение нескольких отделов ЖКТ. Авторы отметили сочетание ЭоГ и ЭоЭ у 43% детей, ЭоГ и ЭоЭт с выраженным синдромом мальабсорбции — у 21%[5].
В японском исследовании T. Matsushita и соавт. (2015) проведена оценка биоптатов антрального отдела желудка 15 взрослых пациентов с ЭоГ. Пиковое количество эозинофилов в антральном отделе желудка при ЭоГ составило 283 ± 164 эозинофила/×400 против 11 ± 9 эозинофилов/×400 у здоровых людей. Выявлена прямая корреляция с эозинофилией в периферической крови у пациентов с ЭоГ: чем тяжелее течение заболевания, тем уровень эозинофилии выше в периферической крови и тем выше плотность инфильтрации слизистой эозинофилами[6].
По данным J.M. Caldwell и соавт. (2014), периферическая эозинофилия выявляется не более чем у 30% пациентов с ЭГИЗ без атопии и у большинства с анамнезом атопии[7].
Во всех представленных работах число пациентов слишком незначительно для применения количественной оценки при постановке диагноза ЭоГ.
M.H. Collins и соавт. (2018) предложили другой подсчет эозинофилов в слизистой желудка, суммировав их количество в нескольких биоптатах. Критерии гистологической диагностики ЭоГ включают ≥ 30 эозинофилов в поле зрения при ≥ 5 биоптатах и ≥ 70 в поле зрения при ≥ 3 биоптатах. Общими признаками ЭоГ-биопсии авторы считают эозинофильные скопления в расширенной собственной пластинке, избыток интраэпителиальных эозинофилов, эозинофильный криптит/абсцесс и эозинофилы в мышечной слизистой оболочке и подслизистой оболочке[8].
Профессор Е.А. Корниенко и соавт. (2018) предложили считать диагностическим критерием ЭоГ инфильтрацию эозинофилами стенки желудка более 20 в поле зрения[3].
E.J. Brenner и соавт. (2021) инициировали анализ в педиатрической когорте с ЭГИЗ в связи с недостаточной информативностью визуальной оценки ЭГДС без данных морфологического исследования. Обследование 509 детей (средний возраст — 10,5 года) показало наличие тканевой эозинофилии ЖКТ в 7,7% случаев, а среди пациентов с периферической эозинофилией и гипоальбуминемией — до 9,1%. Тканевая эозинофилия учитывалась при интенсивности инфильтрации в желудке более 20 эозинофилов в поле зрения[9].
Однако в Italian Journal of Pediatrics в 2019 г. опубликован клинической случай заболевания младенца 4 месяцев с анемией и ЭоГ, когда за диагностический критерий эозинофильной инфильтрации стенки желудка приняли 5 эозинофилов в поле зрения[10].
В публикации G. Pennelli и соавт. 2020 г. представлены следующие диагностические критерии ЭоГ у взрослых: > 30 эозинофилов/поле высокой мощности (HPF) на микроскопах, оснащенных широкообъективными окулярами (FN 22), по крайней мере в 5 отдельных биоптатах при отсутствии известных сопутствующих причин эозинофилии (например, инфекции Helicobacter pylori, болезни Крона, паразитарных инфекций и гематологических или лимфоидных заболеваний)[11].
Одни из последних критериев оценки тканевой эозинофилии в ЖКТ опубликованы в журнале Annals of Gastroenterology в 2020 г. Исследование проведено в трех крупных стационарах в Афинах, Риме, Мадриде, в общей сложности оценены данные ЭГДС и морфологического обследования 111 детей (средний возраст — 10,5 года) с клиникой гастрита и 73 детей с функциональными гастроинтестинальными расстройствами (ФГИР). Морфологическая оценка проведена одним патологоанатомом во всех трех лечебных учреждениях. Полученные данные в группе контроля показали, что в здоровой слизистой желудка эозинофилы отсутствуют, у детей с ЭоГ критерий диагностики — более 10 эозинофилов в поле зрения[12].
Общие данные, представленные авторами описанных выше исследований, приведены в таблице 1.
Таблица 1
Диагностические критерии тканевой эозинофилии у пациентов с эозинофильным гастритом (ЭоГ), по данным исследований за последние 7 лет
КАКОЙ КОД ПО МЕЖДУНАРОДНОЙ КЛАССИФИКАЦИИ БОЛЕЗНЕЙ 10-ГО ПЕРЕСМОТРА ИСПОЛЬЗОВАТЬ?
В клинических рекомендациях по диагностике и терапии пищевой аллергии 2021 г. отдельного кода по эозинофильным поражениям ЖКТ (ЭГИЗ) нет. Предложено пользоваться кодом для других атопических дерматитов L20.8, для дерматита, вызванного съеденной пищей, — L27.2, L50.0 для аллергической крапивницы и К52.2 для аллергического и алиментарного гастроэнтерита и колита. Возможно также использование кода T78.1 — Другие проявления патологической реакции на пищу. В дальнейшем в новой редакции МКБ-11 для ЭоГ предусмотрен код DA42.2.
В последнем согласительном документе 2022 г. рекомендовано использовать коды МКБ-10 для ЭоГ или гастроэнтерита (K52.81) и эозинофильного колита (K52.82)4.
КАК ЛЕЧИТЬ ЭОЗИНОФИЛЬНЫЕ ГАСТРОИНТЕСТИНАЛЬНЫЕ ЗАБОЛЕВАНИЯ У РЕБЕНКА РАННЕГО ВОЗРАСТА?
Стандартных рекомендаций по терапии эозинофильных поражений ЖКТ ниже пищевода нет. Сейчас рассматриваются варианты диетической коррекции, возможности использования ингибиторов протонной помпы и топических стероидов.
Элиминационная диета у детей раннего возраста, находящихся на искусственном вскармливании, включает замену стандартной смеси или полуэлементной смеси на формулы с глубоким гидролизом казеинового белка или аминокислотные. По данным некоторых авторов, даже разные варианты элиминационных диет дают значительный положительный эффект[13, 14]. Чем младше ребенок, тем более эффективна элиминационная диета, по некоторым сведениям, примерно у 40–82% пациентов она оказывается эффективной и без применения лекарственной терапии[15, 16].
Все эксперты сходятся во мнении, что элиминационная диета является терапией первой линии[17, 18]. Наиболее эффективны смеси на основе аминокислот (Неокейт LCP у детей до 1 года, Нутрилон аминокислоты Syneo, Неокейт Джуниор для детей старше года).
Согласно A.J. Lucendo и соавт., положительный клинический эффект от диетотерапии отмечается у 75% пациентов с ЭоГ и ЭоЭ, но низкая приверженность ограничивает ее использование, особенно у подростков[19].
Вторая линия терапии — это применение кортикостероидов. Кортикостероиды являются основой лечения, если диета неэффективна или нецелесообразна, а также в случае тяжелого или осложненного эозинофильного гастроэнтерита и колита[13, 20]. Стероиды способны ингибировать эозинофильные факторы роста, такие как ИЛ-3, ИЛ-5 и GM-CSF[21]. В большинстве исследований отмечалась клиническая ремиссия у 50–90% пациентов с ЭГИЗ, получавших кортикостероиды[16, 21]. Отсутствие первоначального ответа должно привести к переоценке причинно-значимых факторов и диагноза[22].
При постановке диагноза рекомендуемая доза перорального преднизолона для взрослых — 20–40 мг/сут[14] или более высокие дозы из расчета 0,5–1 мг/кг в сутки в течение 2 недель[18]. В течение последующих 6–8 недель дозу снижают в случае достижения клинического эффекта до полной отмены[23]. Однако применение системных кортикостероидов имеет ограничения, примерно у 20% пациентов с ЭГИЗ развивается зависимость[16].
Альтернативой системным кортикостероидам являются топические стероиды, например будесонид. Будесонид — это синтетический стероид с высокой местной глюкокортикоидной активностью и низкой системной биодоступностью, что минимизирует системные побочные эффекты[24, 25]. Для взрослых рекомендуемая доза — 9 мг/сут, затем ее можно снизить до 6 мг/сут и наконец до 3 мг/сут для поддерживающей терапии[13, 18]. На сегодня недостаточно исследований проведено как у взрослых, так и у детей, однако пока это один из самых эффективных препаратов в терапии ЭГИЗ.
В некоторых исследованиях сообщалось об использовании ингибиторов тучных клеток и антагонистов лейкотриеновых рецепторов, например кромогликата натрия и кетотифена[13, 18]. У взрослых больных с ЭГИЗ, в частности с ЭоГ и ЭоЭт, кромогликат натрия давал положительный эффект в качестве монотерапии и еще больший — в комбинации со стероидами[26]. Рекомендуемая пероральная доза варьирует от 100 до 300 мг на прием 4 раза в день для взрослых пациентов[24].
Собственные данные показали больший клинический и морфологический эффект при использовании будесонида, чем у препаратов на основе кромогликата натрия. Единичные положительные эффекты при применении кетотифена (ингибитора тучных клеток с антигистаминным действием) в дозе 2–4 мг/сут в комплексе с диетой включали облегчение симптомов, уменьшение количества эозинофилов в стенке ЖКТ и снижение уровня общего IgE[24].
Эффективность монтелукаста неоспорима в терапии бронхиальной астмы. Являясь селективным ингибитором лейкотриенов (LTD4), он блокирует вызванную лейкотриенами проницаемость сосудов, сокращение гладкой мускулатуры и хемотаксис эозинофилов и базофилов[27]. Однако эффективность монтелукаста при ЭГИЗ остается спорной. В некоторых исследованиях сообщалось, что использование монтелукаста в дозе 5–10 мг/сут у взрослых и у детей со стероидорезистентной формой и рецидивирующим течением ЭоГ, ЭоЭт вызывает клиническое улучшение[28, 29]. Однако в последующих работах у пациентов с ЭоГ и ЭоЭт данные о положительном эффекте от приема монтелукаста отсутствуют[30].
В доказательство изложенного приводим описание клинического случая.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Родители обратились в приемное отделение ГБУЗ «ДГКБ им. З.А. Башляевой ДЗМ» (главный врач — д. м. н., профессор И.М. Османов, лечащий врач — Л.В. Гончарова) с жалобами на потерю сознания у девочки 3 месяцев, вялость, сниженный аппетит вплоть до отказа от еды.
Из анамнеза известно, что ребенок рожден молодой здоровой женщиной, у матери 4-я беременность, протекавшая с угрозой прерывания на 36 неделе, новая коронавирусная инфекция (легкое течение) на 38 неделе, 2-е срочные самопроизвольные роды на 40 неделе в головном предлежании плода. Масса тела ребенка при рождении — 3470 г, длина тела — 51 см. Антропометрические показатели соответствовали сроку гестации. Оценка по шкале Апгар — 8/8 баллов. С рождения находилась на искусственном вскармливании адаптированной молочной смесью для детей первого полугодия жизни на основе коровьего молока.
Особенности клинических проявлений по месяцам жизни представлены в таблице 2.
Таблица 2
Особенности клинических проявлений и прибавки массы по месяцам
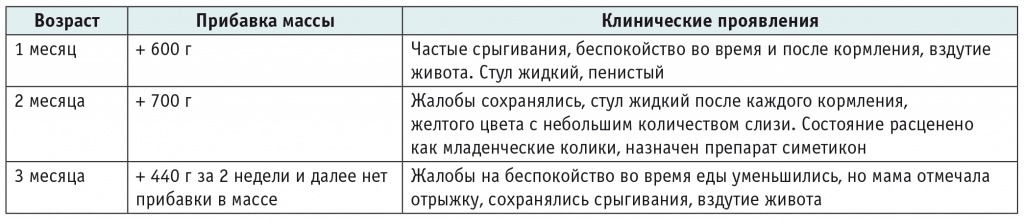
С 2,5 месяцев у девочки объем кормлений уменьшился с 80–100 до 50–60 мл на одно кормление. Она быстро утомлялась во время еды, вяло сосала, цокала языком. За 2 дня до обращения в больницу после прогулки ребенок обмяк, побледнел, длительность приступа составила около 15–20 минут. Подобные эпизоды длительностью по 2–5 минут повторялись дважды во время кормления.
При поступлении ребенок осмотрен кардиологом, по результатам ЭКГ и ЭхоКГ патологические изменения не выявлены. С учетом основных жалоб, связанных с нарушением сознания, ребенок обследован нейрохирургом, данные за травму и нарушение мозгового кровообращения не получены (МРТ, КТ). Проведена консультация невролога, по результатам 6-часовой ЭЭГ патологическая очаговая и эпилептическая активность не обнаружена. Нервно-психическое развитие в норме.
Во время кормления отмечали отказ от еды после первого глотка, беспокойство, плач. Через 10–30 минут — вздутие живота, регургитация, руминация.
Проведено обследование: в клиническом анализе крови выявлены умеренные тромбоцитоз и эозинофилия до 0,714 × 109/л, остальные показатели в пределах возрастной нормы (табл. 3). Эозинофилия в периферической крови у детей с гастроинтестинальными поражениями выявляется не более чем в 30% случаев. В данном случае повышение уровня эозинофилов стало настораживающим фактором, который позволил заподозрить пищевую сенсибилизацию.
Таблица 3
Клинический анализ крови от 20.08.2020 г.

Состояние расценено как сенсибилизация к белкам коровьего молока (пищевая аллергия, гастроинтестинальная форма) (табл. 4).
Таблица 4
Данные обследований

Требовалось оценить полученные результаты и принять решение о необходимости эндоскопического обследования.
Как известно, клинические проявления пищевой аллергии и эозинофильного поражения ЖКТ неспецифичны.
Первые клинические проявления у данного ребенка были расценены как ФГИР: срыгивания, младенческие колики. Однако семейный аллергологический анамнез (у отца поллиноз, у матери в раннем возрасте атопический дерматит) предполагал риск развития атопии у девочки на фоне искусственного вскармливания. Второй момент — это недостаточная прибавка в массе каждый месяц с полным отсутствием прибавки в последние 2 недели и нарастание симптомов ФГИР. Использование при искусственном вскармливании стандартной молочной формулы привело к сенсибилизации к белкам коровьего молока у ребенка с высоким риском атопического марша.
В данном случае применена модифицированная ультразвуковая методика (разработана заведующим кафедрой лучевой диагностики, профессором Пыковым М.И.): оценка структуры и объема желудка, измерение толщины слизистого слоя и стенки желудка и нижнего пищеводного сфинктера. Функциональная проба оценивалась с водной пробой и молочным продуктом (в частности, с молочной стандартной формулой, которую ребенок получал ранее).
Данная методика сейчас еще не стандартизирована, но в связи с отсутствием четких достоверных критериев диагностики гастроинтестинальных проявлений атопии, особенно у детей раннего возраста, используется с большим успехом в нашей клинике. Подан патент на изобретение, после получения которого методические рекомендации будут опубликованы.
По данным ультразвукового обследования желудка с функциональной пробой (водно-сифонной), после приема 20 мл воды отмечены единичные гастроэзофагеальные рефлюксы, после приема 20 мл смеси — резкое беспокойство ребенка, множественные гастроэзофагеальные рефлюксы и нарастание отека слизистой желудка в антральном отделе. Полученные данные позволили предположить гастроинтестинльную форму пищевой аллергии к белкам коровьего молока.
Однако все проведенные обследования не дали возможности судить о топике поражения. Необходимо исключить эозинофильное поражение пищевода, желудка, двенадцатиперстной и тонкой кишки. В качестве диагностического теста ребенок переведен на вскармливание смесью на основе глубокого гидролиза казеинового белка коровьего молока, что значительно уменьшило клинические проявления ФГИР. Это подтвердило диагноз гастроинтестинальной формы пищевой аллергии.
У девочки проведена ЭГДС с биопсией из всех осмотренных отделов для исключения эозинофильного поражения ЖКТ. При визуальном осмотре слизистая розовая, без воспалительных изменений и эрозий. Морфологическая оценка биоптатов с подсчетом количества эозинофилов произведена на базе ГБУЗ «ДГКБ им З.А. Башляевой ДЗМ» (врач-морфолог — Епифанова Е.И.). В слизистой пищевода воспалительных изменений не было, количество эознофилов не превышало 2–3 в поле зрения. В слизистой желудка количество эозинофилов — от 3 до 20 в поле зрения, в слизистой двенадцатиперстной кишки — до 17 в поле зрения.
С учетом описанных клинических проявлений, количества эозинофилов в периферической крови, увеличенного уровня общего IgE, тканевой инфильтрации до 20 эозинофилов в поле зрения можно предположить ЭоГ у ребенка в представленном клиническом случае. Нами использован код К52.2 — Аллергический и алиментарный гастроэнтерит и колит.
ЗАКЛЮЧЕНИЕ
В настоящее время нет четких морфологических критериев диагностики эозинофильных поражений желудка, тонкой и толстой кишки у детей, а клинические проявления пищевой аллергии и эозинофильного поражения ЖКТ, особенно у детей раннего возраста, неспецифичны.
При постановке диагноза эозинофильного гастрита у детей необходимо учитывать семейный аллергологический анамнез, совокупность данных лабораторной диагностики (эозинофилию в клиническом анализе крови и высокий уровень общего IgE) и результаты морфологического исследования биоптата слизистой оболочки желудка.
Поступила: 31.10.2022
Принята к публикации: 14.11.2022
________
1 Federal Bureau of Prisons Clinical Guidance. Management of food allergies. November 2017. URL: http://www.bop.gov/resources/health_care_mngmt.jsp (дата обращения — 11.09.2022).
2 Dellon E.S., Gonsalves N., Abonia J.P., Rothenberg M.E. et al. International Consensus Recommendations for eosinophilic gastrointestinal disease nomenclature. Clin. Gastroenterol. Hepatol. 2022; 20(11): 2474–84.E3. DOI: https://doi.org/10.1016/j.cgh.2022.02.017
3 Там же.
4 Dellon E.S., Gonsalves N., Abonia J.P., Rothenberg M.E. et al. International Consensus Recommendations for eosinophilic gastrointestinal disease nomenclature...








