ВВЕДЕНИЕ
Лекарственное поражение печени (ЛПП) представляет собой наиболее сложную проблему клинической медицины в связи с достаточно высокой распространенностью, неоднородностью клинических проявлений и отсутствием четких прогностических критериев риска их развития. Существует несколько полноценных национальных регистров ЛПП, однако основным источником информации о неблагоприятных реакциях на лекарства служит глобальная база данных VigiBase, созданная ВОЗ. Она содержит 13 208 000 отчетов (по состоянию на 2016 г.) и выделяет поражения печени как наиболее важную проблему1.
Беременность относится к факторам риска ЛПП в силу ряда физиологических изменений, которые могут оказывать влияние на метаболизм лекарственных препаратов [1]. Ключевую роль в этом процессе играют гипоальбуминемия и изменение уровня стероидных гормонов, повышение pH желудочного сока, замедление перистальтики кишечника, рост скорости клубочковой фильтрации [2, 3]. Снижение уровня альбумина плазмы крови при беременности способно приводить к нарушению связывания и выведения лекарств [1, 4].
Синтетические стероидные гормоны как индукторы лекарственного метаболизма могут усугублять гепатотоксичность большинства лекарственных средств [5]. Этот факт необходимо учитывать при оценке риска ЛПП у беременных, получающих гестагены и эстрогены. Высокая липофильность последних позволяет отнести их к группе лекарственных препаратов с потенциально высоким риском негативного влияния на печень [6-9]. В последние годы в научной литературе обсуждается риск нарушения функции печени у беременных после применения ВРТ, приема гормональных препаратов на этапе планирования и в течение беременности для профилактики невынашивания [10, 11]. Согласно данным U. Kopylov и соавт., частота нарушения функции печени после применения ВРТ выше в 6,5 раза, чем при естественно наступившей беременности [11].
Несмотря на активное изучение данной проблемы, факторы риска ЛПП и меры по его профилактике, взаимосвязь ЛПП и акушерских осложнений в вышеупомянутых группах беременных до сих пор являются предметом серьезной дискуссии [12, 13]. По мнению E. Mei-Dan и соавт., индуцированное лекарственными препаратами нарушение функции печени в первой половине беременности может быть сопряжено с высокой частотой невынашивания, развития плацетарной недостаточности и перинатальных осложнений [13].
В настоящее время не изучены предикторы тяжелого течения ЛПП и типы ЛПП, не определены основные препараты и их сочетания, вызывающие повреждение печени в I триместре беременности.
Цель настоящего исследования — выявить факторы риска ЛПП в I триместре беременности.
МАТЕРИАЛЫ И МЕТОДЫ
На базе ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта» и ФГБОУ ВО «Санкт-Петербургский государственный университет» обследованы 113 беременных женщин в I триместре, которые были рандомизированы на три группы. Основная группа включала 81 пациентку (средний возраст — 31,4 ± 4,7 года) с наличием клинико-анамнестических и биохимических проявлений ЛПП, группа сравнения — 20 беременных (средний возраст — 31,2 ± 3,7 года), принимавших гормональные препараты для профилактики или лечения невынашивания беременности в I триместре, с отсутствием изменений уровня печеночных аминотрансфераз. Контрольную группу составили 12 практически здоровых женщин (средний возраст — 30,8 ± 3,6 года), не получавших гормональные препараты в I триместре беременности.
У пациенток было получено добровольное информированное согласие на участие в исследовании.
Критерии включения в основную группу: возраст от 18 до 40 лет, беременность сроком до 12 недель, гормональная терапия на этапе планирования и/или во время беременности, повышение активности печеночных аминотрансфераз более чем в 2 раза относительно верхнего предела нормы.
Критерии включения в группу сравнения: возраст от 18 до 40 лет, беременность сроком до 12 недель, гормональная терапия на этапе планирования и/или во время беременности, активность печеночных аминотрансфераз в пределах референтных значений.
Критерии включения в группу контроля: возраст от 18 до 40 лет, беременность сроком до 12 недель, гормональная терапия на этапе планирования и/или во время беременности не проводилась, активность печеночных аминотрансфераз в пределах референтных значений.
Критерии исключения из всех групп: положительные результаты тестов на наличие вирусных гепатитов, задокументированные хронические заболевания печени и билиарного тракта (желчнокаменная болезнь, аутоиммунные и первично-холестатические заболевания печени, болезни накопления), СД, ранний токсикоз, избыток массы тела или ожирение, наследственная тромбофилия (высокий риск), антифосфолипидный синдром.
Для постановки диагноза ЛПП и оценки функционального состояния печени при беременности у всех женщин проводили сбор анамнеза с учетом экстрагенитальных патологий, физикальное обследование, клинико-биохимическое и инструментальное исследование. Затем сравнивали особенности течения беременности и исходы во всех трех группах.
Для определения вероятности взаимосвязи поражения печени и приема гормональных препаратов использовали метод оценки причинно-следственной связи, разработанный компанией Roussel Uclaf (Roussel Uclaf Causality Assessment Method, RUCAM). Последние обновления RUCAM опубликованы в 2016 г. [14]. Расчет вероятности по RUCAM проводился отдельно для каждого препарата, который мог вызвать гепатотоксическую реакцию.
Полученные результаты обрабатывали с использованием методов параметрической и непараметрической статистики. Межгрупповые различия значений признаков, имеющих непрерывное распределение, оценивали с применением t-критерия Стьюдента и рангового U-критерия Манна — Уитни, при сравнении частотных величин использовали χ2 (критерий Пирсона) с поправкой Йетса и точный метод Фишера, при сравнении парных (сопряженных) выборок — парный Ud-критерий (Вилкоксона). Анализ зависимости между признаками проводили с помощью rs-критерия Спирмена. Критический уровень вероятности нулевой гипотезы (об отсутствии различий или факторных влияний) принимали равным 0,05. Однофакторный дисперсионный анализ (Analysis of Variance, ANOVA) был выполнен для определения значимости различий средних значений. Для проверки нулевой гипотезы использовался апостериорный анализ (post-hoc analysis) — тест Тьюки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнительный анализ акушерско-гинекологического анамнеза, представленного в таблице 1, показал, что основную группу и группу сравнения составили преимущественно повторно беременные женщины.
Таблица 1
Данные акушерско-гинекологического анамнеза, n (%)
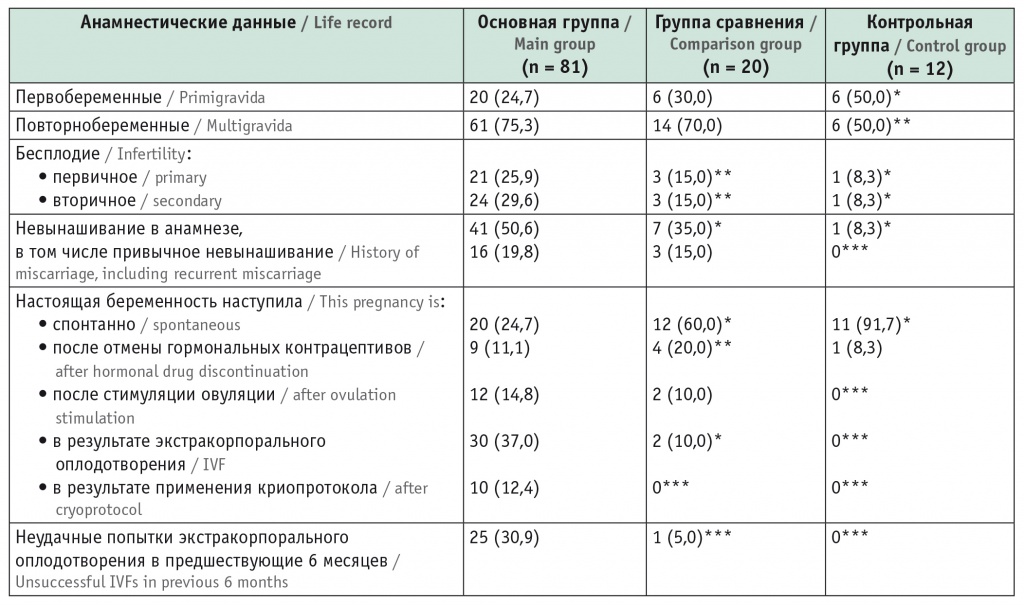
Примечание. Отличия от основной группы статистически значимы: (*) — p < 0,01; (**) — p < 0,05; (***) — p < 0,001.
Установлено, что ЛПП возникло более чем у половины беременных с ранее диагностированным бесплодием. В группе сравнения бесплодие в анамнезе было только у 30% обследованных, а в контрольной группе — у 16,6%, т. е. встречалось в 1,8 и 3,3 раза реже. Значительные различия выявлены и в частоте невынашивания беременности. Самопроизвольное прерывание беременности на сроке до 22 недель произошло у 50,6% пациенток с ЛПП, при этом привычное невынашивание отмечалось почти у каждой пятой женщины.
Важным фактором риска развития ЛПП в I триместре беременности оказалось применение ВРТ. В основной группе у половины женщин беременность наступила после ЭКО и применения криопротокола, у 14,8% — после стимуляции овуляции (кломифена цитратом и гонадотропинами), 11,1% женщин получали гормональные препараты на этапе планирования беременности. В группе сравнения анализируемые показатели статистически значимо отличались.
Анализ исходов предшествующих беременностей показал, что преэклампсия наблюдалась почти с одинаковой частотой в основной группе и группе сравнения (21,5% и 21,4% соответственно) и поэтому не рассматривалась нами как фактор риска ЛПП.
Хронический эндометрит и аднексит в основной группе встречались более чем в 2 раза чаще, чем в группе сравнения, а наружный генитальный эндометриоз — в 3,5 раза чаще (табл. 2). Таким образом, наличие этих гинекологических заболеваний было расценено нами как фактор увеличения фармакологической нагрузки в прегравидарный период и, соответственно, повышения риска ЛПП.
Таблица 2
Частота гинекологических заболеваний, n (%)
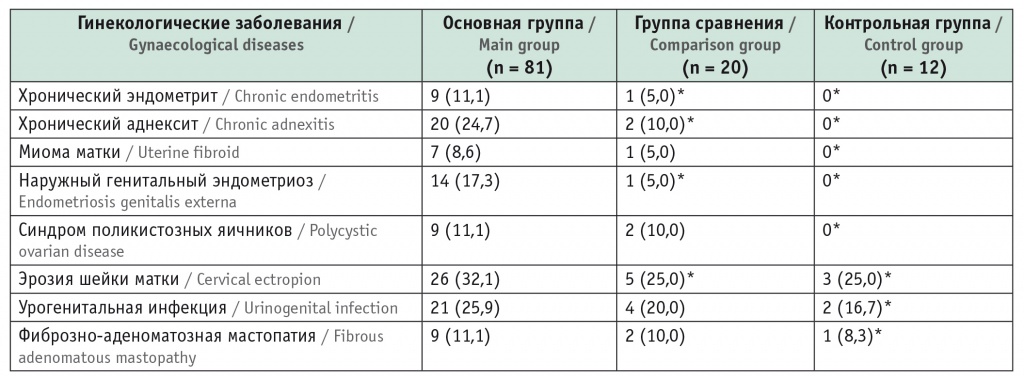
* Отличия от основной группы статистически значимы (p < 0,05).
Беременные с наличием СД, ожирения, хронических заболеваний печени и желчного пузыря, в том числе желчнокаменной болезни, не включались в исследование, поскольку данные заболевания сами по себе являются факторами риска поражения печени и могут исказить результаты поиска других факторов риска. Среди других соматических заболеваний мы не выделили ни одного в качестве фактора риска ЛПП в I триместре беременности. Так, заболевания верхних отделов ЖКТ имелись у 26,8%, 20,0% и 8,3% женщин основной группы, группы сравнения и контрольной группы соответственно, патология сердечно-сосудистой системы — у 31,3%, 25,0% и 8,3%, заболевания почек и мочевых путей — у 22,3%, 20,0% и 8,3%. Мы обратили внимание на то, что у 25,4% беременных с развившимся в I триместре ЛПП были диагностированы заболевания щитовидной железы: у 22,3% — аутоиммунный тиреоидит, у 2,9% — диффузный нетоксический зоб. В группе сравнения патология щитовидной железы регистрировалась в 1,7 раза реже (15%), а в контрольной группе — только в 8,3% случаев. Эти результаты диктуют необходимость более углубленного изучения взаимосвязи патологии щитовидной железы и ЛПП в I триместре беременности. По результатам нашего исследования судить об этом мы посчитали преждевременным.
Прекрасно понимая возможность отсроченного ЛПП, мы оценили фармакологическую нагрузку на этапе планирования беременности и при ее наступлении (табл. 3).
Таблица 3
Частота применения лекарственных препаратов на этапе планирования беременности и в I триместре, %
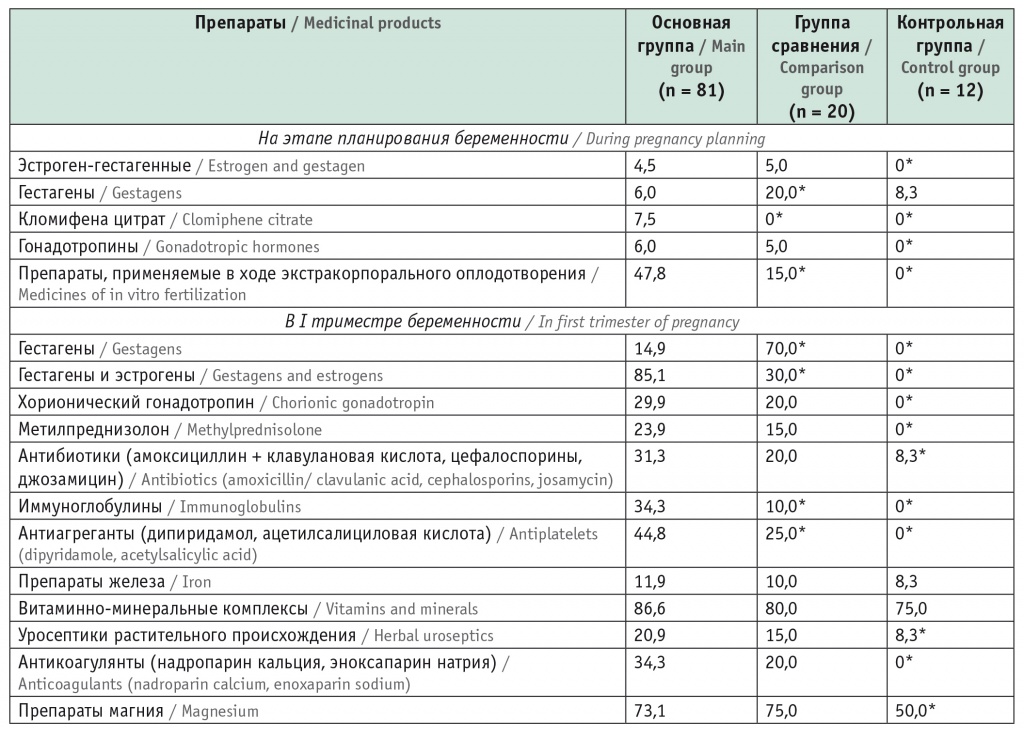
* Отличия от основной группы статистически значимы (p < 0,05).
На этапе планирования беременности 71,8% женщин основной группы получали гормональные препараты, у 49,4% настоящая беременность наступила после ЭКО и использования криопротокола. Однако влияние отдельных групп гормональных препаратов, применяемых в протоколах ЭКО, не оценивали ввиду их разнообразия и большого объема назначаемых лекарственных средств. Характерной особенностью фармакотерапии в I триместре беременности было продолжение приема гормональных препаратов (с целью профилактики и лечения невынашивания беременности) в сочетании с антибактериальными препаратами и иммуноглобулинами (в 31,3% и 34,3% случаях соответственно). В основной группе, кроме гормональных препаратов, женщины получали в среднем 7,7 ± 0,2 наименования лекарств, в группе сравнения — 3,8 ± 0,3 наименования.
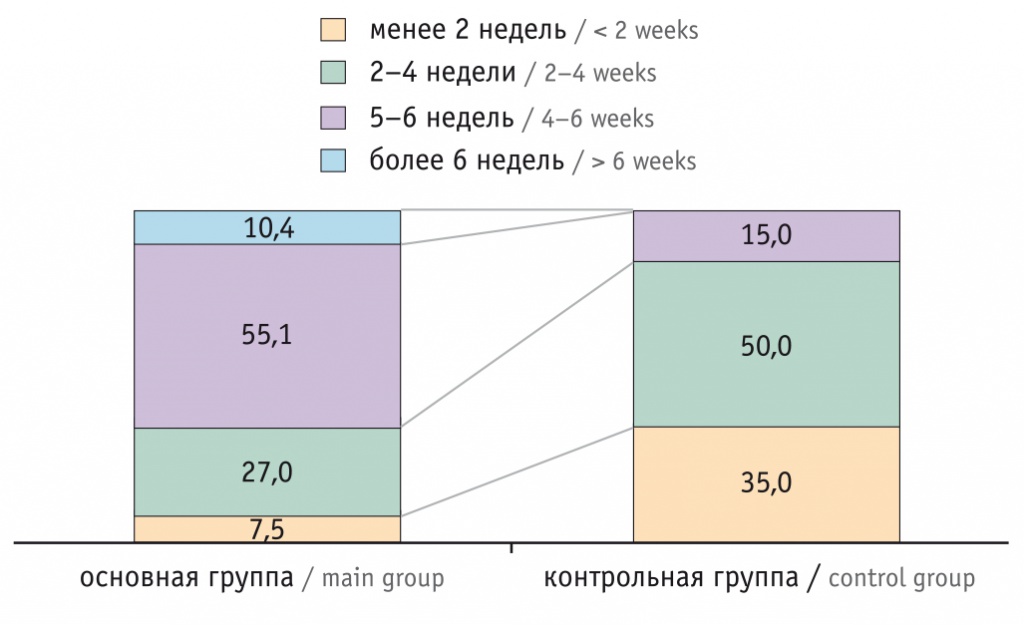
Вероятность ЛПП в I триместре беременности оценивалась с учетом длительности применения гестагенов и эстрогенов. Гормональная терапия проводилась более
длительно — в течение 35 ± 1,7 дня (рис.) у беременных основной группы, причем, как правило, в дозах, превышающих средние рекомендованные в инструкции, после согласования с врачебной комиссией. В группе сравнения данный показатель составил 15,8 ± 0,8 дня (см. рис.). Обнаруженные статистически значимые различия между группами позволили нам выделить в качестве фактора риска ЛПП длительность применения вышеперечисленных препаратов, превышающую 4 недели.
Рис. Длительность применения гормональной терапии в основной группе и группе сравнения
Однофакторный дисперсионный анализ выявил влияние различных лекарственных препаратов, их комбинаций и длительности их применения на возникновение ЛПП в I триместре беременности.
В нашем исследовании ЛПП характеризовались отсутствием симптомов или незначительной субъективной симптоматикой. Жалобы были неспецифичными, их предъявляли лишь 10,5% беременных. У 9% женщин имелся синдром гиперстимуляции яичников легкой или средней степени тяжести: чувство тяжести, вздутие и боли внизу живота, тошнота, рвота до 5 раз в сутки, головокружение, слабость. Описанные симптомы сочетались с увеличением объема яичников по данным УЗИ. У большинства (73%) беременных основной группы наблюдалось легкое течение заболевания с повышением активности аминотрансфераз в 2–8 раз по сравнению с верхним пределом нормы. Течение ЛПП средней тяжести имело место у 24% беременных и сопровождалось повышением уровня общего билирубина в 2 раза в сравнении с верхним пределом нормы (9%). В 2 случаях ЛПП было классифицировано как тяжелое.
Холестатический тип ЛПП, выявленный у 9% беременных, характеризовался более выраженными клиническими симптомами: кожным зудом и желтухой, которые сохранялись достаточно долго. У 5% беременных с печеночным цитолизом были обнаружены гемангиомы печени по данным УЗИ, что соответствовало сосудистому типу ЛПП.
Методы лечения ЛПП в I триместре беременности были нами описаны ранее [15]. Влияние ЛПП в I триместре беременности на дальнейшее ее течение и исходы будет предметом следующего исследования.
ЗАКЛЮЧЕНИЕ
Факторами риска лекарственного поражения печени (ЛПП) в I триместре беременности являются гормональная терапия на этапе планирования беременности и в I триместре, наступление беременности после стимуляции овуляции и применения протоколов ЭКО, длительный прием (более 4 недель) эстрогенных и гестагенных препаратов, полипрагмазия. Не выявлена взаимосвязь между соматическими заболеваниями и риском ЛПП. Преимущественно развивался гепатоцеллюлярный тип повреждения печени; в 9% случаев — холестатический, в 5% — сосудистый.
________________
1 World Health Organization (WHO). The Use of the WHO-UMC System for Standardised Case Causality Assessment. WHO Collaborating Centre for International Drug Monitoring (Uppsala Monitoring Centre, UMC), Database 2000. URL: https://www.who-umc.org/media/2768/standardised-case-causality-assessment.pdf
Поступила: 24.12.2019
Принята к публикации: 25.02.2020








