Онкологические заболевания являются глобальной проблемой здравоохранения. В 2018 г. зафиксированы 18 млн новых случаев рака различной локализации, которые привели к 10 млн смертельных исходов [1]. У пациентов старше 65 лет в 2012 г. отмечены 6,7 млн новых случаев новообразований, а в 2035 г. ожидается 14 млн новых случаев рака [2].
Рак желудка занимает третье место среди причин онкологической смертности [3]. Наиболее эффективные методы его профилактики — диагностика и лечение предраковых изменений в желудке [4]. В связи с этим в последние годы появился целый ряд международных консенсусов по ведению пациентов с атрофическим гастритом и метаплазией, среди которых следует выделить Киотский консенсус [5], Маастрихт V [6], Management of epithelial precancerous conditions and lesions in the stomach II (MAPS II) [7], рекомендации Британской гастроэнтерологической ассоциации [8] и современные обзоры по ведению пациентов с метаплазией желудка в США [9, 10]. Следует также отметить традиционно высокую активность японских исследователей [11].
Целесообразно проведение аналитических обзоров, позволяющих ориентироваться в большом количестве новых разработок.
ЗАБОЛЕВАЕМОСТЬ РАКОМ ЖЕЛУДКА
В последние годы появились новые данные, которые указывают на умеренный рост заболеваемости раком желудка в США у жителей младше 50 лет. В одной из работ были проанализированы результаты американского регистра, охватывавшего 13 000 случаев некардиального рака желудка. Показано, что частота патологи возрастает у белых людей неиспанского происхождения младше 50 лет [12].
В другом большом исследовании, рассмотревшем статистику из 50 штатов США с 1999 по 2013 г., эти выводы подтверждаются [13]. Положение о росте заболеваемости некардиальным раком в молодых популяциях отстаивается еще в одной работе из США, опубликованной в 2020 г. [2].
Авторы современного европейского клинического обзора полагают, что изменение заболеваемости раком желудка является установленным фактом [14].
Увеличение распространенности рака желудка в молодых популяциях сопровождается аналогичной динамикой предраковых изменений в желудке. В Швеции 5284 человека наблюдались в течение 20 лет. Авторы зафиксировали увеличение частоты атрофического гастрита у пациентов в возрасте от 35 до 44 лет [15]. Естественно, что рост заболеваемости некардиальным раком желудка обусловливает пересмотр взглядов на структуру факторов риска, в которой возрастает доля неинфекционных причин [12].
Одной из интересных особенностей являются резкие географические и этнические различия заболеваемости раком желудка. Самая высокая распространенность этой патологии наблюдается в Восточной Азии, где она достигает 30 случаев на 100 000 населения, самые низкие показатели фиксируются у жителей Северной Америки и Африки (рис.) [1].
Рис. Заболеваемость раком желудка в различных регионах мира в 2018 г. [1]
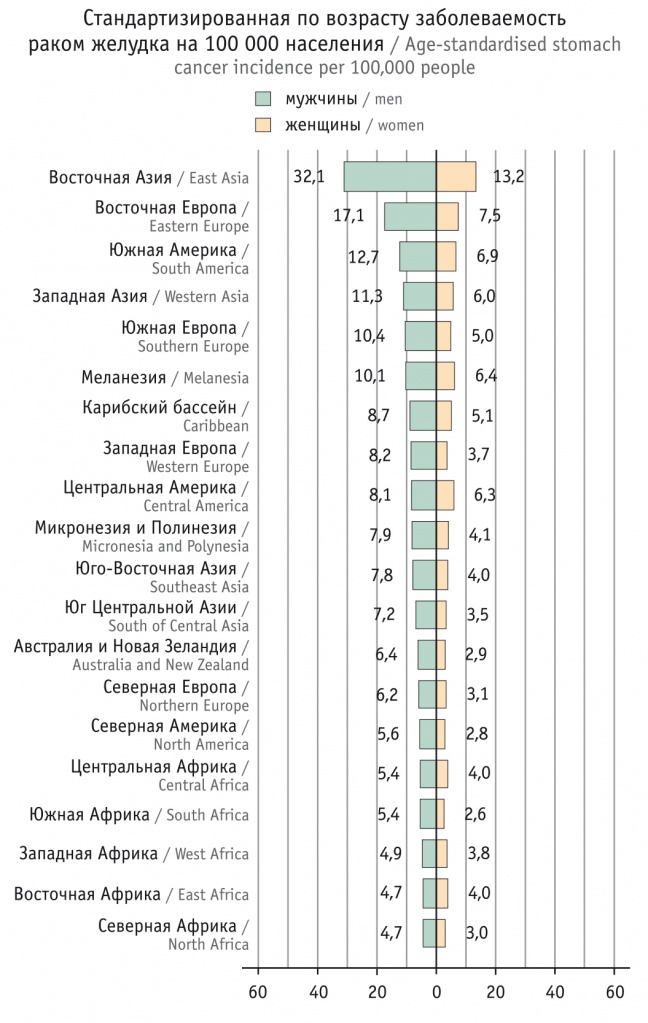
В большинстве регионов России частота рака желудка колеблется от 20 до 25 случаев на 100 000 населения [16].
В современной работе из США проанализированы 77 881 случай рака желудка. Установлено, что заболеваемость некардиальным раком желудка была наиболее высокой среди чернокожих жителей, лиц испанского, азиатского происхождения и коренного населения Америки [17]. У нас есть большой собственный опыт изучения этнических особенностей гастродуоденальной патологии в различных регионах Сибири [16, 18-21] и в кооперации с северо-американскими и скандинавскими коллегами в приполярных регионах планеты [22]. Эти исследования верифицируют наличие выраженных этнических различий распространенности и патогенеза заболеваний.
ВЕДЕНИЕ ПАЦИЕНТОВ С ПРЕДРАКОВЫМИ ИЗМЕНЕНИЯМИ В ЖЕЛУДКЕ
Большое значение имеют опубликованные в 2019 г. вторые рекомендации по ведению пациентов с предраковыми состояниями и изменениями желудка (MAPS II) [7]. Следует отметить, что эти рекомендации были созданы тремя группами специалистов: Европейским обществом гастроинтестинальной эндоскопии, Европейской группой по изучению Helicobacter pylori и микробиоты и Европейским обществом патологоанатомов, что особенно важно для комплексной диагностики патологии желудка. Мы позволим себе процитировать некоторые положения этих рекомендаций.
Положение 1 MAPS II. Пациенты с хроническим атрофическим гастритом или кишечной метаплазией находятся в группе риска развития аденокарциномы желудка.
Это известное положение было подтверждено также Маастрихтским консенсусом V в 2017 г. [6] и Киотским консенсусом по гастриту [5].
Положение 2 MAPS II. Гистологически подтвержденная кишечная метаплазия является наиболее надежным маркером атрофии слизистой оболочки желудка.
Хронический атрофический гастрит и кишечная метаплазия — это предраковые изменения, потому что они создают независимый риск развития аденокарциномы желудка [23].
Положение 10 MAPS II. Системы для гистологического определения стадии гастрита, например Operative Link for Gastritis Assessment (OLGA) и Operative Link on Gastric Intestinal Metaplasia Assessment (ОLGIM), могут использоваться для идентификации пациентов с поздними стадиями атрофического гастрита.
В 2008 г. международной группой гастроэнтерологов и морфологов предложена новая система стадирования атрофического гастрита OLGA. Эта система суммирует показатели атрофии в теле и антральном отделе желудка с определением баллов в каждом биоптате; III, IV стадии выраженности атрофического гастрита по системе OLGA свидетельствуют о высокой вероятности развития рака желудка [24]. На базе классификации OLGA разработана модификация OLGIM, основанная на оценке кишечной метаплазии [25].
Положение 11 MAPS II. Низкие уровни пепсиногена 1 в сыворотке и/или низкое соотношение пепсиногенов 1/2 выявляют пациентов с продвинутыми стадиями атрофического гастрита, и им рекомендуется эндоскопия, особенно если серологический тест на H. pylori отрицательный.
Как указано в MAPS I [26], низкий уровень пепсиногена 1 в сыворотке, низкое соотношение пепсиногенов 1/2 или оба эти фактора являются надежными показателями атрофических изменений слизистой оболочки желудка. Работы, опубликованные после MAPS I, подтверждают, что низкие уровни пепсиногенов — предикторы атрофического гастрита и риска развития рака желудка. Метаанализ 2015 г. по тестам на пепсиноген при раке желудка и атрофическом гастрите позволил получить высокую корреляцию между снижением уровня пепсиногена в сыворотке и атрофией.
Суммарная чувствительность и суммарная специфичность диагностики рака желудка составили 0,69 (95%-ный ДИ: 0,60–0,76) и 0,73 (95%-ный ДИ: 0,62–0,82) соответственно. Значения для диагностики атрофического гастрита были 0,69 (95%-ный ДИ: 0,55–0,80) и 0,88 (95%-ный ДИ: 0,77–0,94) соответственно. График Фагана показал, что использование уровней пепсиногена в сыворотке крови может улучшить выявляемость рака желудка и атрофического гастрита [27].
Положение 20 MAPS II. Эрадикация H. pylori лечит хронический неатрофический гастрит, может привести к регрессии атрофического гастрита, снижает риск рака желудка у больных неатрофическим и атрофическим гастритом и, следовательно, рекомендуется пациентам с этими состояниями.
Положение 21 MAPS II. У пациентов с кишечной метаплазией эрадикация H. pylori, по-видимому, не дает обратного развития метаплазии, но уменьшает воспаление и атрофию. В связи с этим таким больным тоже рекомендуется эрадикация H. pylori.
Два метаанализа, которые фокусировались на риске рака желудка после эрадикации H. pylori, показали, что она значительно снижает риск рака у больных хроническим атрофическим или неатрофическим гастритом (ОР = 0,64; 95%-ный ДИ: 0,48–0,85), но не у лиц с кишечной метаплазией или дисплазией (ОР = 0,88, 95%-ный ДИ: 0,59–1,31) [28, 29]. Тем не менее у пациентов с кишечной метаплазией эрадикация H. pylori оказывает благотворное гистологическое действие.
Поэтому авторы MAPS II считают, что эрадикацию H. pylori следует проводить и у пациентов с кишечной метаплазией [7]. Важно отметить, что инфекция H. pylori вызывает и другие заболевания желудка и двенадцатиперстной кишки, поэтому эрадикация рекомендована в большинстве случаев, помимо наличия предраковых состояний [6, 21].
Консенсус Британской гастроэнтерологической ассоциации, опубликованный в конце 2019 г., является более подробным и содержит детальный регламент, описывающий действия эндоскопистов при предраковых изменениях в желудке. Для терапевтов и гастроэнтерологов можно выделить следующие положения.
Положение 1. Эрадикация H. pylori рекомендуется для уменьшения риска рака желудка у пациентов, которые имеют атрофический гастрит.
Положение 2. Эрадикация H. pylori может применяться для уменьшения риска развития рака желудка у пациентов с H. pylori-ассоциированной кишечной метаплазией и дисплазией.
Положение 22. Эндоскопический скрининг может проводиться у пациентов старше 50 лет с множественными факторами риска рака желудка (мужской пол, курение табака, пернициозная анемия, семейный анамнез рака) [8].
Следует заметить, что в американских обзорах по ведению пациентов с метаплазией в желудке разрешается выполнять морфологическое исследование не только по системе OLGA, но и по модифицированной Сиднейской системе [9, 10, 30].
ПРОФИЛАКТИКА РАКА ЖЕЛУДКА
Как известно, профилактика может быть первичной и вторичной. Первичная профилактика заключается в предупреждении действия факторов риска. Вторичная профилактика представляет собой лечение осложнений заболевания.
Ведущими факторами риска рака желудка являются мужской пол, возраст старше 50 лет, H. pylori, курение табака, семейный онкологический анамнез, дефицит в пище овощей и фруктов [2]. H. pylori относится к модифицируемым факторам риска, он находится в сфере деятельности гастроэнтерологов и терапевтов.
Все современные международные рекомендации, включая Киотский консенсус [5], Маастрихт V [6], MAPS II [7], рекомендации Британской гастроэнтерологической ассоциации [8], работы по ведению пациентов с предраковыми изменениями в желудка в США [9, 10], Японии [11] и России [31], утверждают, что эрадикация H. pylori снижает риск рака желудка, то есть представляет собой метод первичной профилактики этой патологии.
В последнее время накоплен большой материал по начавшемуся в 2013 г. Европейскому регистру H. pylori (HP-Eu-Reg), представляющему собой мультицентровое наблюдательное исследование реальной клинической практики. Всего в рамках работы эрадикационная терапия была выполнена 2769 взрослым пациентам.
Анализ данных показал, что эффективность эрадикации по схеме «висмут + тройная терапия» была значительно более высокой в сравнении с таковой у только тройной терапии [32].
Аналогичные результаты получены в мультицентровом исследовании, объединившем ученых из Испании, России, Украины, Франции и Ирландии [33]. Эти данные позволяют считать, что в настоящее время наиболее обоснованным методом эрадикационной терапии в России является следующая схема: препарат висмута (висмута трикалия дицитрат 240 мг 2 раза в день) + плюс ингибитор протонной помпы (эзомепразол или рабепразол 20 мг 2 раза в день с возможным увеличением дозы при необходимости) + плюс амоксициллин 1 г 2 раза в день + кларитромицин 500 мг 2 раза в день в течение 10–14 дней.
ЗАКЛЮЧЕНИЕ
Обзор современных данных показал, что наиболее эффективные методы профилактики рака желудка — эрадикация Helicobacter pylori, отказ от курения табака, рациональное питание с достаточным содержанием овощей и фруктов. Вторичная профилактика заключается в оптимизации диагностики, наблюдения и лечения предраковых изменений в желудке.
Поступила: 13.03.2020
Принята к публикации: 24.04.2020








