Печень и поджелудочная железа (ПЖ) — два, казалось бы, абсолютно непохожих органа пищеварительной системы, имеющие различную гистологическую структуру и анатомическое строение, выполняющие кардинально отличные функции, соприкасающиеся только опосредовано. Однако они тесно взаимосвязаны друг с другом.
Одной из патологий, сказывающихся на состоянии как печени, так и ПЖ, является метаболический синдром. Помимо широко известных «кардиологических» проявлений, он имеет «гастроэнтерологические» составляющие — неалкогольную жировую болезнь печени (НАЖБП) и неалкогольную жировую болезнь ПЖ (НАЖБПЖ). Эти нозологии объединяет сходство патофизиологических процессов и естественного течения: инициальная жировая инфильтрация (стеатоз печени, ПЖ) носит прогрессирующий характер и трансформируется в активный воспалительный процесс (неалкогольный стеатогепатит (НАСГ) и стеатопанкреатит) с последующим формированием фиброзной ткани (фиброз и цирроз печени, фиброз ПЖ) и злокачественной малигнизацией (гепатоцеллюлярная карцинома (ГЦК), рак ПЖ) [1-5].
Поразительное сходство НАЖБП и НАЖБПЖ подчеркивают часто одновременное или последовательное развитие обеих патологий, ведь их сочетанное течение наблюдают в 50–80% случаев [2-5]. Это повлекло за собой появление постулата о необходимости проведения диагностического поиска не только НАЖБП, но и НАЖБПЖ при обнаружении признаков метаболического синдрома, на фоне которого развивается стеатоз печени и ПЖ [2, 6, 7].
Объединяют НАЖБП и НАЖБПЖ не только сходство патогенетических механизмов, естественного течения, клинических проявлений, но и отсутствие четких стандартов, определяющих лечебную тактику. Вполне вероятно, что существует несколько нитей, соединяющих НАЖБП и НАЖБПЖ, и одной из таких нитей могут быть желчные кислоты (ЖК).
НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПЕЧЕНИ И НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ: СКОВАННЫЕ ОДНОЙ ЦЕПЬЮ
К сожалению, патогенетические особенности возникновения и прогрессирования НАЖБП и НАЖБПЖ изучены недостаточно полно. Исторически сложилось так, что в поле зрения врачей сначала попала НАЖБП, и только со временем, по мере расширения знаний о естественном течении этой патологии и метаболического синдрома, были сформулированы первые представления о НАЖБПЖ. В настоящее время высказываются мнения о тесной связи указанных нозологий, при этом большое внимание уделяется оси «тонкий кишечник — печень/ПЖ — жировая ткань» [3-5].
Среди множества теорий, объясняющих развитие НАЖБП и НАЖБПЖ, выделяется гипотеза, основанная на изменениях метаболизма липидов, способствующих накоплению жира в гепатоцитах и строме ПЖ, активации окислительного процесса, повреждению клеток, формированию фиброза [1-5]. Центральное место в этой теории занимают адипоциты, способные высвобождать цитокины, активирующие процессы воспаления и фиброгененза в печени и ПЖ, вызывающие развитие инсулинорезистентности.
Еще одним мощным фактором, создающим условия для появления и формирования инсулинорезистентности, является нарушение метаболизма ЖК, которое вместе с ростом концентраций вторичных ЖК рассматривается в качестве одного из «толчков» для активации, усиления воспалительного процесса и прогрессирования НАЖБП и/или НАЖБПЖ [8].
ЖЕЛЧНЫЕ КИСЛОТЫ И НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПЕЧЕНИ: ТЕСНЫЕ ВЗАИМОСВЯЗИ
Подчеркивается, что НАЖБП развивается на фоне выраженного дисбаланса синтеза ЖК с преобладанием альтернативного способа их образования [8]. Такие изменения ассоциируются с уменьшением количества желчи, ее внутрипеченочным накоплением, что способствует поражению печени [9]. При стеатозе печени и НАСГ констатируют изменение общего количества и спектра ЖК: возрастание сывороточных концентраций гликохенодеоксихолата, гликохолата и таурохолата [10, 11], отмечена также прямая зависимость между метаболическим фенотипом, инсулинорезистентностью и уровнем ЖК при НАСГ [12].
Регуляция синтеза ЖК происходит преимущественно посредством активации ядерных рецепторов, таких как фарнезоидный рецептор Х (FXR), G-белковый рецептор (TGR5), прегнан-Х-рецептор, рецептор витамина D [13].
Большинство ЖК связываются с FXR, который играет важную роль в метаболизме ЖК, глюкозы и липидов [8, 13]. FXR экспрессируется в различных тканях и органах, наиболее высокие уровни экспрессии зафиксированы в печени и почках, подвздошной кишке, ПЖ и надпочечниках [13].
Основной функцией FXR является контроль синтеза и энтерогепатической циркуляции ЖК [8, 13]. FXR влияет на гомеостаз липидов в печени посредством малого гетеродимерного партнера (SHP), который уменьшает экспрессию белка, связывающего стерол-регулирующие элементы 1 (SREBP-1). Последний также регулирует экспрессию рецепторов, активируемых пролифератором пероксисом PPAR-α, способных индуцировать β-окисление жирных кислот.
Именно после открытия FXR ЖК перестали рассматриваться с точки зрения биологически активных веществ, принимающих участие только в процессе пищеварения. Доказано, что эти естественные лиганды FXR принимают участие в контроле уровней жиров, глюкозы, энергетическом метаболизме (рис. 1) [14].
Рис. 1. Роль фарнезоидного рецептора Х (FXR) в регуляции метаболизма глюкозы и липидов (по [14]). Активация FXR желчными кислотами или синтетическими агонистами приводит к падению уровней триглицеридов в плазме крови посредством снижения экспрессии SREBP-1, преимущественно в гепатоцитах. Активация FXR также увеличивает экспрессию аполипопротеина Apo CII и снижает экспрессию Apo CIII и ANGTPL-3, что способствует стимуляции активности липопротеинлипазы. FXR опосредует угнетение параоксоназы 1 для инактивации проатерогенных липидов, усиливает β-окисление жирных кислот и улучшает клиренс липопротеинов очень низкой плотности и хиломикронов. С другой стороны, активация FXR в β-клетках усиливает Akt-фосфорилирование и содействует транслокации GLUT-2 на апикальной мембране, увеличивая поглощение глюкозы. FXR-KLF11-сигнальный путь играет значимую роль в регуляции транскрипции и секреции инсулина. FXR-SHP-отрицательный регуляторный каскад способен влиять на глюконеогенез в печени
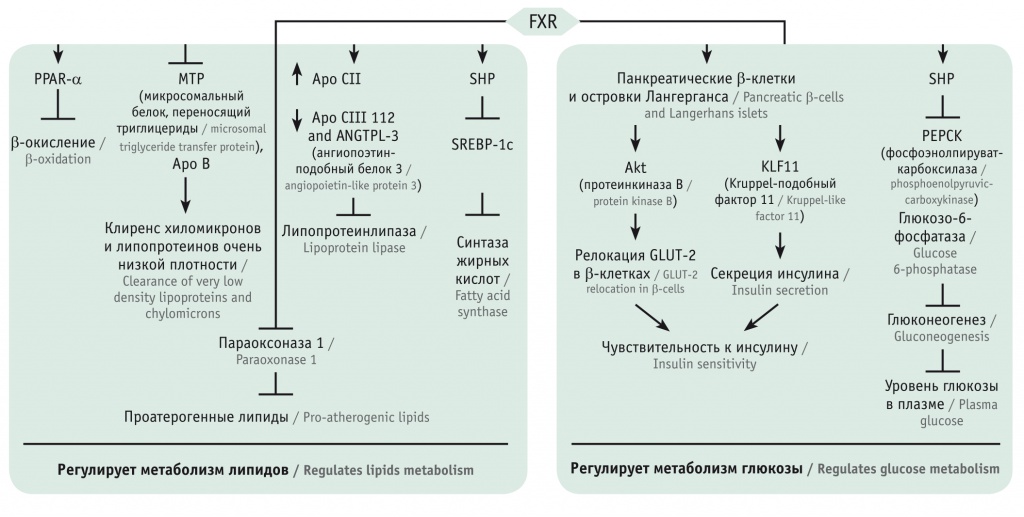
Метаболизм триглицеридов регулируется посредством FXR/SHP-сигнального пути. В липогенезе участвует множество ферментов: ацетил-СоА-карбоксилаза, синтаза жирных кислот, глюкозо-6-фосфатаза. Их функциональная активность регулируется SHP. Один из наиболее важных регуляторов синтеза жирных кислот и триглицеридов — SREBP-1с, активность которого может ингибироваться SHP [13].
ЖК способны оказывать значительное влияние на состояние и функциональную активность кишечной микробиоты, а изменение состава ЖК является важным регулятором микробиома кишечника (рис. 2). Вторичные ЖК сильнее активируют FXR и TGR5, чем первичные [15].
Рис. 2. Взаимосвязь между желчными кислотами, фарнезоидным рецептором Х (FXR) и микробиотой кишечника (по [14]). Активация FXR приводит к увеличению экспрессии мРНК-индуцибельной NO-синтазы (iNOs), ANG-1, CAR-12, которые принимают участие в антибактериальной защите, продуцируя антимикробные пептиды (iNOs, ANG-1) или помогая поддерживать интестинальный pH (CAR-12). Все это играет важную роль в поддержании гомеостаза интестинального содержимого и целостности эпителиального барьера. Активация FXR способствует супрессии воспалительных генов (фактора некроза опухоли (ФНО) α, интерлейкинов (ИЛ) 1 и 6) и усиливает антибактериальное действие.
Примечание: ДХК — дезоксихолевая кислота, ЛХК — литохолевая кислота, ХДХК — хенодезоксихолевая кислота, ХК — холевая кислота, ASBT — апикальный натрий-зависимый переносчик желчных кислот
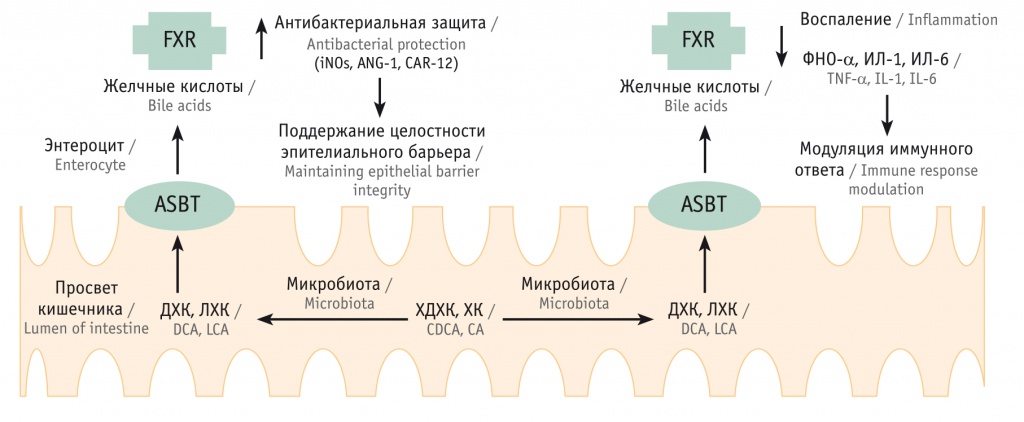
Такое многообразие благоприятных эффектов, развивающихся при активации FXR, послужило основанием для поиска и разработки агонистов этого рецептора. Предполагается, что усиление экспрессии FXR окажет благоприятное действие при НАЖБП и, вероятно, при НАЖБПЖ, позволив значительно минимизировать последствия вялотекущего воспалительного процесса.
УРСОДЕЗОКСИХОЛЕВАЯ КИСЛОТА ПРИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ И НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ: СВЯЗАННЫЕ ОДНОЙ ЦЕЛЬЮ
Среди множества средств, обладающих способностью активировать FXR, стоит обратить пристальное внимание на один из естественных лигандов этого рецептора — урсодезоксихолевую кислоту (УДХК). УДХК обладает антихолестатическим и антиапоптическим, а также антиоксидантным, цитопротекторным, антифибротическим, гипохолестеринемическим, иммуномодулирующим, гепатопротекторным свойствами, которые могут использоваться в лечении НАЖБП/НАЖБПЖ.
Урсодезоксихолевая кислота при неалкогольной жировой болезни печени
Целесообразность назначения УДХК при НАЖБП анализируется на протяжении нескольких десятилетий. В одном из первых метаанализов подтверждена способность монотерапии УДХК нормализовать активность функциональных проб печени у больных НАСГ, комбинированной терапии — дополнительно снижать активность воспалительного процесса в печени, выраженности стеатоза [16]. Однако противоречивые результаты, полученные в отношении способности УДХК минимизировать гистологические признаки фиброза, не позволили экспертам American Association for the Study of Liver Diseases и European Association for the Study of the Liver рекомендовать этот препарат для лечения НАЖБП. Относительно недавно появились новые доказательные данные, которые позволяют задуматься о целесообразности включения данного препарата в схемы лечения НАЖБП.
Метаболизм липидов. Благотворное влияние УДХК на метаболизм липидов зафиксировано в целом ряде работ. Наблюдая за состоянием больных морбидным ожирением и НАЖБП (n = 40), которые принимали УДХК (20 мг/кг/сут) на протяжении 3 недель до выполнения бариатрического вмешательства, М. Mueller и соавт. констатировали усиление синтеза ЖК посредством уменьшения активности циркулирующего фактора роста фибробластов 19 и активации FXR, что привело к индукции холестерин-7α-гидроксилазы (классического пути биосинтеза ЖК) [17].
Изменение синтеза ЖК сопровождалось истощением запасов холестерина в печени и снижением уровня ЛПНП с последующей активацией ключевого фермента синтеза холестерина — 3-гидрокси-3-метилглутарил-СоА-редуктазы. Отмеченная индукция активности стеароил-СоА-десатуразы в белой висцеральной жировой ткани сопровождалась усилением синтеза менее токсичных мононенасыщенных жирных кислот [17].
Улучшение метаболизма липидов в печени на фоне приема УДХК подтверждают современные экспериментальные исследования, проведенные в культуре тканей. В одной из таких работ эта способность объясняется влиянием УДХК на Akt/mTOR/SREBP-1-сигнальный путь с последующим уменьшением активации Аkt, mTOR, экспрессии SREBP-1 [18].
В другом исследовании анализировались механизмы антилипидогенного и гепатопротекторного действия УДХК [19]. Авторы доказали, что прием УДХК приводит к значимому уменьшению количества липидных капель, содержания свободных жирных кислот, триглицеридов в печени у мышей, страдающих ожирением (рис. 3).
Рис. 3. Урсодезоксихолевая кислота (УДХК) улучшает метаболизм липидов в печени у ob/ob мышей, страдающих ожирением [19]. Представлены биоптаты печени, окрашенные гематоксилин-эозином, масляным красным и результаты иммуногистохимического исследования на CD36 и SREBP-1с в печени (красные стрелки указывают на положительное окрашивание)
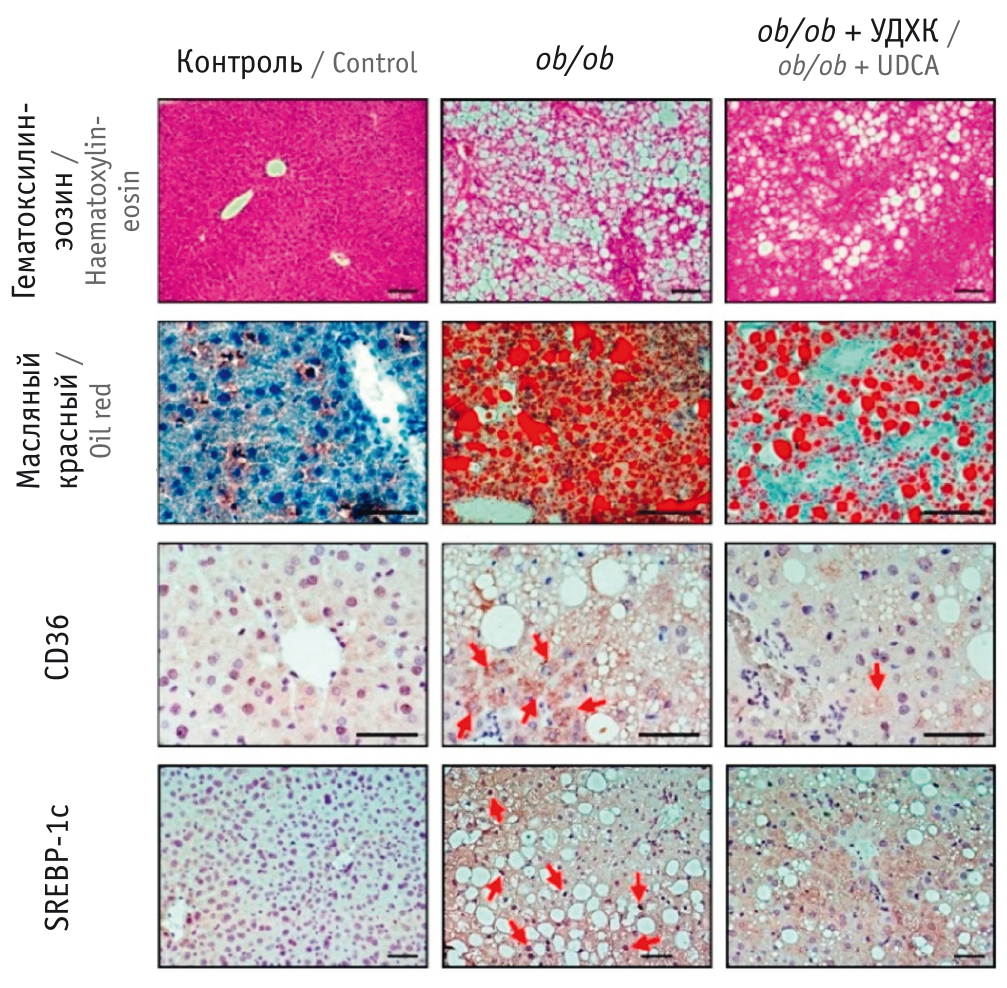
Введение УДХК способствует улучшению функции митохондрий, трансформации белой жировой ткани в коричневую. Данный факт объяснили усилением активности энергетического обмена в печени, биогенезом митохондрий и инкорпорацией метаболизма ЖК (Abca1, BSEP, FGFR4, TGR5), УДХК-опосредованным торможением NF-κB и STAT3-индуцированного фосфорилирования посредством угнетения экспрессии SOCS1 и SOCS3-сигнальных путей. Эти изменения сопровождались снижением активности ангиогенеза: уменьшением экспрессии фактора роста сосудистого эндотелия, молекул адгезии сосудистого эндотелия 1-го типа, трансформирующего фактора роста.
УДХК сокращала количество жировой ткани у подопытных животных, что ассоциировалось со снижением макрофагальной инфильтрации жировой ткани и уровней маркеров липогенного потенциала (липофусцина, SREBP-1 и CD36). Основываясь на полученных данных, исследователи констатировали: «УДХК может быть новым эффективным терапевтическим средством для лечения ожирения» [19].
Подобные результаты получены в клинических исследованиях. В одной из таких работ анализировали влияние УДХК на состояние печени у лиц с синдромом короткого кишечника, на фоне которого формируются дислипидемия и вторичный стеатоз печени вследствие недостаточности тонкого кишечника [20]. Оказалось, что прием УДХК в дозе 20 мг/кг/сут на протяжении 4 месяцев позволил снизить активность синтеза холестерина (р < 0,05), уменьшить фракционную скорость синтеза холестерина (р = 0,06) и триглицеридов (р < 0,01) в печени.
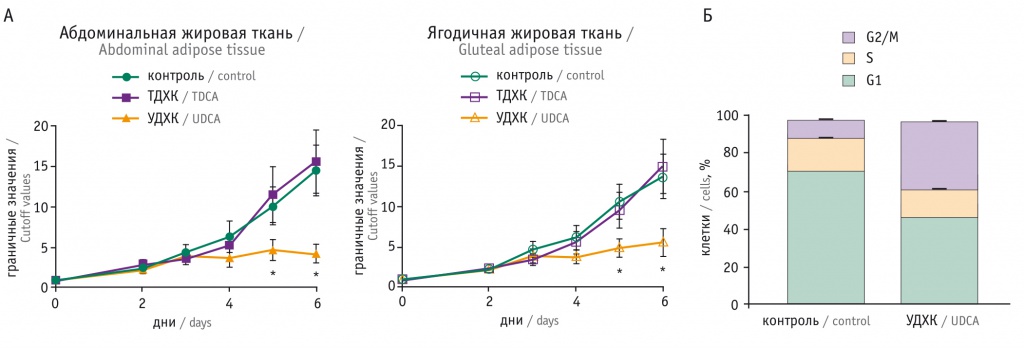
Доказана способность УДХК ингибировать процессы пролиферации и дифференцировки подкожных адипоцитов человека [21]. Проанализировав состояние образцов абдоминальной и ягодичной жировой ткани, полученных у 10 женщин в пременопаузе, страдавших ожирением (ИМТ ≥ 32 кг/м2), исследователи подтвердили наличие у УДХК более выраженных антипролиферативных и антиадипогенных свойств по сравнению с таковыми тауродезоксихолевой кислоты (рис. 4). При этом антиадипогенная активность данной ЖК не зависела от активации FXR и TGR5, а была опосредована способностью УДХК поддерживать активацию ERK1/2 и инактивировать PPAR-γ [21].
Рис. 4. Влияние желчных кислот на пролиферацию адипоцитов (по [21]). А — преадипоциты культивировали на протяжении 6 дней в присутствии 200 мкг урсодезоксихолевой кислоты (УДХК) или 500 мкг тауродезоксихолевой кислоты (ТДХК); анализ пролиферации клеток проводили в указанные дни; (*) — различия между группами статистически значимы. Б — анализ клеточного цикла в присутствии урсодезоксихолевой кислоты (200 мкг) по сравнению с контролем. Представлено количество клеток (%), пребывавших в различных фазах клеточного цикла — G1, S, G2/M
Углеводный обмен и инсулинорезистентность. Положительные изменения уровня гликемии, инсулинорезистентности на фоне приема УДХК зафиксированы в целом ряде исследований. Уменьшение выраженности инсулинорезистентности у мышей линии KK-A(y), страдавших СД 2 типа, стеатозом печени, получавших с пищей большое количество жиров, отметили Т. Tsuchida и соавт. [22]. Залогом таких благоприятных изменений стал пероральный прием УДХК в дозах 50, 150 и 450 мг/кг на протяжении 2–3 недель; отметили также снижение уровней гипергликемии, гиперинсулинемии, триглицеридов и холестерина в печени, активное выведение жиров с фекалиями [22].
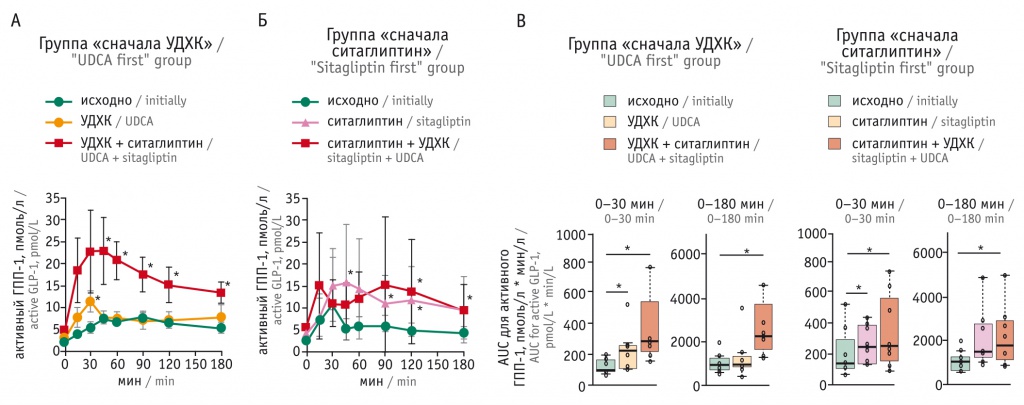
Относительно недавно японские ученые под руководством К.R. Shima [23] представили доказательства способности УДХК влиять на секрецию глюкагоноподобного пептида 1 (ГПП-1), основным физиологическим эффектом которого является стимуляция секреции и синтеза инсулина β-клетками ПЖ. ГПП-1 ингибирует секрецию глюкагона, повышающего уровень гликемии, замедляет скорость опорожнения желудка, способствуя уменьшению колебаний постпрандиальной гликемии.
В этом исследовании приняли участие больные СД 2 типа с сопутствующей НАЖБП (n = 16). Пациентов разделили на две группы по 8 человек; участникам первой группы рекомендовали сначала принимать только УДХК (900 мг/сут на протяжении 12 недель), затем назначали ситаглиптин (50 мг/сут в течение последующих 12 недель). Представители второй группы исходно получали монотерапию ситаглиптином (50 мг/сут) на протяжении 12 недель с последующим включением в схему лечения УДХК (900 мг/сут) в течение 12 недель.
В группе больных, первоначально принимавших УДХК, исследователи отметили значительное снижение массы тела (р = 0,04) и уровня HbA1с (р = 0,01). В группе исходного приема ситаглиптина введение УДХК сопровождалось статистически значимым снижением концентрации HbA1c (р = 0,04). Монотерапия УДХК ассоциировалась с активацией ранней фазы секреции ГПП-1 (р < 0,01) [23] (рис. 5).
Рис. 5. Содержание активного глюкагоноподобного пептида 1 (ГПП-1) в плазме крови у больных сахарным диабетом 2 типа и неалкогольной жировой болезнью печени после приема жидкой жирной пищи на момент включения в исследование, спустя 12 и 24 недели терапии (по [23]). Приведены плазменные концентрации активного ГПП-1 у пациентов, сначала получавших монотерапию урсодезоксихолевой кислотой (УДХК) (А) или ситаглиптином (Б), и значения площади под кривой (AUC) для концентрации активного ГПП-1 в обеих группах (В).
* Различия между группами статистически значимы
Поскольку НАЖБП, метаболический синдром, ожирение неблагоприятно влияют на состояние сердечно-сосудистой системы, большое внимание уделяется торможению прогрессирования атеросклеротического поражения сосудов и нормализации АД у таких больных. Ведь повышение АД можно рассматривать с позиции формирования системной инсулинорезистентности. В одной из экспериментальных работ отмечены гипотензивные свойства УДХК [24]. Лабораторным животным с выраженной инсулинорезистентностью скармливали УДХК (70 мг/кг/сут) или кандесартан (3 мг/кг/сут) на протяжении 4 недель. Спустя месяц терапии оказалось, что систолическое (САД) и диастолическое (ДАД) АД у подопытных мышей соответствовало таковому у контрольных животных, получавших с пищей минимальное количество жиров. Спустя 4 недели в группе кандесартана САД и ДАД статистически значимо снизились в отличие от показателей группы УДХК, где они не претерпели значимых изменений. Однако дополнительное скармливание УДХК на протяжении последующих 24 недель сопровождалось снижением САД, причем гипотензивное действие этой ЖК было сопоставимым с таковым кандесартана [24].
Фиброз. Способность УДХК тормозить или уменьшать образование соединительной ткани в печени при НАЖБП является одним из камней преткновения в лечении этой патологии. С одной стороны, ранее опубликованы несколько исследований, в которых это свойство УДХК признавалось сомнительным: препарату не удалось улучшить результаты гистологического анализа печени у больных НАЖБП или НАСГ [1].
В то же время относительно недавно опубликованы результаты экспериментальных исследований, представляющих другие данные. Так, S. Gheibi и соавт. последовательно, на протяжении 14 и 28 дней, скармливали крысам-самцам линии Вистар куркумин (200 мг/кг) и УДХК (80 мг/кг) соответственно [25]. Комбинированная терапия УДХК позволила значимо уменьшить выраженность жировой дегенерации печени, степень отека и некроза гепатоцитов по сравнению с данными показателями у контрольных животных, не получавших ни УДХК, ни куркумин.
Улучшение гистологической картины сопровождалось положительными биохимическими изменениями: падением сывороточной концентрации триглицеридов, нормализацией уровней супероксиддисмутазы и малонового диальдегида. УДХК способствовала поддержанию целостности митохондрий, снижала экспрессию апоптических белков и цитокинов [25].
Апоптоз. Продолжая наблюдение за больными морбидным ожирением и НАЖБП, принимавшими УДХК (20 мг/кг/сут) на протяжении 3 недель до проведения бариатрического вмешательства, М. Mueller и соавт. констатировали увеличение экспрессии некоторых маркеров стресса эндоплазматического ретикулума (CHOP и GRP78) [26]. Изменение экспрессии CHOP (триггера проапоптических процессов) на фоне терапии УДХК не привело к индукции апоптоза по ВАК- и ВАХ-сигнальным путям.
Прием УДХК также сопровождался уменьшением количества потенциально проапоптической микроРНК-34а в сыворотке крови [26].
Исследователи пришли к выводу, что УДХК оказывает неоднозначное действие на больных НАЖБП: с одной стороны, увеличение уровня CHOP может быть нежелательно, но цитопротективные свойства УДХК позволяют повысить апоптотический порог, что подтверждает отсутствие индукции проапоптотических триггеров [26].
Кишечная микробиота. Влияние ЖК на состав кишечного микробиома изучалось в нескольких рандомизированных контролируемых исследованиях. В одном из них участникам рекомендовали 3-летний профилактический прием плацебо (n = 203) или УДХК в дозе 8–10 мг/кг/сут (n = 198) с целью профилактики аденоматозных колоректальных полипов [27]. После завершения курса превентивной химиотерапии исследователи проанализировали влияние УДХК на состав кишечной микробиоты: оказалось, что длительный прием УДХК ассоциирован с изменением микробного состава кишечной микрофлоры (р < 0,001) независимо от пола пациента, причем данные модификации не ассоциировались с риском развития аденокарциномы ни у мужчин, ни у женщин (во всех случаях р > 0,05).
На фоне приема УДХК статистически значимо возрастала численность популяций Streptococcus, Escherichia и Bilophila, уменьшалось количество фузобактерий. Снижение риска развития аденокарциномы у мужчин исследователи объяснили ростом численности Faecalibacterium prausnitzii и наличием обратной связи между F. prausnitzii и Ruminococcus gnavus (увеличение популяции F. prausnitzii приводило к снижению количества R. gnavus) [27].
Установлено, что УДХК ингибирует рост патогенных бактерий, в том числе тормозит прорастание спор и вегетативных форм Clostridium difficile [28], противодействует развитию воспалительных процессов в кишечнике посредством усиления барьерной функции энтероцитов и ингибирования апоптоза [29], восстановления микробиоценоза кишечника [30, 31].
Согласно последним данным, 8-недельная терапия УДХК (300 мг 2 раза в сут) больных НАЖБП с сопутствующим ожирением благотворно сказывалась на метаболизме кишечных бактерий [32]. Исследователи установили, что улучшение функционирования печени обусловлено не только способностью УДХК модулировать кишечный микробиом и увеличивать численность лакто- и бифидобактерий, но и влиянием этой ЖК на фенилаланин/тирозин-сигнальный путь, что проявляется уменьшением уровней токсинов (гиппуровой кислоты, п-крезола, метаболитов индола и сульфатов) и возрастанием концентраций антиоксидантов (аскорбата сульфата, N-ацетил-L-цистеина) [32].
Противоопухолевая активность. Наличие противоопухолевых свойств у препаратов, использующихся для лечения НАЖБП, может рассматриваться в качестве значительного преимущества, учитывая финальную стадию естественного течения заболевания — ГЦК. В настоящее время доказаны хемопревентивная активность УДХК в отношении рака толстого кишечника [33] и желудка [34], которая проявляется в виде подавления пролиферации раковых клеток в переходных фазах клеточного цикла (G1/S и G2/M) и ограничения инвазивных свойств неопластических клеток соответственно.
С УДХК связывают большие надежды в лечении ГЦК, особенно в комбинации с сорафенибом [35]. Эти ожидания основываются на способности УДХК защищать эпителиальные клетки от повреждений, апоптоза, ингибировать пролиферацию и индуцировать апоптоз и/или гибель раковых клеток вследствие аутофагоцитоза [35].
Оправдывают смелые надежды и результаты экспериментального исследования, проведенного Т. Liu и соавт. [36]. Ученые проанализировали состояние образцов тканей человеческой холангиокарциномы, полученных у пациентов, перенесших резекцию печени по поводу ГЦК. Инкубация образцов с литохолевой кислотой приводила к увеличению экспрессии гомолога G онкогена V-MAF апоневрозно-мышечной фибросаркомы (MAFG), тогда как введение УДХК предупреждало повышение экспрессии MAFG [36].
Известно, что экспрессия MAFG возрастает в клетках и тканях с холестазом, пораженных ГЦК, а высокий уровень экспрессии коррелирует с быстрой прогрессией опухоли и уменьшением выживаемости. Получив данные о снижении экспрессии MAFG под влиянием УДХК, исследователи высказали предположение о возможном улучшении прогноза у больных ГЦК при условии назначения этой ЖК [36].
Урсодезоксихолевая кислота и поджелудочная железа
Согласно современной концепции естественного течения НАЖБПЖ, прогрессирование заболевания проходит от стеатоза ПЖ через стеатопанкреатит в фиброз и рак ПЖ с развитием эндо- и экзокринной дисфункции железы [5]. Начальный этап изучения НАЖБПЖ ограничивает наши возможности по предоставлению и анализу данных об эффективности назначения УДХК именно при этой патологии, поэтому ниже будет рассмотрено влияние УДХК на состояние ПЖ при заболеваниях, косвенно соответствующих стадиям НАЖБПЖ.
Липидный обмен. Способность УДХК улучшать всасывание и переваривание жиров при поражении ПЖ показана в работе S. Drzymała-Czyż и соавт. [37]. К такому выводу исследователи пришли, проанализировав результаты дыхательного теста с использованием 13С-смешанных триглицеридов у больных муковисцидозом, которым отменили прием УДХК и оставили только заместительную терапию с использованием стандартных или высоких доз ферментных препаратов.
Спустя месяц после отмены УДХК ученые констатировали существенное ухудшение переваривания (р < 0,000031) и всасывания жиров (суммарный процент восстановления дозы — 2,9%; 95%-ный ДИ: 0,7–5,8). «Помимо назначения ферментов ПЖ, необходимо учитывать роль других факторов, ответственных за усвоение жиров, особенно при муковисцидозе», — резюмировали исследователи.
Несмотря на то что в данной работе приняли участие пациенты с патологией, отличной от НАЖБПЖ, полученные результаты можно считать основанием для проведения подобных исследований в когорте больных со стеатопанкреатитом.
Углеводный обмен. В литературе описаны случаи успешного применения УДХК для лечения аутоиммунного панкреатита. К. Tsubakio и соавт. наблюдали 51-летнюю пациентку, страдавшую СД 2 типа с сопутствующим поражением печени по холестатическому типу, имевшую признаки аутоиммунного панкреатита по данным МРТ (отек ПЖ, сужение основного панкреатического протока, терминальную стриктуру общего желчного протока), по результатам гистологического (фиброз ткани с инфильтрацией железы мононуклеарами) и лабораторного (обнаружены антитела к карбоангидразе 2-го типа, антитела к лактоферрину) исследований [38]. Из-за сопутствующего СД и холестатического поражения печени японские врачи не решились назначить пациентке кортикостероиды, но рекомендовали прием УДХК. Терапия этой ЖК помогла разрешить явления холестаза, нивелировать отек ПЖ и улучшить компенсацию углеводного обмена [38].
Активность воспалительного процесса. В некоторых исследованиях изучалось влияние УДХК на течение острого экспериментального желчного панкреатита. Возникновение острого повреждения ткани ПЖ модулировали посредством помещения интралобулярного панкреатического протока морских свинок в раствор хенодезоксихолевой кислоты (ХДХК); степень тяжести острого панкреатита оценивали при помощи стандартных лабораторных и гистологических критериев [39]. Повреждающее влияние ХДХК нивелировали введением УДХК с последующей 5–24-часовой экспозицией.
Предварительное выдерживание изолированных панкреатических протоков в растворе УДХК перед воздействием ХДХК значимо предотвращало потерю АТФ, повреждение митохондрий, ХДХК-индуцированную клеточную смерть (рис. 6). Пероральный прием УДХК (250 мкг/кг) статистически значимо уменьшал тяжесть ХДХК-индуцированного острого панкреатита [39].
Рис. 6. Влияние желчных кислот на внутриклеточный рН (рНi) в изолированных панкреатических протоках гвинейских свинок (по [39]). Панкреатические протоки подвергались воздействию различных концентраций хенодезоксихолевой (А, В) или урсодезоксихолевой кислоты (Б, Г) в буферных растворах HEPES (A, Б) и НСО3–/СО2 (В, Г) на протяжении 5 мин. После удаления желчных кислот рНi спонтанно восстанавливался
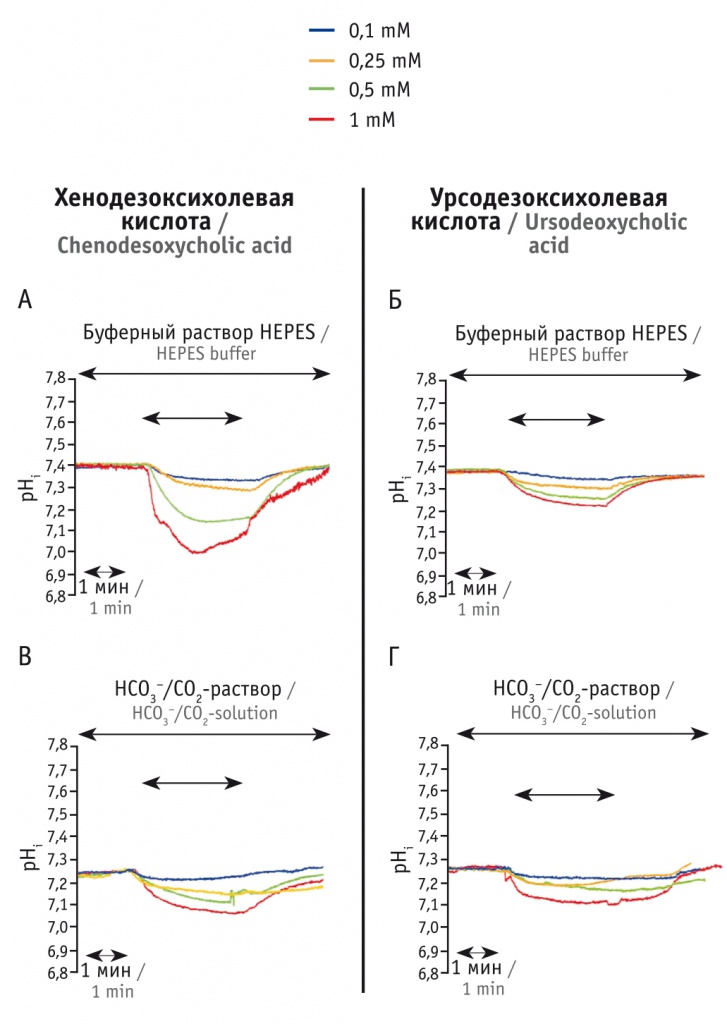
Исследователи утверждают, что УДХК подавляет ХДХК-индуцированное поражение панкреатического протока посредством торможения апоптоза и митохондриального повреждения, а также уменьшает тяжесть ХДХК-индуцированного острого панкреатита.
В еще одном экспериментальном исследовании, проведенном с участием мышей линии Balb/c с аллоксан-индуцированным СД 1 типа, скармливание лабораторным животным УДХК и пробукола позволило значимо снизить активность воспалительного процесса по сравнению с таковой в контрольной группе мышей, получавших монотерапию пробуколом [40]. По мнению исследователей, комбинация УДХК и пробукола оказывала протективное действие на β-клетки ПЖ, т. к. ее прием сопровождался статистически значимым снижением уровня ИФН-γ в плазме крови [40].
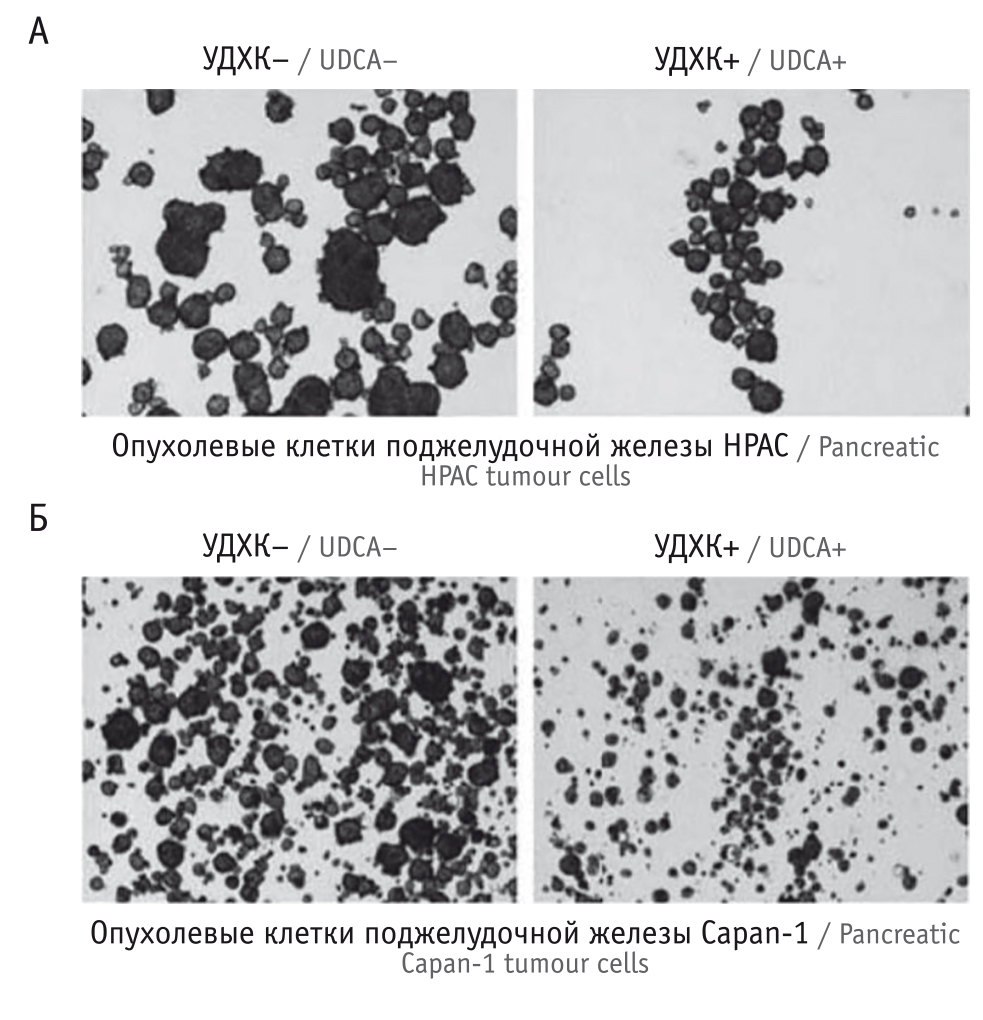
Противоопухолевая активность. Согласно данным последних исследований, УДХК обладает хемопрофилактическими свойствами в отношении рака ПЖ. К этому выводу пришли Y.J. Kim и соавт., культивируя неопластические клетки ПЖ в растворе УДХК на протяжении 7 дней [41]. Ученые утверждают, что присутствие этой вторичной ЖК приводит к уменьшению количества активных форм кислорода, играющих ключевую роль в развитии опухолевого процесса и его прогрессировании. Кроме того, УДХК уменьшала фосфорилирование STAT3 и снижала уровень экспрессии пероксиредоксина II, способствовала увеличению регуляции Е-кадгерина и снижению количества рецепторов N-кадгерина.
Помимо значимой антиоксидантной активности, УДХК показала способность уменьшать эпителиально-мезенхимальную трансдифференциацию, тормозить образование стволовых клеток в культуре раковых клеток ПЖ (рис. 7), что позволило авторам сделать вывод о целесообразности назначения УДХК больным раком ПЖ [41].
Рис. 7. Урсодезоксихолевая кислота (УДХК) уменьшает образование опухолевых клеток в поджелудочной железе (по [41]). Количество опухолевых клеток поджелудочной железы линии НРАС (А) и Capan-1 (Б) с/без внесения раствора УДХК на протяжении 7 дней (4-кратное увеличение)
ЗАКЛЮЧЕНИЕ
Неалкогольная жировая болезнь печени (НАЖБП) и неалкогольная жировая болезнь поджелудочной железы (НАЖБПЖ) — тесно взаимосвязанные патологии, скованные между собой различными цепями (метаболическим синдромом, системной инсулинорезистентностью, окислительным стрессом, дисбалансом липидного и углеводного обменов), одна из которых — изменение метаболизма желчных кислот (ЖК) и экспрессии фарнезоидного рецептора Х (FXR). При этих нозологиях существуют общие терапевтические цели, направленные на модификацию образа жизни, снижение массы тела и увеличение физической нагрузки. НАЖБП и НАЖБПЖ может объединять общий ориентир медикаментозного лечения — агонистическое воздействие на FXR, добиться которого, вероятно, можно посредством применения третичной ЖК — урсодезоксихолевой кислоты (УДХК).
Многофакторный механизм действия УДХК, включающий противовоспалительную, антиоксидантную, цитопротективную и антиапоптическую активность, способность нормализовать углеводный, липидный обмен и активировать FXR, может стать основанием для включения препарата в схемы лечения НАЖБП и НАЖБПЖ.
Безусловно, для подтверждения данного предположения требуется проведение широкомасштабных рандомизированных контролируемых исследований, особенно в отношении НАЖБПЖ — ведь подавляющее большинство выводов о возможной эффективности УДХК при стеатозе ПЖ сделаны нами на основании данных, полученных при назначении этого препарата больным НАЖБП или различной патологией ПЖ. Необходимые нам ответы сокрыты в будущем.
Поступила: 10.08.2020
Принята к публикации: 14.10.2020








