Термин «идиопатический панкреатит» (ИП) применяется в случаях, когда имеют место отчетливые клинические, лабораторные признаки панкреатита, характерные результаты визуализации поджелудочной железы (ПЖ), ее морфологические изменения, однако ни при непосредственном, ни при лабораторно-инструментальном обследовании причину заболевания выяснить не удается[1]. В последние годы диагноз ИП ставится все реже, что связано с прогрессом в области панкреатологии, а также с совершенствованием диагностических методов, позволяющих в большинстве случаев не только подтвердить диагноз панкреатита как такового, но и выяснить его причину.
Современные лабораторные и особенно инструментальные методы (КТ, МРТ, эндосонография и др.) способствуют выявлению причины ИП приблизительно в 80% случаев[2]. Установление причины панкреатита имеет принципиальное значение для выработки тактики лечения. Летальность при остром ИП значительно выше (14,1%), чем при билиарном панкреатите (7,2%)[3].
Мнения о частоте встречаемости ИП в зависимости от пола и возраста разноречивы. Некоторые авторы считают, что частота ИП сходна у мужчин и женщин, другие опубликовали данные о соотношении частоты заболевания у мужчин и женщин 7 : 1[4]. По данным N. Thorsgaard Pedersen и соавт. (1982), ИП в 33% случаев развивается у мужчин[5], другие исследователи считают, что этот показатель составляет 61%[6], 57%[7].
Относительно возраста возникновения ИП опубликованы четкие сведения о раннем и позднем ИП, что нашло свое отражение в классификации TIGAR-O[8]. В категорию ИП, согласно этой классификации, отнесены также тропический хронический панкреатит, другие случаи ИП. Ранний хронический ИП развивается в возрасте 15–25 лет, а поздний — в возрасте 55–65 лет. Такое разделение было предложено еще в начале 90-х годов XX столетия P. Layer и соавт. (1994) [9], по результатам отбора больных, у которых диагноз ИП формулировали при исключении приема любых доз алкоголя и при наличии даже подозрения на другую причину заболевания. На основании полученных данных удалось сформировать однородные группы больных с ИП и разделить заболевание на ранний и поздний ИП.
В литературе, как правило, предусматривают такое же разделение ИП[10]. При раннем хроническом ИП внешне- и внутрисекреторная недостаточность ПЖ, ее кальцификация развиваются медленнее, а болевой синдром интенсивнее, чем при позднем. Напротив, в половине случаев позднего хронического ИП боль отсутствует. При обеих формах кальцификация ПЖ происходит медленнее, чем при алкогольном хроническом панкреатите.
Своевременная диагностика ИП важна, но из-за сложности определения этиологии период между развитием первых симптомов хронического ИП и постановкой диагноза составляет в среднем 5 лет. Поздняя диагностика приводит к ухудшению течения панкреатита. Так, у более 50% больных с острым ИП развиваются повторные панкреатические атаки[11]. Опубликованы и совершенно противоположные данные, свидетельствующие о том, что только у одного из 31 пациента с первым эпизодом острого ИП возникает повторная панкреатическая атака в течение ближайших 36 месяцев. Такие противоречивые результаты могут быть связаны с тем, что обследование проведено в разных популяциях, а также с разными возможностями обследования больных.
Чем чаще развиваются острые панкреатические атаки, тем вероятнее, что сформируется хронический панкреатит с необратимыми морфологическими и функциональными изменениями ПЖ[8], наступят нарушения всасывания жирорастворимых витаминов, в том числе витамина D, с появлением предпосылок для развития остеопороза [12]. В связи с этим в некоторых клиниках стараются определить этиологию ИП «любой ценой», применяя небезопасные методы исследования у больных с рецидивирующими атаками острого ИП.
Такой подход, например, предлагают M. Kaw и G. Brodmerkel (2002) [13]. Авторы обследовали 126 больных с двумя и более эпизодами острого ИП. Они показали, что включение в обследование микроскопии желчи для выявления микролитиаза, секретинового теста, манометрии сфинктера Одди (СО) позволило выяснить этиологию заболевания у 79% пациентов. Было проведено лечение, которое обеспечило отсутствие панкреатических атак в течение 30 месяцев у более 60% больных[13]. В то же время подобное обследование не всегда безопасно для пациентов. Те же авторы отметили, что манометрия СО может вызвать разнообразные осложнения[13]. Следует также учесть, что выполнение таких сложных процедур, как манометрия СО, не всегда возможно, поэтому практическое применение результатов указанного выше исследования малореально.
Безусловно, врачу следует приложить максимум усилий для выяснения истинной причины панкреатита, чтобы изменить формулировку диагноза ИП и назначить правильное лечение. Ниже приводятся основные этиологические факторы, скрывающиеся под маской ИП (табл. 1).
Таблица 1
Этиология острого рецидивирующего идиопатического панкреатита (по J.K. Lee и R. Enns, 2007[1])
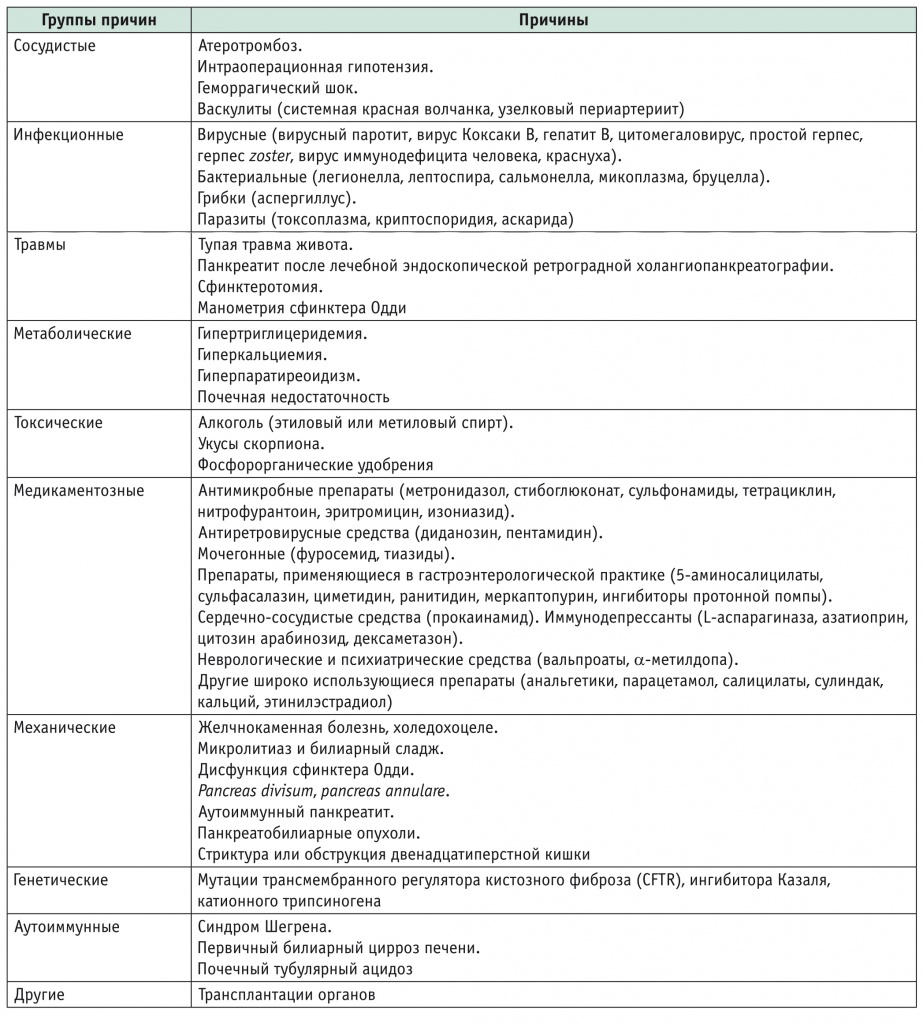
Алгоритм диагностического поиска при подозрении на ИП (рис. 1) предложен G. Blanco и соавт. (2019)[14].
Рис. 1. Диагностический алгоритм при подозрении на идиопатический панкреатит (по G. Blanco и соавт., 2019[14])
МУКОВИСЦИДОЗ
Первые упоминания об этом заболевании появились в Средние века. В преданиях европейских народов существовало поверье о том, что ребенок, при поцелуе которого ощущался соленый привкус, обречен на скорую смерть. Причиной считали смертельное проклятие, наложенное ведьмой. Понадобилось несколько столетий, чтобы сменить устоявшееся мнение: только в 1936 г. швейцарский педиатр Гвидо Фанкони описал ребенка, страдавшего кистозным фиброзом ПЖ и бронхоэктазами, причем заболевание носило семейный характер[15].
Немного позже, в 1938 г., американский патологоанатом Дороти Андерсен опубликовала монографию «Кистофиброз поджелудочной железы и его взаимоотношение с целиакией», в которой описала новую самостоятельную нозологическую единицу — «кистозный фиброз ПЖ». Спустя 8 лет другой американский специалист Сидни Фарбер (известный как основоположник современной химиотерапии и описавший редкое генетическое заболевание, названное позднее в его честь) предложил другое название болезни — муковисцидоз (МВ) (лат. mucus — слизь, viscidus — вязкий, липкий, клейкий), подчеркивая повышенную вязкость секретов экзокринных желез.
Лабораторные методы диагностики заболевания, широко известные потовый тест и генетический анализ, появились в 1953 и 1989 гг. соответственно.
В настоящее время активно функционирует профильная международная организация Cystic Fibrosis Foundation (CFF), имеющая представительства во многих странах мира. Только в 2018 г. CFF вложила более 180 млрд долларов в разработку новых методов лечения МВ и уход за пациентами, страдающими этой патологией[16].
На протяжении последних десятилетий благодаря усилиям ученых и врачей всего мира, появлению специфической генной терапии продолжительность жизни больных МВ значительно возросла[17]. Согласно данным Регистра больных МВ (2017), ведение которого осуществляет CFF, их средняя прогнозируемая выживаемость в 1993–1997 гг. составляла 31 год, тогда как средняя продолжительность жизни пациентов, рожденных в 2013–2017 гг., по прогнозам экспертов, возрастет до 44 лет[16].
Помимо увеличения продолжительности, представители CFF подчеркивают рост качества жизни больных МВ и их высокую социальную активность: 51% взрослых с этой патологией работают на протяжении всего дня или имеют частичную занятость, 43% женаты, а 31% больных МВ имеют ученую степень[16, 18].
Дефиниция
МВ — одно из самых распространенных аутосомно-рецессивных наследственных заболеваний, характеризующееся полиорганной патологией, вызываемое мутацией гена, кодирующего мембрано-ассоциированный белок, называемый муковисцидозным трансмембранным регулятором проводимости (Cystic Fibrosis Transmembrane Conductance Regulator, CFTR). CFTR является цАМФ-регулируемым каналом для ионов Cl–, регулирующим транспорт Cl– и Na+
через мембраны эпителиальных клеток.
Мутацию гена CFTR выявляют у 3% белого населения. По данным Регистра больных МВ, только в США в 2017 г. зарегистрированы 29 887 больных МВ, т. е. каждый 35-й американец является носителем дефектного гена[16]. Согласно сведениям CCF, каждый 20-й человек в мире — носитель гена МВ, и каждый день рождаются 125 человек с таким заболеванием[16].
Биология CFTR и возникновение муковисцидоза
CFTR представляет собой трансмембранный хлоридно(Cl–)-бикарбонатный(HCO3–) ионный канал, который экспрессируется на апикальной мембране эпителиальных клеток различных экзокринных органов, где он регулирует гомеостаз соли и жидкости[19, 20]. CFTR обнаружен в различных органах и тканях, включая бронхи, легкие, ПЖ, слюнные железы, пищевод, желудок, желчевыводящие пути, потовые железы, кишечник, почки, сердце, семявыносящие протоки. Уровень экспрессии CFTR в этих органах значительно варьирует: в слизистой оболочке желудка экспрессия CFTR наименьшая, тогда как на апикальной мембране холангиоцитов, проксимальных интралобулярных панкреатических протоках она наиболее высока[17]. Поэтому течение МВ часто осложняется развитием экзо- и эндокринной панкреатической недостаточности, подтверждающей важность функции CFTR в физиологии ПЖ[17].
С момента открытия в 1989 г. CFTR является одним из наиболее изученных белков. В настоящее время известно, что он состоит из пяти участков: двух трансмембранных доменов (TMD), двух цитоплазматических нуклеотид-связывающих доменов (NBD) и регуляторного домена (рис. 2).
Рис. 2. Структура гена CFTR (по материалам сайта Cystic Fibrosis Foundation, 2019[19])
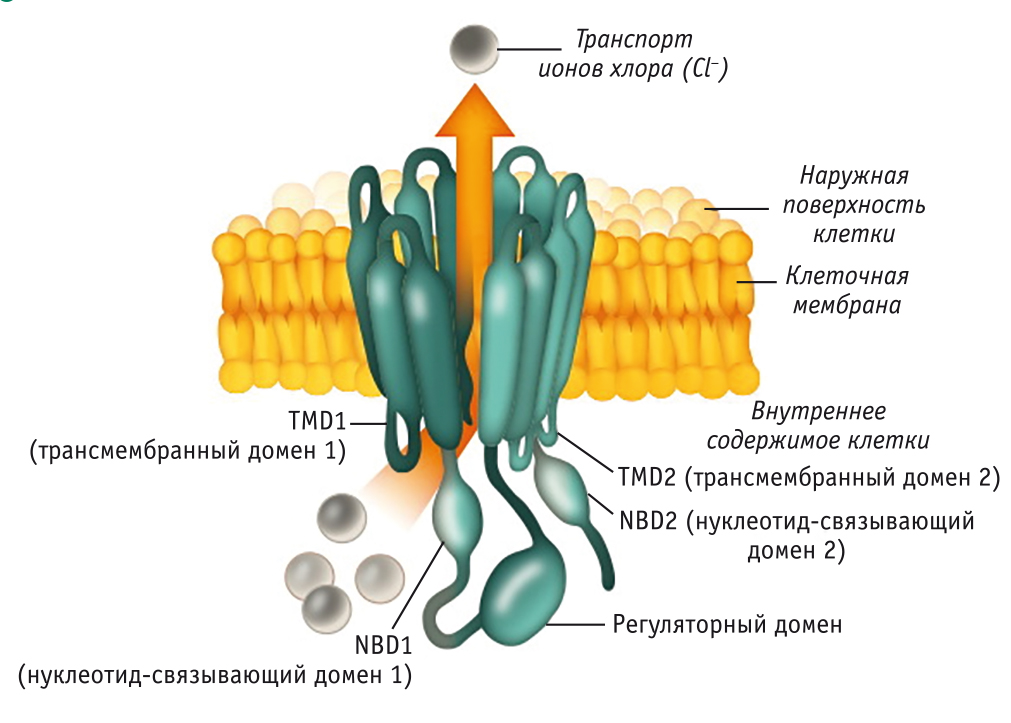
В нестимулированных клетках нефосфорилированный регуляторный домен связывается с NBD1, предупреждая взаимодействие NBD1 с NBD2 и АТФ-гидролиз, что необходимо для открытия канала. Другие регионы CFTR опосредуют взаимодействие «белок — белок» и стабилизируют CFTR на апикальной мембране[17].
Открытие канала и транспорт ионов хлора в околоклеточное пространство контролируются двумя внутриклеточными доменами (NBD1 и NBD2), которые способны связывать и гидролизировать АТФ. Регуляторный домен содержит сайты фосфорилирования, для активации которых необходимо наличие остатка фосфорной кислоты. NBD1 и NBD2 связывают и гидролизируют АТФ, вызывая открытие канала путем взаимодействия с трансмембранными доменами. Одна из молекул АТФ остается связанной с NBD1 в течение нескольких минут. За это время происходит несколько циклов открывания/закрывания канала, обусловленных связыванием и гидролизом второй молекулы АТФ. Таким образом, обеспечивается содержание достаточного количества ионов хлора в околоклеточном пространстве, необходимого для поддержания нормального осмотического давления и обеспечения циркуляции жидкости в околоклеточном пространстве.
Такой постоянный контролируемый поток ионов хлора является обязательным условием нормального функционирования эпителия бронхов, легких, кишечника, протоков ПЖ, яичников, потовых желез. При уменьшении концентрации ионов хлора в околоклеточном пространстве происходит активация эпителиального натриевого канала, обеспечивающего приток натрия в клетку. В итоге на поверхности клетки падает содержание NaCl, что вызывает снижение осмотической силы и количества воды, поступающей к клетке. Следствием этих изменений становятся «осушение» околоклеточного пространства и накопление слизистого, вязкого секрета[21].
Нарушение функционирования хлоридно-бикарбонатного трансмембранного канала связывают с мутацией гена CFTR. В настоящее время известно более 2000 мутаций в гене CFTR, но только 250–300 из них приводят к развитию заболевания, при этом наиболее распространены лишь 20 мутаций. В зависимости от последствий, к которым приводят нарушения в структуре гена, все мутации подразделяют на шесть классов[22].
Мутации I класса вызывают серьезное нарушение синтеза белка. Как правило, это нонсенс-мутации или мутации со сдвигом рамки считывания (появление лишнего или потеря одного либо нескольких (в числе, не кратном 3) нуклеотидов, приводящее к нарушению триплетного кода и неправильному считыванию мРНК, что обусловливает преждевременное введение стоп-кодона завершения, вызывающего нестабильность мРНК и ее деградацию) (рис. 3)[22, 23].
Рис. 3. Виды дефектов синтеза белка CFTR при муковисцидозе и соответствующие способы коррекции (по I. Pranke и соавт., 2019[23]).
Примечание: ПМ — плазматическая мембрана, NMD — nonsense-mediated mRNA decay (нонсенс-опосредованный распад микрорибонуклеиновой кислоты, мРНК)
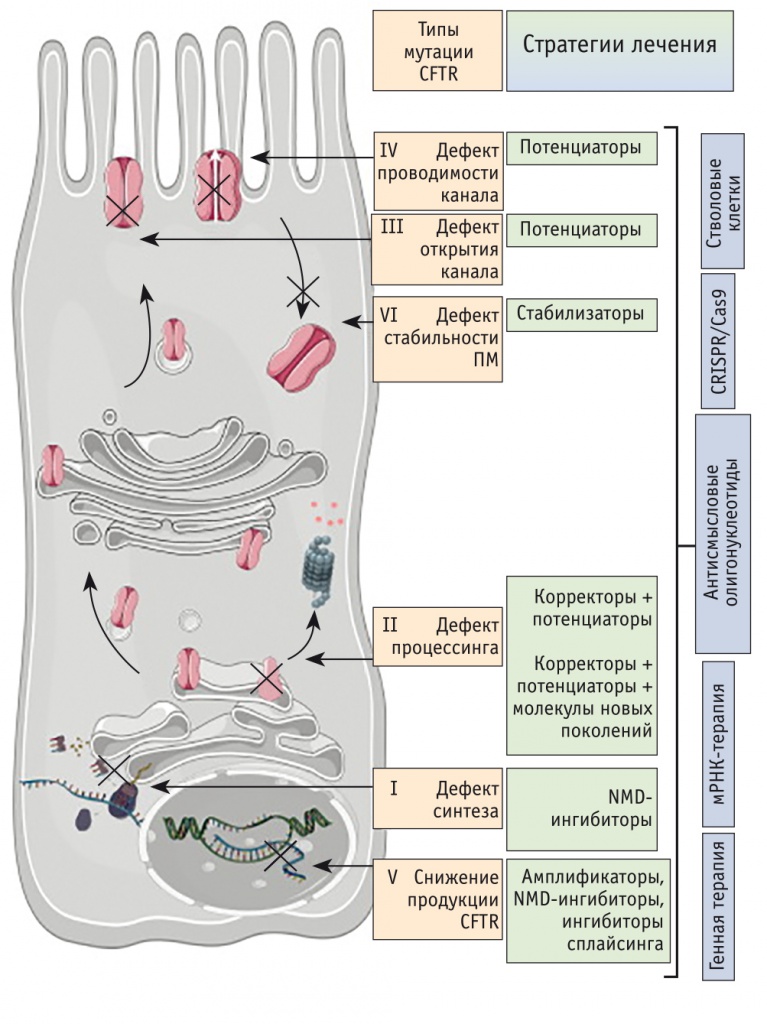
Мутации II класса опосредуют неправильное сворачивание белка и изменение процессинга CFTR. Основным примером мутаций этого класса является делеция аминокислоты фенилаланина в положении 508 (F508del-CFTR), которую обнаруживают почти у 80% больных МВ[22, 23]. Процесс созревания CFTR, характеризующийся сложным фолдингом (спонтанным сворачиванием полипептидной цепи) и двойным N-гликозилированием MSD2, начинается в эндоплазматическом ретикулуме во время трансляции и продолжается в аппарате Гольджи. Этот сложный процесс может нарушаться на разных этапах, что приводит к значимой (60–80%) деградации CFTR или даже к его аутофагии[23]. Дефектное сворачивание в эндоплазматическом ретикулуме вновь синтезированного F508del-CFTR вызывает нестабильность NBD1 и нарушение взаимодействия последнего с другими регионами CFTR. В результате дефектный белок не проходит «контроль качества» со стороны клеточных систем, получает убиквитиновую метку и транспортируется в протеасому, где разрезается на части протеазами[22, 23]. Поэтому вероятность эффективного транспорта нормального CFTR к апикальной поверхности плазматической мембраны из эндоплазматического ретикулума сравнительно невелика. Эта мутация также ассоциирована с ухудшением открытия Cl– канала и снижением стабильности CFTR в плазматической мембране.
Мутации III класса почти не затрагивают продукцию белка CFTR, локализованного в плазматической мембране, а изменяют процесс его активации, определяя продолжительное закрытие канала и тяжелое течение заболевания. Наиболее типичной мутацией в этом классе является замена глицина на аспарагиновую кислоту (1652G > A), которая происходит в критической точке на поверхности NBD1–NBD2, препятствуя АТФ-зависимому открытию канала[22, 23].
Мутации IV класса определяют дисфункцию каналов, приводя к недостаточно сильному току ионов хлора через открытый канал CFTR. При миссенс-мутациях этого класса на апикальной поверхности мембраны располагается белок CFTR с неизменной способностью к открытию, но обладающий остаточной активностью в отношении цAMФ-зависимой секреции Cl–. Как правило, такая мутация обусловлена заменой аргинина на гистидин в позиции 117, который локализуется в регионе TMD2, что уменьшает вероятность проводимости ионов Cl– и HCO3–[22, 23].
Мутации V класса характеризуются синтезом небольшого количества нормально функционирующего CFTR. Большинство из них являются интронными, индуцирующими инкорпорацию криптического экзона, или опосредующими мутацию экзонов, изменяющими участки слайсинга[5].
Мутации VI типа приводят к снижению стабильности белка CFTR на апикальной мембране, опосредуя его быстрое удаление с мембраны, преимущественно за счет усиленного эндоцитоза.
Мутации I–III классов провоцируют тяжелое течение МВ с отсутствием нормально функционирующего белка или синтезом CFTR, обладающего остаточной функциональной активностью. Мутации IV–VI классов сопряжены с сохранением достаточно высокой резидуальной активности и ассоциированы с более мягким течением заболевания.
Нарушение функции поджелудочной железы при муковисцидозе
CFTR играет основополагающую роль в продукции щелочной изотонической жидкости, секретируемой панкреатическими протоковыми клетками в ответ на прием пищи. Физиологическая функция этого щелочного секрета заключается в «смыве» пищеварительных проферментов из панкреатической протоковой системы в двенадцатиперстную кишку, нейтрализации кислого химуса, поступающего в проксимальную часть тонкого кишечника. При МВ изменяется качественный и количественный состав панкреатического секрета: снижается рН, уменьшается объем, увеличивается содержание белков, что способствует обструкции протоков ПЖ[24–27].
При прогрессировании заболевания плотный секрет (аномально уплотненные гранулы зимогена в сочетании с накоплением густой слизи, секретируемой эпителием протоков) способствует обструкции с последующей дилатацией ацинусов бляшками мукопротеинов, кальцификации, деструкции ацинусов, образованию кист в ПЖ. Эти патологические изменения, в свою очередь, вызывают повреждение и деструкцию эпителия в сочетании с воспалением и жировой инфильтрацией ПЖ, а впоследствии — генерализованный фиброз органа [28, 29].
При прогрессирующем течении МВ поражаются не только островки, но и протоки ПЖ: иногда на аутопсии «ткань ПЖ представляет собой редкие протоки в море жировой ткани, заменившей разрушенные протоковые клетки и островки»[30].
В зависимости от вида мутации CFTR клинические признаки поражения ПЖ выражены более или менее сильно. Как правило, 85% больных МВ являются носителями мутации I, II, III, IV и VI типа (при которых CFTR или отсутствует, или не функционирует полноценно) и страдают выраженной внешнесекреторной недостаточностью ПЖ (ВНПЖ), требующей пожизненной заместительной ферментной терапии (ЗФТ). В то же время пациенты с иными, менее значимыми мутациями CFTR, хотя и не имеют клинически выраженную ВНПЖ, не избегают поражения ПЖ. Деструкцию ПЖ можно обнаружить посредством определения концентрации сывороточного иммунореактивного трипсиногена, но у некоторых больных она может не достигать уровня, способного повлиять на протекание физиологических процессов пищеварения[31].
В ряде генетических исследований показано наличие значимой взаимосвязи между острым панкреатитом и мутациями CFTR, что неудивительно, учитывая ключевую роль CFTR в регуляции протоковой секреции ПЖ[32]. В ряде работ, выполненных под руководством M.J. DiMagno, установлено, что изменение экспрессии CFTR у нокаутированных или F508del-дефицитных мышей ассоциируется с избыточной экспрессией провоспалительных цитокинов и утяжелением течения острого панкреатита[33, 34].
МВ часто осложняется хроническим панкреатитом (ХП). При этом показано снижение концентрации HCO3– в панкреатическом секрете у больных ХП[17]. С другой стороны, доказано, что дефект секреции эпителиальной жидкости совместно с гиперсекрецией слизи приводит к накоплению муцина в малых протоках ПЖ, создавая условия для прогрессирования ХП[17]. Эти изменения ассоциируются с уменьшением интралюминального рН, ухудшением «смыва» панкреатических проферментов и формированием бляшек мукопротеинов на стенках панкреатических протоков[35]. Полученные данные подтверждают, что панкреатическая протоковая секреция HCO3–, образование жидкости и специфичность CFTR играют фундаментальную роль в патогенезе ХП, особенно у больных МВ[17].
При МВ патологические изменения происходят не только в протоковых клетках, но затрагивают и островки Лангерганса, провоцируя развитие МВ-ассоциированного СД (МВАСД). МВАСД является одним из самых распространенных осложнений МВ, которое диагностируют практически у 50% больных МВ[36, 37], при этом у детей, страдающих МВ, часто отмечают нарушение толерантности к глюкозе до развития клинически явного диабета[38]. ВНПЖ признана основным важным фактором риска развития МВАСД[39].
Почти у всех пациентов — носителей генотипов, определяющих тяжелое течение МВ, МВАСД развивается в конце первого года жизни, тогда как при наличии более легких мутаций сопутствующий СД возникает у 80% больных при достижении среднего возраста[40, 41]. Другие факторы риска — пожилой возраст, женский пол, сопутствующая гепатобилиарная патология, прием кортикостероидов.
Возникновение МВАСД сопряжено с ухудшением клинического прогноза для больных МВ, более частыми пульмонологическими обострениями, прогрессирующим снижением функции легких, ухудшением нутритивного статуса, уменьшением выживаемости, особенно среди пациентов женского пола. По данным некоторых авторов, даже нарушение толерантности к глюкозе, развивающееся задолго до возникновения МВАСД, ассоциировано с ухудшением течения МВ.
Доказано, что МВАСД неблагоприятно сказывается на функции легких и уровне смертности. У лиц с МВАСД усиливается легочная недостаточность и возрастает риск летального исхода по сравнению с таковыми у больных МВ, не имеющих нарушения углеводного обмена[42, 43].
Интересно, что МВАСД нельзя отнести ни к СД 1 типа, ни к СД 2 типа, так как он имеет признаки обоих: для него характерны и потеря функциональной массы β-клеток, и развитие инсулинорезистентности различной степени выраженности[41, 44].
Два основных механизма, которые, по мнению ученых, играют ведущую роль в появлении МВАСД, — это уменьшение количества островковых клеток и дисфункция β-клеток[36]. Снижение массы островковых клеток ассоциировано с прогрессирующей деструкцией эндокринной части ПЖ, жировой инфильтрацией и фиброзом органа, в ряде случаев — отложением амилоида в островках[36]. Безусловно, в развитии МВАСД большое значение отводят окислительному стрессу и воспалительным изменениям, происходящим в эндоплазматическом ретикулуме β-клеток[45, 46]. Хроническое воспаление — типичное патологическое изменение, характерное как для МВ ПЖ, легких, так и для МВАСД[47, 48]. Высказывается мнение, что CFTR может оказывать непосредственное влияние на секрецию инсулина в β-клетках[49], предрасполагая к развитию амилоидоза вследствие изменений рН внутри островков ПЖ.
Клинические «маски» муковисцидоза
Клинические симптомы МВ чрезвычайно многообразны. Наиболее типичным является развитие легочных проявлений заболевания у детей первого года жизни. Однако МВ может протекать под множеством других «масок», в том числе рецидивирующего бронхита, панкреатопатии, дискинезии желчевыводящих путей, бесплодия у мужчин и снижения фертильности у женщин (рис. 4)[50].
Рис. 4. Возможные клинические манифестации муковисцидоза (по G. Mansour, 2019[50])
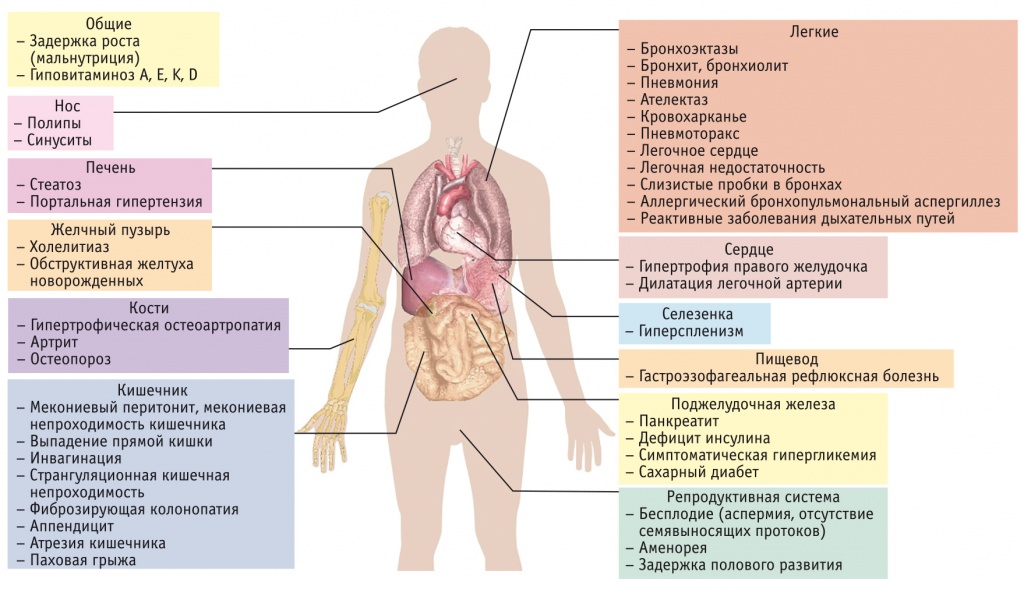
Как правило, МВ диагностируется в раннем детском возрасте, реже — у детей школьного возраста и подростков. Подавляющее большинство больных МВ к моменту достижения совершеннолетия уже имеют выраженные признаки легочной недостаточности, легочного сердца, у них деформируется грудная клетка, изменяются фаланги пальцев по типу «барабанных палочек». При длительном течении заболевания практически у всех пациентов отмечают небольшой рост, малый вес, обнаруживают поражение носоглотки, полипы носовой полости, синуситы.
Как утверждают эксперты CFF[15], если два родителя являются носителями мутации гена МВ, то вероятность рождения ребенка, больного МВ, составляет 25% (1 : 4), возможность появления малыша-носителя мутации, который не будет страдать МВ, — 50% (1 : 2). В то же время с вероятностью 25% можно ожидать, что рожденный ребенок будет полностью здоров, не будучи при этом носителем мутантного гена МВ.
Совершенно по-другому будет складываться ситуация, если один из родителей болен МВ, а другой — носитель мутации. В таком случае риск рождения ребенка, больного МВ, составляет 50% (1 : 2), при этом вероятность появления детей-носителей мутантного гена, которые не будут иметь яркой клинической симптоматики заболевания, также равна 50% (1 : 2).
Подчеркивая, что каждый 35-й американец является носителем мутантного гена CFTR, представители CFF отмечают высокую вероятность появления ребенка, больного МВ, в семье, члены которой ранее не имели подобного генетического заболевания[15].
Лечение муковисцидоза — роль заместительной ферментной терапии
Современное лечение МВ предполагает проведение генной терапии в зависимости от выявленной мутации и основывается на назначении специфических препаратов (потенциаторов, стабилизаторов, корректоров, амплификаторов и т. д.), способных уменьшить последствия дефектного синтеза белка CFTR. Несмотря на появление таких медикаментов, основополагающий постулат лечения МВ, предполагающий назначение ЗФТ, остался неизменным. В 2018 г. Европейское общество МВ (Еuropean Cystic Fibrosis Society, ECFS) опубликовало обновленную версию практического руководства, посвященного лечению МВ[51]. Европейские эксперты отмечают, что течение МВ может осложниться развитием панкреатита с ВНПЖ. В таком случае на первое место в клинической картине заболевания выходит абдоминальная боль, поэтому специалисты подчеркивают необходимость тщательного обследования больных с рецидивирующей необъяснимой абдоминальной болью, ассоциированной с тошнотой и рвотой.
Согласно положениям руководства ECFS, основные принципы лечения больных панкреатической формой МВ не отличаются от таковых при панкреатитах другой этиологии: обязательно проведение ЗФТ в соответствии с современными нормами терапии ХП[51]. Дополнительным условием коррекции явлений панкреатита у больных МВ становится тщательный контроль уровней электролитов и степени дегидратации с проведением регидратационной терапии[51].
В ряде рандомизированных контролируемых исследований убедительно показано, что ЗФТ оказывает благоприятное влияние на нутритивный статус, антропометрические показатели (рост) больных МВ, а также нивелирует гастроинтестинальные симптомы заболевания (табл. 2). Доказано, что ЗФТ позволяет значимо увеличить абсорбцию жиров и белков у лиц, страдающих МВ, по сравнению с плацебо (р < 0,001). Без проведения ЗФТ типичное значение коэффициента абсорбции жира (КАЖ) у больных МВ-ассоциированной ВНПЖ составляет 40–50%, тогда как назначение ЗФТ позволяет в ряде случаев добиться нормативных значений этого показателя или значительно его улучшить[52].
Таблица 2
Результаты рандомизированных контролируемых исследований эффективности заместительной ферментной терапии у больных муковисцидозом с сопутствующей внешнесекреторной недостаточностью поджелудочной железы
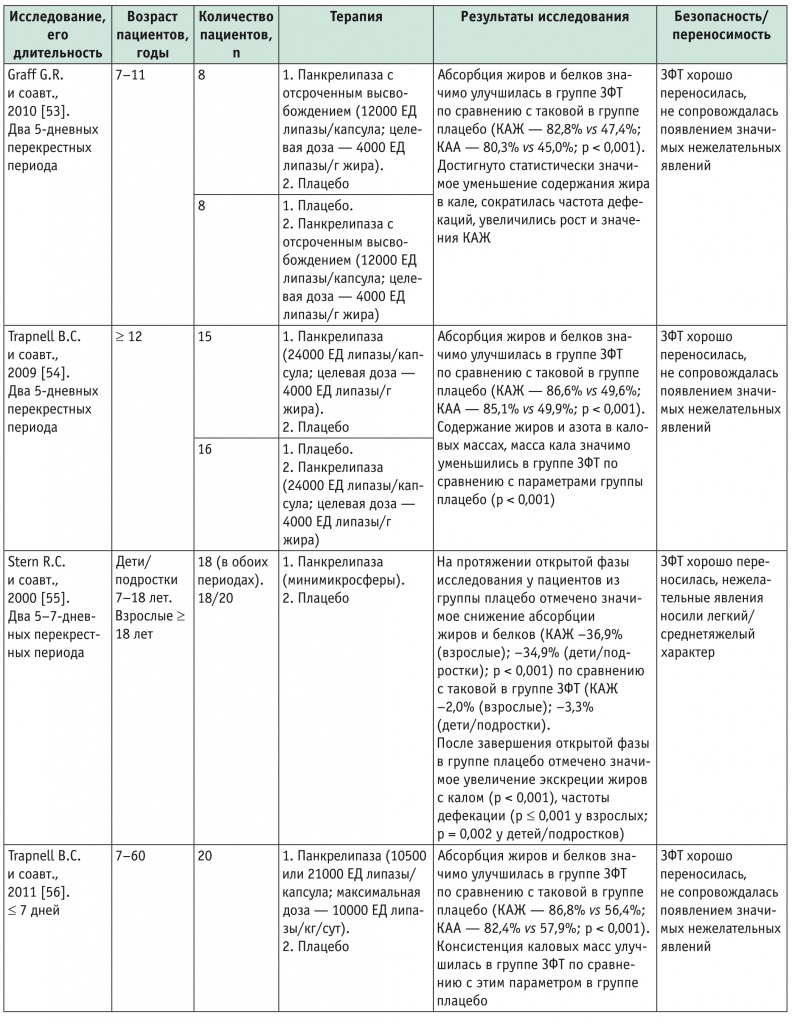
Примечание: ЗТФ — заместительная ферментная терапия, КАА — коэффициент абсорбции азота, КАЖ — коэффициент абсорбции жира.
Результаты кратковременных исследований (см. табл. 2) свидетельствуют, что при назначении ЗФТ больным МВ КАЖ варьирует в пределах 72,7–86,8%, а у пациентов, получающих плацебо, он составляет 47,4–62,8%. Подобные данные зарегистрированы и в отношении коэффициента абсорбции азота (КАА): прием ферментных препаратов позволяет поддерживать его в пределах 80,3–87,2%, тогда как в условиях отсутствия ЗФТ его значения составляют всего 45,0–65,7%[52]. Более значимая положительная динамика КАЖ и КАА отмечена при тяжелом течении заболевания, которое диагностировали при значениях КАЖ < 40% или ≤ 50%. Консистенция каловых масс, частота опорожнения кишечника, содержание жира в каловых массах — все перечисленные параметры улучшаются при проведении ЗФТ, также уменьшается выраженность других симптомов: абдоминальной боли, метеоризма[52].
Помимо увеличения КАЖ, ЗФТ позволяет улучшить антропометрические показатели — рост и вес пациентов. К сожалению, непосредственные доказательства наличия прямой связи между назначением ЗФТ и увеличением выживаемости больных МВ с ВНПЖ отсутствуют, однако существуют убедительные данные, подчеркивающие способность ЗФТ повышать качество жизни пациентов с МВ[57].
Эффективность и безопасность ЗФТ при МВ доказана экспертами Кокрановского сообщества. U.R. Somaraju и А. Solis-Moya (2016) представили результаты систематического обзора и метаанализа, основанного на результатах 1 параллельного и 12 перекрестных исследований, проведенных с участием взрослых и детей, больных МВ (n = 512), длительностью не более 4 недель[58]. В 10 исследованиях анализировалось достижение такой первичной точки, как пищевой статус.
Эксперты Кокрановского сообщества доказали, что проведение ЗФТ у больных МВ позволяет увеличить массу тела на 0,32 кг (95%-ный ДИ: –0,03 – –0,67; р = 0,07). Комбинированный анализ результатов нескольких исследований позволил установить, что статистически более значимые положительные результаты достигаются при применении микросфер с энтеросолюбильной оболочкой по сравнению с таковыми при использовании ферментных препаратов в виде таблеток с кишечнорастворимой оболочкой в отношении таких вторичных конечных точек, как частота опорожнения кишечника (средние различия (СР) –0,58; 95%-ный ДИ: –0,85 – –0,30; р < 0,0001), количество дней, прошедших с абдоминальной болью (СР –7,96; 95%-ный ДИ: –12,97 – –2,94; р = 0,002), экскреция жира с калом (СР –11,79 г; 95%-ный ДИ: –17,42 – –6,15 г; р < 0,0001)[58].
Анализ данных других небольших перекрестных исследований также подтвердил превосходство энтеросолюбильных микросфер над кишечнорастворимыми таблетками с адъювантным приемом циметидина для уменьшения частоты дефекации (СР –0,70; 95%-ный ДИ: –0,90 – –0,50; р < 0,00001).
Несмотря на эти данные, есть еще множество вопросов, на которые эксперты Кокрановского сообщества не смогли дать точные ответы: эффективность длительной ЗФТ при МВ, оптимальные дозы ферментных препаратов в зависимости от степени тяжести МВ и ВНПЖ, вида мутации, оптимальное время для инициации ЗФТ и приема ферментов на протяжении суток[58].
ЗАКЛЮЧЕНИЕ
Бурный рост медицинской науки открывает новую информацию о причинах и механизмах возникновения наследственных заболеваний, а также дает новые знания о возможностях их терапевтической и генной коррекции, улучшая качество жизни и ее продолжительность у пациентов, в т. ч. у больных муковисцидозом (МВ). Мы приводим основополагающие данные в отношении МВ.
- МВ — это самое распространенное аутосомно-рецессивное наследственное заболевание, вызванное мутацией гена CFTR, имеющее множество различных клинических проявлений.
- Несмотря на то что типичные проявления МВ предполагают поражение органов дыхания, поджелудочной железы (ПЖ) и кишечника, заболевание может протекать под различными масками, в т. ч. под маской идиопатического панкреатита.
- Простым диагностическим тестом, способным подтвердить диагноз МВ, является потовая проба. При получении сомнительных результатов потовой пробы необходимо проведение генетического анализа для выявления распространенных мутаций CFTR.
- В зависимости от выявленной мутации CFTR могут назначаться разнообразные виды генной терапии.
- Назначение заместительной ферментной терапии показано всем больным МВ, как взрослым, так и детям. Целесообразно в лечении таких больных использовать минимикросферические препараты панкреатина с энтеросолюбильной оболочкой — лекарственные средства, имеющие наивысший уровень доказательности.
- Высокая вероятность нарушения эндокринной функции ПЖ и развития МВ-ассоциированного СД определяет необходимость проведения скрининга уровней гликемии и гликозилированного гемоглобина.








