На сегодняшний день наблюдается значимое увеличение доли пациентов с патологией печени в структуре гастроэнтерологических больных. Нередко отмечаются случаи манифестации болезни сразу с цирротической стадии, протекающей ранее бессимптомно, что возможно объяснить значительным функциональным резервом печени[1–3].
Вирусные гепатиты В и С, неалкогольная жировая болезнь печени (НАЖБП), злоупотребление алкоголем — ведущие причины хронических заболеваний печени (ХЗП). Несмотря на успехи медицины в области лечения инфекционных болезней, сейчас в мире насчитывается более 300 млн человек, являющихся носителями различных вирусов гепатита (среди них 257 млн человек страдают хроническим гепатитом В и около 71 млн — хроническим гепатитом С)[4, 5].
У 25% пациентов с НАЖБП развивается фиброз печени (ФП), у десятой части больных за 10 лет стеатоз печени эволюционирует в неалкогольный стеатогепатит (НАСГ)[6]. В свою очередь, НАСГ в 10–25% случаев трансформируется в цирроз печени (ЦП)[7].
Следует отметить тот факт, что у значительного числа больных криптогенным ЦП присутствуют метаболические факторы риска, что свидетельствует о вероятной роли НАЖБП при данной патологии[8, 9]. До 10% трансплантаций связаны с ЦП в исходе НАЖБП[10].
Все пациенты с ХЗП (хроническими гепатитами, НАЖБП и др.) относятся к группе риска развития гепатоцеллюлярной карциномы[11–13]. ХЗП чаще страдают лица трудоспособного возраста[1, 14], данный факт обусловливает длительные периоды временной нетрудоспособности и инвалидизацию.
Важнейшие задачи здравоохранения в России — повышение эффективности лечения, оптимизация диагностики и профилактика ХЗП. Решение этих задач может способствовать более раннему и успешному лечению и скринингу пациентов с ХЗП.
В клинической практике при ХЗП получили распространение такие методы исследования, как лабораторные тесты (биохимический анализ крови с оценкой ферментов цитолиза, холестаза), различные инструментальные методы (УЗИ органов брюшной полости, ФГДС, КТ, МРТ), методы оценки степени ФП: пункционная биопсия печени (ПБП), фибротесты, фиброэластометрия; а также расчетные прогностические индексы: APRI, MELD, Child — Pugh.
Сейчас «золотым стандартом» верификации фиброза и уточнения его этиологии и выраженности является ПБП, поскольку используемые до настоящего времени методы исследования не в состоянии дать ответ на вопросы о действительном характере морфологических изменений печени при различных ее поражениях. Широко применяется прижизненное морфологическое исследование ткани печени для определения степени ФП и активности воспаления[15]. Метод обладает высокой специфичностью (до 99%) и чувствительностью (до 85%)[16], но при этом ПБП не дает информацию о функции печени.
К количеству материала при ПБП предъявляются строгие требования, несоблюдение которых может приводить к недостаточно корректным заключениям[17]. Метод является инвазивным, соответственно, способен вызвать осложнения (внутрипеченочную гематому, желчный перитонит, местное метастазирование при прицельной биопсии злокачественных опухолей, внутрибрюшное кровотечение, пневмоторакс) и даже летальный исход[18, 19].
Используемые в практике неинвазивные методы оценки ФП, такие как эластометрия и фибротесты, имеют свои лимитирующие факторы. Для эластометрии таковыми становятся ИМТ ≥ 28 кг/м2, активный гепатит, асцит, холестаз, венозный застой в системе воротной вены, недостаточный опыт оператора. Данные ограничения требуют технического совершенствования метода[20, 21].
Фибротест — специальный биохимический анализ крови, основанный на измерении уровней маркеров фиброза, воспаления и стеатоза (общего билирубина, АЛТ, α2-макроглобулина, гаптоглобина, аполипопротеина А1, γ-глютамилтранспептидазы (ГГТП) в крови пациента, — относится к малоинвазивным методам диагностики ФП и оценки некро-воспалительной активности в печени. Острый гепатит (любой этиологии) и внепеченочный холестаз являются состояниями, лимитирующими применение исследования. Метод не может считаться достоверным при наличии у пациента хронических воспалительных заболеваний соединительной ткани, например ревматизма, ревматоидного артрита, системной красной волчанки, склеродермии, а также при наследственных гипербилирубинемиях по типу синдрома Жильбера и гемолитической анемии[20, 21].
При невозможности выполнить ПБП в связи с противопоказаниями, недостоверностью результатов эластометрии при наличии у пациента ожирения или асцита в качестве альтернативы рассматриваются фибротесты. При комбинации неинвазивных тестов (эластометрии в сочетании с фибротестом) можно рассчитывать на высокие показатели чувствительности и специфичности, сопоставимые с показателями ПБП [21–23]. Данные методы также не позволяют оценить микросомальное окисление печени.
Ни один из используемых методов диагностики, зарегистрированных на территории Российской Федерации, не дает информацию о состоянии метаболизма и дезинтоксикации в печени. Для современной гепатологии актуально наличие высокочувствительного и специфичного метода, способного определять минимальные отклонения в функциональной активности печени.
В качестве альтернативы существующим методам выступает 13С-метацетиновый дыхательный тест (13С-МДТ). Метод был впервые описан P. Krumbiegel и соавт. в 1985 году[24]. С тех пор он считается полезным инструментом определения степени повреждения и функционального резерва печени. 13С-МДТ обладает высокой чувствительностью (до 92,6%) и специфичностью (до 84,1%) при определении ЦП, по данным Kibion — Wagner[25], способен оценить скорость и объем метаболизма в системе цитохрома P450 в печени.
В основе дыхательного теста лежит оценка количества выделяемой метки метаболизируемого субстрата в выдыхаемом воздухе. Субстрат после перорального приема всасывается, проходит через кровоток, затем проходит деметилирование в печени, затем в виде 13СО2 выводится через легкие. Метаболическую функцию печени определяют по объему и скорости выведения субстрата[26, 27]. Ряд европейских клиник применяют 13C-МДТ для количественной оценки функционального резерва печени при циррозе [28, 29].
Настоящее исследование направлено на обоснование использования данного метода в России.
Цель исследования: разработка алгоритма скрининга и обследования пациентов при помощи 13С-МДТ для оптимизации диагностики заболеваний печени.
Для достижения поставленной цели нужно было решить две задачи:
- оценить клинико-диагностические особенности применения 13С-МДТ при заболеваниях печени различной этиологии в зависимости от степени фиброза, наличия цирроза и активности воспаления;
- оценить возможность оптимизированного применения метода для характеристики функционального резерва печени и его прогностическую значимость при ХЗП.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на базе ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России в Санкт-Петербурге. Больных отбирали из числа обратившихся амбулаторно в консультативно-диагностические центры и в гастроэнтерологическое отделение стационара:
- 2016–2017 гг. — работа с литературой по теме исследования, освоение методики выполнения 13С-МДТ;
- 2016–2018 гг. — отбор пациентов;
2018 г. — статистический анализ полученных данных, представление результатов работы на профильных российских и международных конференциях.
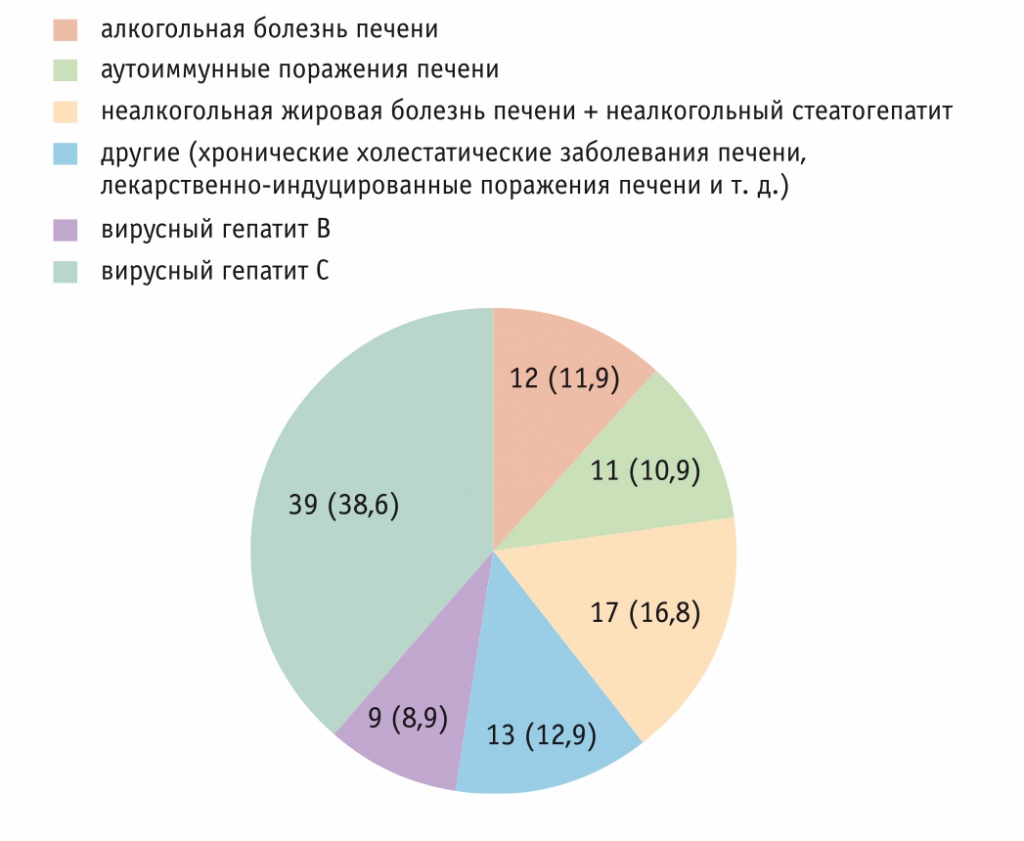
В исследование включен 101 пациент с ХЗП различной этиологии (рис. 1), из них 55 мужчин и 46 женщин, средний возраст составил 48 ± 14 года.
Рис. 1. Распределение пациентов в зависимости от этиологии заболеваний печени, n (%)
В зависимости от установленной степени фиброза больные были разделены на пять групп (рис. 2, 3).
Рис. 2. Группы пациентов с хроническими заболеваниями печени в зависимости от степени фиброза
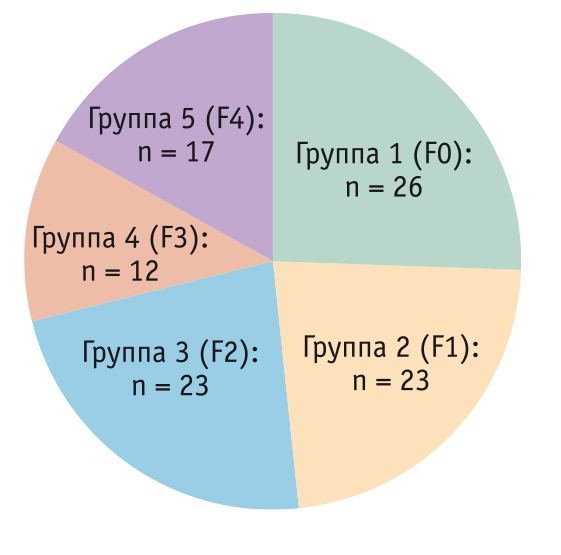
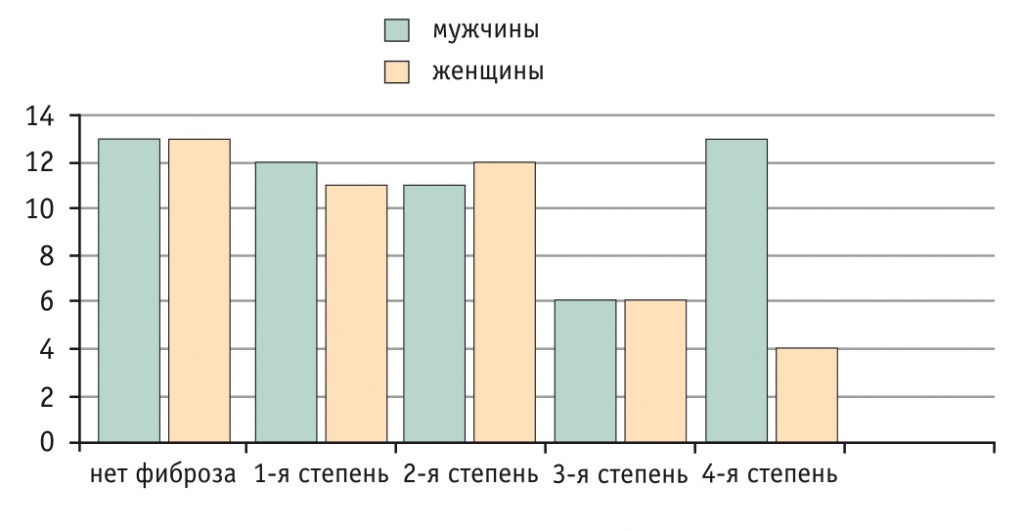
Рис. 3. Распределение включенных в исследование пациентов с хроническими заболеваниями печени по полу в зависимости от степени фиброза
Выполнялись сбор жалоб и анамнеза (наследственность, образ жизни, характер питания) и физикальное обследование больных для определения состояния пищеварительной системы. Использовались лабораторные методы — клинический анализ крови (тромбоциты, лейкоциты, гемоглобин), биохимический анализ крови (общий белок, альбумин, АЛТ, АСТ, щелочная фосфатаза (ЩФ), общий билирубин и его фракции, креатинин), коагулограмма (МНО, выявление коагулопатии); УЗИ органов брюшной полости (структура печени и ее размеры, наличие асцита, портальной гипертензии), ФГДС (исключение портальных гастропатий, варикозного расширения вен пищевода); эластометрия печени, или фибротест, или результаты ранее выполненной биопсии печени для оценки степени ФП, а также 13С-МДТ (изучаемый метод).
Критерий включения: установленный ранее диагноз ХЗП на основании комплексного обследования в соответствии с существующими стандартами (клинико-лабораторные анализы, генетические маркеры, УЗИ, эластометрия, фибротест (АктиТест), биопсия печени и т. д).
Критерии исключения: острый гепатит любой этиологии, ВИЧ-инфекция в стадии СПИД, возраст менее 18 и более 80 лет, тяжелые коморбидные патологии.
Все участники подписывали бланк добровольного информированного согласия на проведение всех необходимых процедур и манипуляций, а также согласие на обработку персональных данных. Исследование одобрено локальным этическим комитетом ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» (протокол № 10 от 09.11.2016 г.). Решение: планируемое исследование «Клинико-диагностическое значение 13С-метацетинового дыхательного теста при хронических заболеваниях печени» соответствует этическим нормам, изложенным в Хельсинкской декларации Всемирной медицинской ассоциации «Рекомендации для врачей, занимающихся биомедицинскими исследованиями».
13С-МДТ выполняется натощак. Препарат (13С-метацетин) применяется перорально с фиксированной дозировкой 75 мг на одно исследование в сухом виде, растворяется в 200 мл воды. Измеряется изотопный состав углерода в углекислоте выдыхаемого воздуха, что дает информацию о скорости печеночного метаболизма. Забор образцов выдыхаемого воздуха в 10 металлизированных пакетов производится в течение 2 часов — 1 раз перед приемом препарата, затем через каждые 10 минут в первый час исследования и через каждые 20 минут в течение второго часа. Исследование проводится на инфракрасном газовом анализаторе Iris, Германия. Результаты каждого исследования представляются в виде зависимостей скорости вывода экзогенной углеродной метки (PDR) от времени и суммарной доли выведенной метки от времени.
13С-МДТ проводили согласно стандартной схеме. Учитывались такие показатели теста, как кумулятивная доза (CUM) 13С (отражает объем метаболизированного субстрата, измеряется в процентах), доза в час (dose/h) (процент от введенной дозы метацетина) и дельта над исходным уровнем (DOB), выраженная в промилле, в течение 120 минут. С помощью 13С-МДТ у пациентов с ХЗП оценивали микросомальное окисление в печени, степень фиброза. Далее параметры 13С-МДТ сравнивали с клинико-лабораторными параметрами больных.
ПБП в ходе исследования не выполнялась, учитывались результаты ПБП, сделанной ранее. При отсутствии ПБП использовали другие методы определения степени ФП: фибротест, Фибромакс (стандартные методы расчета по формулам компании BioPredictive); эластометрию печени с функцией оценки стеатоза по скорости затухания ультразвуковой волны (CAP). Эластометрия выполнялась на аппарате FibroScan 502 Touch.
Размер выборки предварительно не рассчитывался. Использовались средние значения, медианы, сравнение двух независимых групп по одному признаку (критерий Стьюдента, критерий Манна — Уитни, χ2, точный критерий Фишера). Группы сопоставляли с помощью вариантного анализа (ANOVA) Кендалла, гамма, логистического регрессионного анализа.
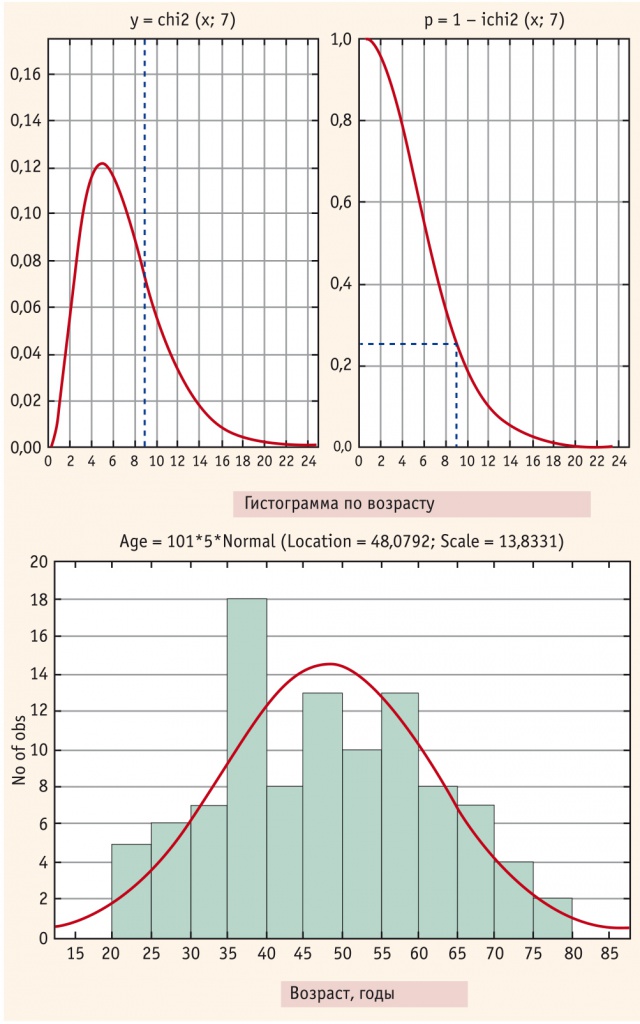
Статистическая обработка полученных результатов проводилась с применением программ Microsoft Office Excel 2010 и Statistica 10. Распределение соответствовало распределению χ2 (рис. 4) (Chi-Square = 8,97; степеней свободы 7, p = 0,25). Нормальным считалось распределение при p > 0,05. Парное сравнение групп производили с помощью t-критерия Стьюдента для независимых выборок; статистически значимыми считались различия при р < 0,05.
Рис. 4. Распределение выборки по возрасту
РЕЗУЛЬТАТЫ
Между первыми тремя группами (пациенты без фиброза, F1, F2) значимых различий в показателях 13C-MДT не было, однако тенденция к появлению таких различий при бо́льших выборках наблюдалась. Установлены статистически значимые различия между группой без ФП (группа 1) и с фиброзом 3-й степени (группа 4) по показателям DOB-40 (p = 0,019), DOB-80 (p = 0,020), DOB-100 (p = 0,028).
Между пациентами групп без фиброза и с фиброзом 4-й степени (ЦП) и больными групп F1 и F4 выявлены статистически значимые различия по всем параметрам 13C-MДT (значения p представлены в таблице 1).
Таблица 1
Сравнение показателей 13С-метацетинового дыхательного теста (13С-МДТ) пациентов в зависимости от степени фиброза (p value)
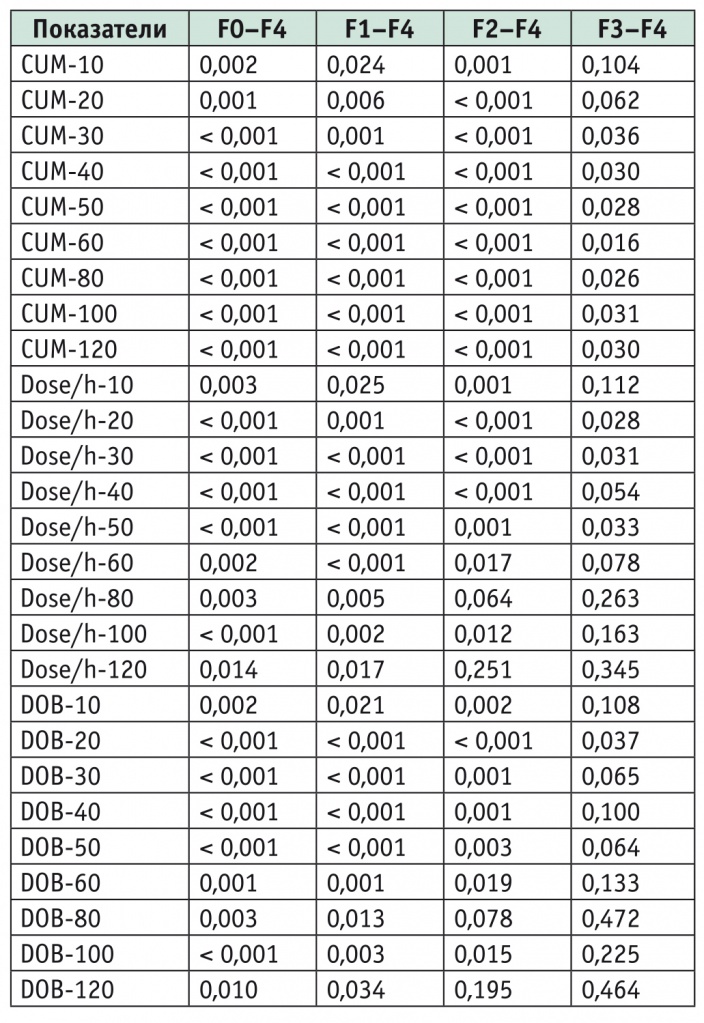
Примечание: р — вероятность ошибки первого рода; DOB-10, 20, 30, 40, 50, 60, 80, 100, 120 — дельта над исходным уровнем на 10-й, 20-й, 30-й, 40-й, 50-й, 60-й, 80-й, 100-й и 120-й минутах выполнения 13С-МДТ; Dose/h-10, 20, 30, 40, 50, 60, 80, 100, 120 — доза в час на 10-й, 20-й, 30-й, 40-й, 50-й, 60-й, 80-й, 100-й и 120-й минутах; CUM-10, 20, 30, 40, 50, 60, 80, 100, 120 — суммарная концентрация 13СО2 к исходу 10-й, 20-й, 30-й, 40-й, 50-й, 60-й, 80-й, 100-й и 120-й минуты выполнения 13С-МДТ.
У участников групп F1 и F3 существенно различались показатели дозы в час на 40-й минуте теста (p = 0,025) и дельта над исходным уровнем на 40-й минуте (p = 0,016), у пациентов с F2 и F3 — CUM от 30-й до 120-й минуты теста, доза в час на 20-й, 30-й, 50-й минуте, DOB-20. У больных групп F2 и F4 значимо различались все показатели 13C-MДT, кроме дозы в час на 80-й и 120-й минуте, DOB-80, DOB-120 (см. табл. 1).
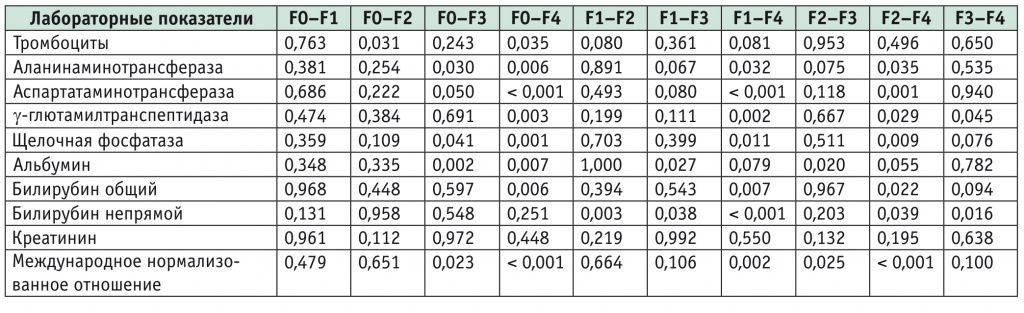
В ходе исследования сравнивались также уровни тромбоцитов, АЛТ, АСТ, ГГТП, ЩФ, альбумина сыворотки, билирубина общего, билирубина непрямого, креатинина, МНО (табл. 2).
Таблица 2
Сравнение лабораторных показателей в исследуемых группах (p value)
Далее с помощью статистического алгоритма «дерево решений» (decision tree analysis statistics), вариантного анализа (ANOVA) были выделены пороговые значения кумулятивной дозы в первые 30 минут теста. Если CUM-10 < 1, то риск наличия фиброза увеличивается в 2,5 раза, если CUM-20 < 2,5, риск тяжелого фиброза возрастает в 6,89 раза, если CUM-30 < 5,65, риск цирроза увеличивается в 23,3 раза (для всех случаев р < 0,01). На основании этих данных нами была разработана формула для оценки ФП в первые 30 минут 13С-МДТ, базирующаяся на впервые нами установленной взаимосвязи между снижением показателей кумулятивной дозы в первые 30 минут теста и риском наличия фиброза и цирроза у пациентов с ХЗП.
Затем была изобретена формула для определения степени фиброза:
N = 1a + 2b + 10c,
где N — сумма баллов; а, b и c — коэффициенты (%), рассчитываемые из CUM-10, CUM-20 и CUM-30.
При этом если CUM-10 < 1%, то a = 1; если CUM-10 ≥ 1%, то a = 0; если CUM-20 < 2,5%, то b = 1; а если CUM-20 ≥ 2,5%, то b = 0; если CUM-30 < 5,65%, то c = 1; если CUM-30 ≥ 5,65%, то c = 0. При N = 0 определяют степень ФП как F0, при N = 1–3 — как F1-2, при N = 10–13 — как F3-4. Предполагаемая чувствительность метода — 74%, специфичность — 85%.
Были построены и проанализированы графики распределения степени ФП в зависимости от тяжести дисфункции печени (ДП). ДП определялась относительно референтных интервалов показателя DOB (значение DOB-20, время достижения DOBmax, соответствие этих данных референтным значениям). В норме максимальное значение DOB должно быть выше 20,8 промилле, оно достигается к 10–20-й минуте исследования, затем снижается по экспоненте.
Распределение степеней фиброза в зависимости от тяжести нарушений микросомального окисления представлено на рисунке 5.
Рис. 5. Распределение степеней фиброза печени в зависимости от тяжести нарушения микросомального окисления (p < 0,05 по критерию Фишера)
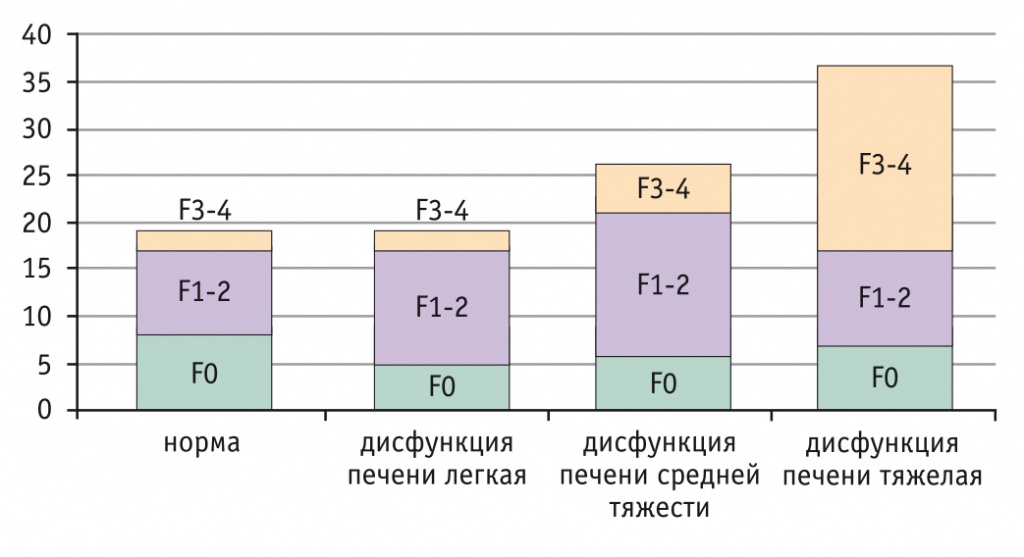
Исходя из приведенных показателей можно сделать вывод, что с увеличением тяжести ДП возрастает количество участников с фиброзом 3–4-й степени. Следует отметить, что у всех обследованных пациентов с ХЗП выявлено угнетение функционального резерва различной степени. Далее были определены степени фиброза по формуле, описанной выше (рис. 6).
Рис. 6. Распределение смоделированной (согласно формуле) степени фиброза в зависимости от тяжести дисфункции печени (p < 0,01 по критерию Фишера)
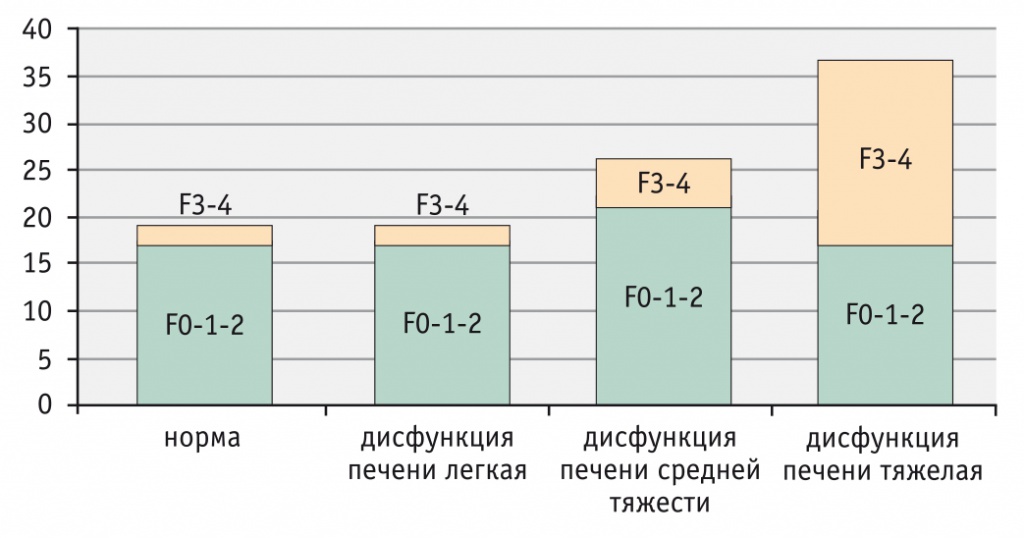
На основании вышепреведенной информации можно считать созданную нами формулу эффективным методом диагностики ФП 3-й степени и ЦП (F4). При помощи данного метода возможно неинвазивно определять степень ФП. Таким образом, исключается риск осложнений, сопровождающих ПБП: внутрибрюшного кровотечения, внутрипеченочной гематомы, пневмоторакса, желчного перитонита; также исключаются местное метастазирование при прицельной биопсии злокачественных опухолей, летальный исход.
При использовании описанной формулы сокращается время проведения 13С-МДТ. Возможность пройти тест амбулаторно, отсутствие необходимости высококвалифицированных специалистов для его выполнения, субъективности оценки результатов и увеличение комплаентности пациентов к обследованию позволяют нам считать этот метод оценки ФП перспективным для практикующих гастроэнтерологов и врачей других специальностей.
За время проведения исследования нежелательные явления, связанные с выполнением 13С-МДТ, не зафиксированы.
ОБСУЖДЕНИЕ
Получены убедительные данные о прогностической значимости 13С-МДТ при хронических диффузных заболеваниях печени. Исходя из этого разрабатывается алгоритм оказания медицинской помощи больным ХЗП и модель донозологической диагностики и скрининга с применением 13С-МДТ. Введение в клиническую практику нового метода оценки функции печени, ее функционального резерва позволит существенно улучшить диагностику у пациентов с ХЗП.
В ходе исследования получены результаты, позволяющие сократить проведение теста с 120 минут до 30 без потери диагностической эффективности. Рассчитанные в нашей выборке чувствительность и специфичность метода равны 74% и 85% соответственно, что не расходится с литературными данными[27–29]. Тенденция к появлению различий между больными с минимальными степенями фиброза требует проведения исследования на большей выборке. Эти результаты позволяют не только утверждать, что 13С-МДТ может быть внедрен в клиническую практику в Российской Федерации, но и предполагать возможности сокращения затрат на проведение теста при дальнейшем совершенствовании методики.
ЗАКЛЮЧЕНИЕ
Наличие хронических заболеваний печени (ХЗП) существенно повышает риск развития таких серьезных социально значимых заболеваний, как цирроз печени, гепатоцеллюлярная карцинома, и влияет на продолжительность и прогноз жизни больных. Растущая распространенность гепатитов (вирусных, алиментарно-токсических, аутоиммунных), неалкогольной жировой болезни печени, ожирения, метаболического синдрома, связанных с ними патологий, таких как СД 2 типа и сердечно-сосудистые заболевания, а также трудности диагностики и отсутствие достоверных высокоинформативных тестов для оценки функционального резерва при заболеваниях печени свидетельствуют об актуальности данной проблемы.
На основании литературных данных и полученных собственных результатов представляется значимым введение 13С-метацетинового дыхательного теста (13С-МДТ) в клиническую практику, так как он сопоставим по эффективности с существующими методами диагностики, при этом лишен присущих им недостатков, поскольку является неинвазивным, безопасным, репрезентативным и простым в исполнении. 13С-МДТ с успехом могут применять терапевты, врачи семейной медицины, гастроэнтерологи, инфекционисты. Его можно проводить и амбулаторно, и в стационаре, использовать для скрининга лиц без клинических проявлений ХЗП и для оценки эффекта терапии в динамике.








