ВВЕДЕНИЕ
Реальная возможность уменьшить смертность от рака пищеварительного тракта заключается в своевременной диагностике, лечении и профилактике предраковых изменений. В настоящее время все крупные международные клинические рекомендации утверждают, что пищевод Барретта (ПБ) является предраковым заболеванием пищевода[1–3]. Многократно более высокий риск развития аденокарциномы пищевода у пациентов с ПБ подтверждается в когортных исследованиях при пролонгированном наблюдении[4, 5].
Однако попытки установить биологические маркеры, определяющие уровень риска канцерогенеза у лиц с ПБ, до сих пор не привели к ощутимым результатам[6]. Несмотря на то что место оксидативного стресса в патогенезе рака пищеварительной системы не вызывает сомнений[7], конкретные исследования результатов свободнорадикального окисления у пациентов с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) являются единичными[8]. В этой связи уточнение характера изменений в показателях малонового диальдегида (МДА) и антиоксидантных ферментов при различных формах ГЭРБ является, безусловно, актуальным.
Цель исследования: изучить особенности показателей МДА и антиоксидантных ферментов у пациентов с различными вариантами ГЭРБ.
Дизайн исследования. Представлены результаты одномоментного сравнительного исследования продуктов перекисного окисления липидов и ферментов антиоксидантной защиты, определяемых методом иммуноферментного анализа (ИФА) в сыворотке крови и биоптатах дистальной части пищевода у 119 пациентов с четырьмя клиническими вариантами ГЭРБ: неэрозивной рефлюксной болезнью (НЭРБ), эрозивной ГЭРБ на стадиях A-B и C-D и пищеводом Барретта.
МАТЕРИАЛЫ И МЕТОДЫ
Мы обследовали 119 пациентов с различными клиническими вариантами ГЭРБ, серди которых были 61 мужчина и 58 женщин. Средний возраст пациентов составил 44,5 ± 1,7 года. НЭРБ была диагностирована у 42 человек (19 мужчин и 23 женщины; средний возраст — 45,6 ± 2,3 года), эзофагит в стадии A-B — у 27 лиц (14 мужчин и 13 женщин; средний возраст — 43,2 ± 2,1 года), эзофагит в стадии C-D — у 24 больных (13 мужчин и 11 женщин; средний возраст — 41,6 ± 2,5 года), ПБ — у 26 пациентов (15 мужчин и 11 женщин; средний возраст — 46,3 ± 2,7 года).
Клиническую симптоматику всех 119 пациентов изучали на основании стандартных анкет; пациентам проводили увеличительную и узкоспектральную эндоскопию пищевода на аппаратах GIF-XP190N, совместимых с системой EVIS EXERA III компании Olympus. У всех пациентов брали венозную кровь и биоптаты пищевода для определения содержания МДА, каталазы и супероксиддисмутазы (СОД). Гистологическое исследование биоптатов пищевода было выполнено при подозрении на ПБ у 29 человек.
Диагноз ГЭРБ устанавливали согласно рекомендациям Монреальского консенсуса[9]. Для диагностики эзофагита применяли лос-анджелесскую классификацию[10]. ПБ диагностировали на основании данных эндоскопии и морфологического исследования как участок цилиндрического метапластического эпителия дистального отдела пищевода (кишечной метаплазии), расположенный проксимальнее зоны пищеводно-желудочного перехода, имеющий длину не менее 1 сантиметра[1].
Критерии исключения из исследования: выраженная хроническая патология различных органов и систем, новообразования, инфекционные заболевания, перенесенные в течение последних 6 месяцев, дисплазия пищевода.
Для определения содержания МДА, СОД и каталазы биоптаты пищевода гомогенизировали в 0,05% трис-HCL-буфере (pH = 7,8). Гомогенат центрифугировали 10 минут при 1000 g; полученный супернатант вторично центрифугировали 10 минут при 14000 g. Приготовленную надосадочную жидкость использовали для определения биохимических показателей[11, 12]. Венозную кровь для определения МДА, СОД и каталазы забирали у пациентов из локтевой вены с 8 до 9 часов утра натощак и распределяли в пробирки Vacutainer с разделительным гелем и двойным активатором свертывания (кремнезем). Концентрацию МДА, СОД и каталазы в биоптатах пищевода и крови определяли методом ИФА на анализаторе «СтатФакс-3000» с помощью наборов Cloud-Clone Corp., США.
Пациентов обследовали с разрешения этического комитета ФГБНУ НИИ МПС (Протокол № 11 от 11.11.2016) и в соответствии со статьей 24 Конституции РФ и Хельсинской декларации Всемирной медицинской ассоциации, регламентирующей проведение научных исследований. Все обследованные были ознакомлены с целями, методами и возможными осложнениями в ходе исследований и подписали информированные согласия на участие в обследованиях.
Результаты оценивали согласно общепринятым методам статистического анализа. Статистическую обработку проводили на персональном компьютере при помощи пакета прикладных программ Statistica (версия 7,0). Для количественных показателей выборку описывали с помощью подсчета медианы (Ме) и интерквартильного размаха в виде первого и третьего квартилей (С25 и С75). Статистическую значимость различий между показателями независимых выборок оценивали по непараметрическому критерию Манна — Уитни. Достоверным считался уровень значимости при р ≤ 0,05.
РЕЗУЛЬТАТЫ
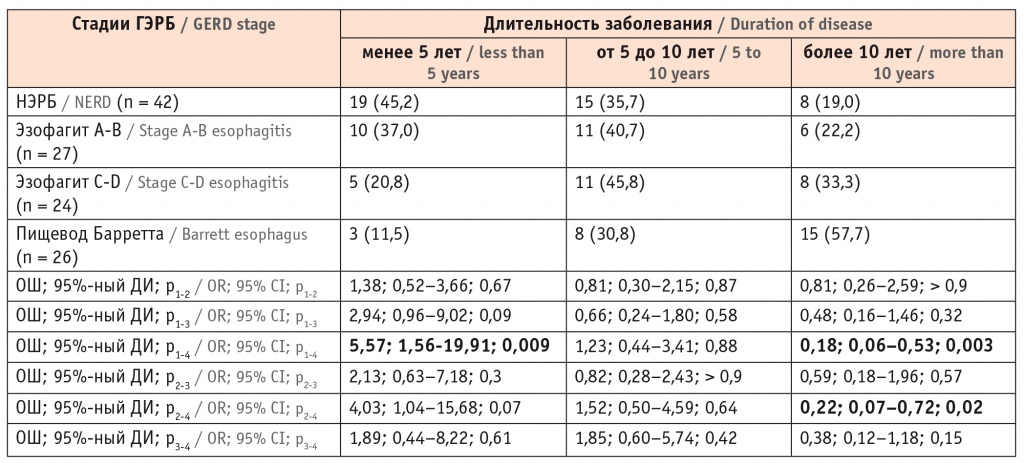
Мы проанализировали анамнестические данные и частоту симптомов у пациентов с различными вариантами ГЭРБ. Длительность заболевания была отчетливо более высокой у пациентов с ПБ по сравнению с больными НЭРБ и эзофагитом стадии A-B. Анамнез заболевания более 10 лет отмечался у 2/3 пациентов с ПБ и только у 1/5 пациентов с НЭРБ и эзофагитом стадии A-B (табл. 1).
Таблица 1
Длительность заболевания у пациентов с различными клиническими вариантами гастроэзофагеальной рефлюксной болезни, n (%)
Примечания.
- Здесь и в таблицах 2 и 3: уровень достоверности определен при помощи отношения шансов.
- Здесь и в таблицах 2 и 3: ГЭРБ — гастроэзофагеальная рефлюксная болезнь, ДИ — доверительный интервал, НЭРБ — неэрозивная рефлюксная болезнь, ОШ — отношение шансов.
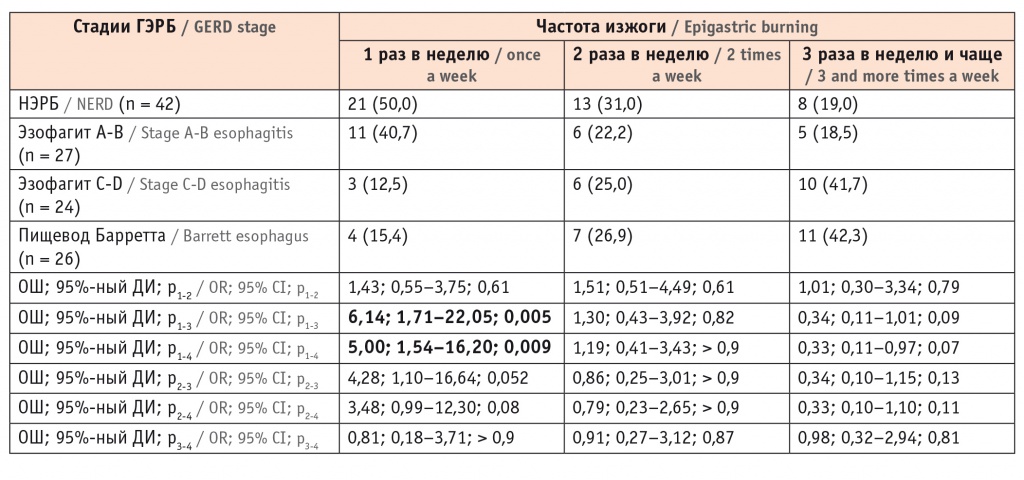
Частота еженедельной изжоги и отрыжки не имела существенных различий у пациентов с НЭРБ, эзофагитом и ПБ. Жалобы на дисфагию и одинофагию наблюдали только у пациентов с эзофагитом C-D и ПБ (табл. 2). При более подробном анализе было установлено, что частота изжоги 3 раза в неделю и больше регистрировалась в 2 раза чаще у больных эзофагитом C-D и ПБ, чем у лиц с НЭРБ и эзофагитом A-B (табл. 3).
Таблица 2
Частота пищеводных симптомов у пациентов с различными клиническими вариантами гастроэзофагеальной рефлюксной болезни, n (%)
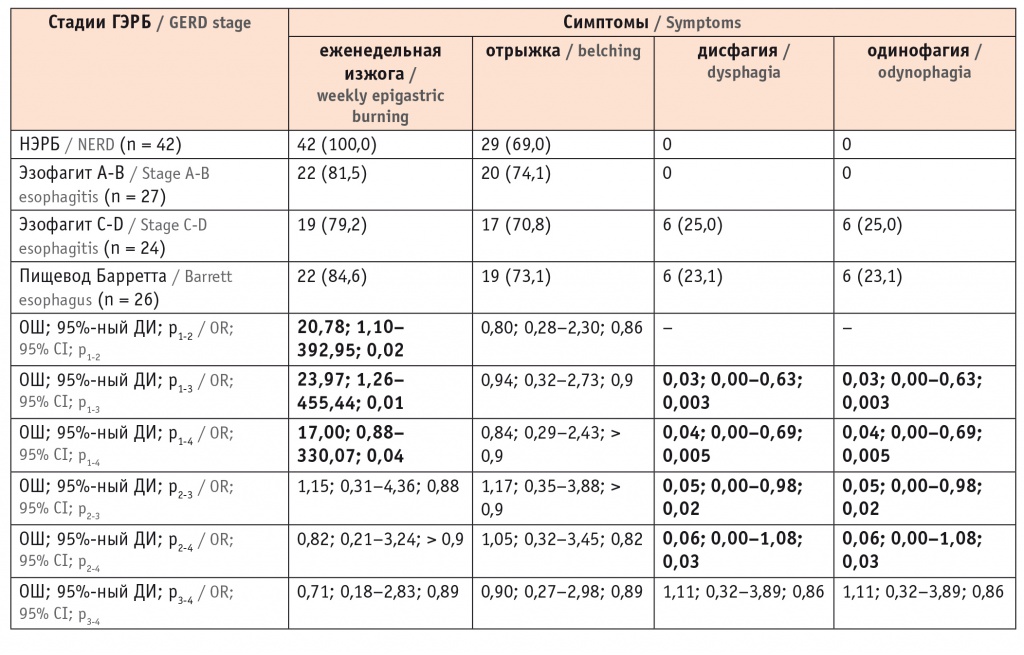
Таблица 3
Частота изжоги у пациентов с различными клиническими вариантами гастроэзофагеальной рефлюксной болезни, n (%)
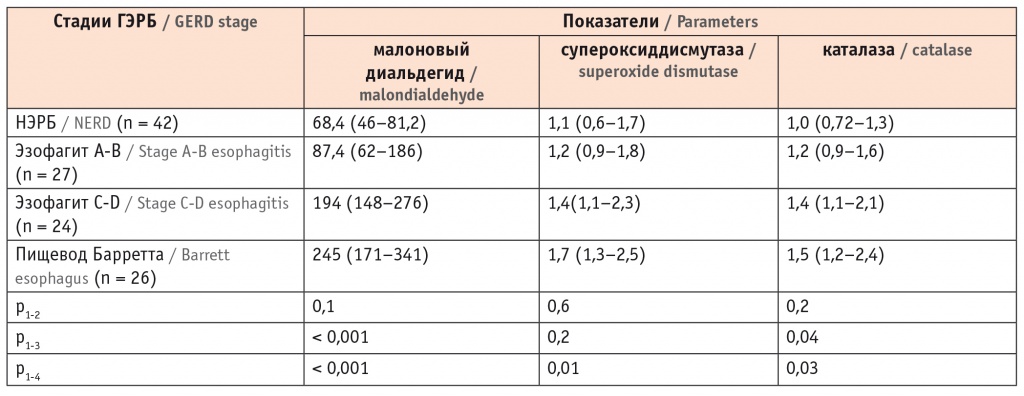
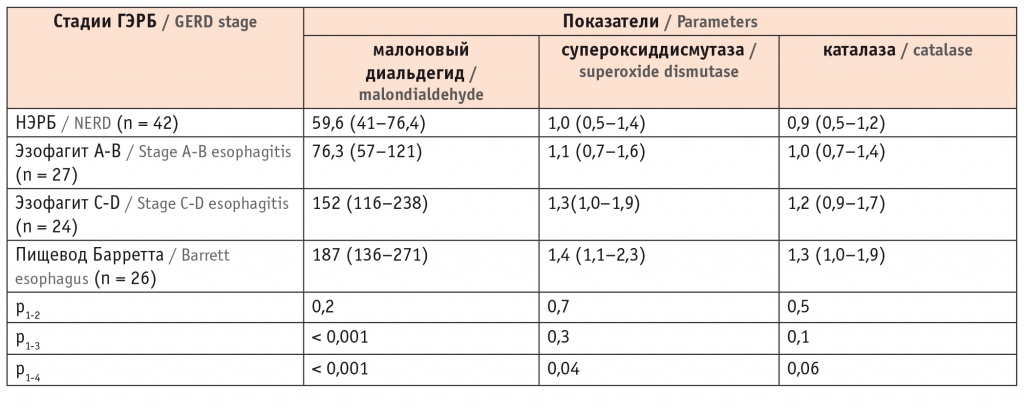
Мы обнаружили, что в биоптатах из слизистой пищевода содержание МДА значительно повышалось у пациентов с эзофагитом C-D и ПБ. Концентрация МДА у лиц с ПБ была в 3,6 раза выше, чем у пациентов с НЭРБ, а СОД и каталаза повышались в 1,5 раза (табл. 4). Это свидетельствовало о наличии выраженного оксидативного стресса у пациентов с предраковыми изменениями в пищеводе.
Таблица 4
Показатели малонового диальдегида и антиоксидантных ферментов в слизистой оболочке пищевода у пациентов с различными клиническими вариантами гастроэзофагеальной рефлюксной болезни, нг/мл (Ме, C25-C75)
Примечания.
- Здесь и в таблице 5 статистическую значимость различий рассчитывали с помощью критерия Манна ― Уитни.
- Здесь и в таблице 5: НЭРБ — неэрозивная рефлюксная болезнь.
В сыворотке крови регистрировались аналогичные, но менее выраженные изменения. Содержание МДА у больных с ПБ повышалось в 3,1 раза, а концентрация СОД и каталазы — в 1,4 раза (табл. 5). Это позволило считать, что оксидативный стресс был более выражен в слизистой пищевода по сравнению с показателями в сыворотке крови.
Таблица 5
Показатели малонового диальдегида и антиоксидантных ферментов в крови у пациентов с различными клиническими вариантами гастроэзофагеальной рефлюксной болезни, нг/мл (Ме, С25-С75)
ОБСУЖДЕНИЕ
Следует заметить, что существует точка зрения, согласно которой клиническая симптоматика у пациентов с ПБ не имеет специфических особенностей[13]. Мы получили другие результаты, указывающие на статистически значимо более высокую частоту изжоги — 3 раза в неделю, дисфагии и одинофагии у больных с метаплазией в пищеводе в сравнении с лицами с НЭРБ и пациентами с эзофагитом в стадии A-B. Подобные результаты мы ранее отмечали в других наших работах[14–16].
В настоящее время активно обсуждаются различные аспекты предраковых изменений в пищеводе[17, 18]. Ведется активный поиск различных биомаркеров для стратификации риска аденокарциномы пищевода[6]. Мнение об участии оксидативного стресса в развитии патологии сейчас является общепринятым[19]. Один из продуктов перекисного окисления липидов, МДА, обладает токсическим действием на митохондрии, плазматические мембраны, эндоплазматический ретикулум и пероксисомы, что, в свою очередь, активирует воспаление и провоцирует развитие рака.
Цитотоксическое действие МДА в настоящее время является хорошо документированным[20], но эти идеи до сих пор не применяются для понимания канцерогенеза в пищеводе. Вместе с тем повышение эффективности профилактики аденокарциномы пищевода возможно при определении факторов, влияющих на прогрессирование метаплазии в дисплазию и рак[21]. В то же время недостаточно работ, изучающих роль свободнорадикального окисления при ГЭРБ[8].
ЗАКЛЮЧЕНИЕ
Мы обнаружили увеличение длительности течения заболевания и более выраженную клиническую манифестацию у больных эзофагитом стадии C-D и ПБ. С нашей точки зрения, большое значение имеет продемонстрированное нами повышение концентрации МДА в биоптатах пищевода и крови у пациентов с эзофагитом C-D и ПБ. Очевидно, что пациенты с верифицированным оксидативным стрессом нуждаются в наиболее активном диспансерном наблюдении и дополнительных лечебно-профилактических мероприятиях. С нашей точки зрения, МДА можно применять в качестве биомаркера повышенного риска канцерогенеза в пищеводе.
Поступила: 15.04.2021
Принята к публикации: 26.06.2021








