Нестероидные противовоспалительные препараты (НПВП) обладают универсальным и уникальным для данного класса препаратов сочетанием анальгетического и противовоспалительного эффектов, что и объясняет лидирующее место НПВП в современной медицине. Анализ зарубежного и российского фармацевтических рынков показывает, что в последнее десятилетие представители этой группы препаратов занимают ключевые места по объему продаж1. Это обусловлено приверженностью к ним врачей многих специальностей и, безусловно, доступностью в связи с безрецептурным отпуском во многих странах, включая Россию.
Важно, что неуклонное постарение населения и рост распространенности коморбидности приводит к увеличению потребления НПВП[1]. Более того, решения руководства нашей страны об увеличении ожидаемой продолжительности жизни требуют повышения эффективности здравоохранения, в т. ч. системы лекарственного обеспечения[2].
На современном российском фармацевтическом рынке присутствует около 20 международных непатентованных наименований НПВП, не считая дженерических препаратов. Роль НПВП в практике врача любой специальности трудно переоценить, однако именно это и создает основную сложность при персонифицированном выборе адекватного терапевтического подхода. Принимая решение о назначении НПВП, врач любой специальности сталкивается с серьезной проблемой соотношения пользы и риска, особенно сложной для молодого врача[3]2.
МЕХАНИЗМЫ СЕРДЕЧНО-СОСУДИСТОЙ ТОКСИЧНОСТИ НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ ПРЕПАРАТОВ
Несмотря на гетерогенность класса НПВП, общим механизмом признается воздействие на фермент циклооксигеназу (ЦОГ). В 2021 г. исполнилось 30 лет с момента открытия двух изоформ ЦОГ — ЦОГ-1 и ЦОГ-2[4]. ЦОГ-1 (констуитивная) синтезируется постоянно в большинстве тканей, тогда как ЦОГ-2 (индуцибельная) экспрессируется при развитии воспаления под действием цитокинов, факторов роста, медиаторов воспаления, эндотоксинов и т. д.[4, 5].
Обе формы ЦОГ задействованы в метаболизме простагландинов (ПГ), играющих ключевую роль при воспалении (лихорадка, боль, отек, поствоспалительная пролиферация тканей). ЦОГ-2 экспрессируется в норме эндотелиальными сосудистыми клетками, которые синтезируют простациклин; соответственно, ингибирование ЦОГ-2 приводит к блокированию простациклина, что имеет большее значение для ЦОГ-2-селективных НПВП[5].
Возникающий дисбаланс простаноидов потенциально увеличивает риск тромботических осложнений и сердечно-сосудистых катастроф[6]. Частота подобных осложнений у пациентов, использующих НПВП, составляет 0,5–1,0 на 100 больных в год, что примерно в 4 раза больше, чем в общей популяции[7, 8]. Значимым фактором риска развития и прогрессирования как гастроэнтерологической, так и сердечно-сосудистой патологии считается бесконтрольный прием НПВП.
Еще одним значимым механизмом дестабилизации сердечно-сосудистой системы признается влияние на уровень АД, свойственное всем представителям НПВП[9]. Повышение АД опосредовано задержкой жидкости на фоне ингибирования ЦОГ в тканях почек и снижением натрийуреза и задержкой натрия и воды (до 30–50%), особенно при хронических заболеваниях почек, нередких при длительном приеме НПВП. Образующиеся в эндотелии сосудов ПГI2 оказывают сосудорасширяющее действие на периферические сосуды, а ингибирование его способствует вазоконстрикции и повышению АД из-за неконтролируемой вазоконстрикции под влиянием ангиотензина II и катехоламинов, повышению чувствительности рецепторов к действию вазоконстрикторных медиаторов, а также к росту сопротивления почечных сосудов.
ПГ коркового слоя почек и юкстагломерулярных клеток, в частности ПГE2 и ПГI2, играют важную роль в поддержании почечного кровотока и скорости клубочковой фильтрации, особенно на фоне приема диуретиков.
Ингибирование ЦОГ под воздействием НПВП может вызывать увеличение объема циркулирующей крови и клинически выраженную сердечную недостаточность (CH), особенно при желудочковой дисфункции[9]. Клинически дестабилизация АГ приводит и к снижению эффективности применяемых гипотензивных средств, в большей степени — влияющих на ренин-альдостерон-ангиотензиновую систему3.
НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ И АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Планомерная оценка влияния приема НПВП на течение АГ началась более 25 лет назад. Например, в ряде исследований выявлено, что у пожилых пациентов развитие АГ, потребовавшей назначения гипотензивной терапии, ассоциировано с приемом НПВП в среднем от 10% (ОР = 1,7)[10] до 29% случаев (ОР = 1,4)[11]. Более поздний и масштабный метаанализ (51 рандомизированное клиническое исследование (РКИ), n = 130 451) показал, что НПВП приводят к существенному увеличению риска развития или ухудшения течения АГ по сравнению с плацебо (ОШ = 1,49; 95%-ный ДИ: 1,18–1,88; р = 0,04) при отсутствии существенных различий между неселективными и ЦОГ-2-селективными НПВП (р = 0,23)[12]. Изучение воздействия НПВП на АД проведено на основании метаанализа 50 РКИ (n = 771)[13]. Обнаружено, что использование НПВП приводило к повышению АД как у нормотензивных пациентов, так и у больных с верифицированной АГ, при этом наиболее значимое повышение АД отмечалось при его недостаточном контроле (рис.).
Рис. Результаты метаанализа рандомизированных клинических исследований влияния нестероидных противовоспалительных препаратов на динамику артериального давления (по данным[13]).
Примечание: АГ — артериальная гипертензия, АД — артериальное давление, РКИ — рандомизированные клинические исследования
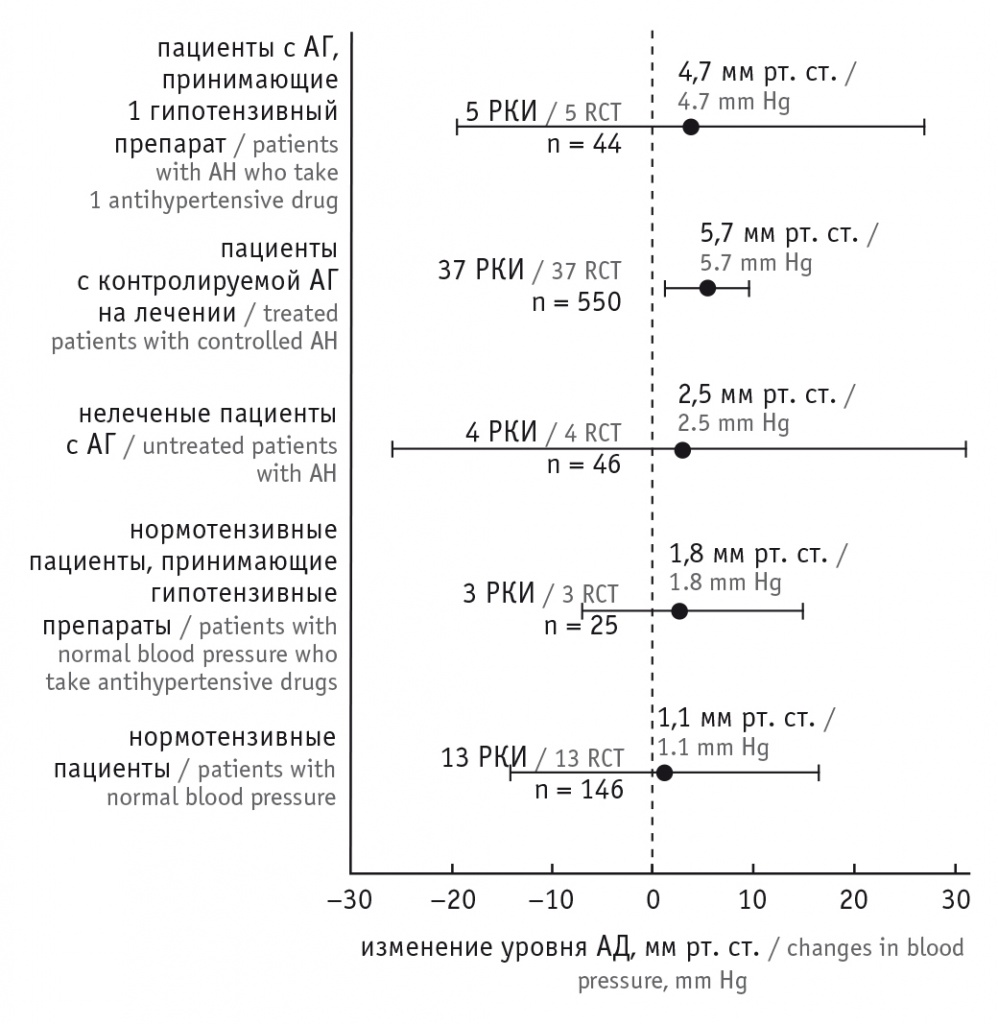
При этом отмечено меньшее влияние на АД при приеме умеренно селективного ингибитора ЦОГ-2 нимесулида. Российские исследования не выявили нарушений гемодинамики и дестабилизации АГ на фоне применения нимесулида. Так, в НИИ ревматологии им. В.А. Насоновой проведен ретроспективный анализ побочных эффектов у 322 пациентов с различными ревматическими заболеваниями и сердечно-сосудистой коморбидностью (ИБС, АГ), принимавших нимесулид более 1 года до поступления в клинику и продолживших его принимать в течение всей госпитализации. Выявлено, что даже столь продолжительный прием нимесулида не ассоциирован с высоким риском развития сердечно-сосудистых осложнений и дестабилизации АД[14].
В исследовании И.Б. Беляевой и В.И. Мазурова изучена безопасность применения Найза («Др. Редди’с Лабораторис», Индия) при длительной терапии хронической боли[15]. В исследовании сравнивали гемодинамические показатели у больных остеоартрозом (n = 40) на фоне использования в течение месяца Найза или диклофенака. При этом 23 пациента имели сопутствующую АГ.
У больных, получавших диклофенак, отмечено более значимое увеличение систолического и диастолического АД, как среднесуточного, так и среднедневного (p < 0,05), что сопровождалось ухудшением самочувствия. Одному больному без верифицированной АГ потребовалось назначение гипотензивной терапии. У пациентов с остеоартрозом и АГ, получавших Найз, статистически значимого увеличения АД не было.
У получавших диклофенак значимо увеличилось среднесуточное АД (p < 0,05), при этом индекс площади систолического АД за сутки вырос более чем в 2 раза (p < 0,05), а диастолического АД — почти в 3 раза (p < 0,05), что документировало стабильность повышения АД в течение суток.
Указанные изменения АД сопровождались ухудшением самочувствия, появлением одышки, отеков нижних конечностей. Пациентам требовалась коррекция гипотензивной терапии (увеличение дозы эналаприла или применение комбинированной терапии).
При изучении параметров системной гемодинамики в подгруппах больных, получавших Найз, существенные изменения не выявлены. У пациентов, получавших диклофенак, отмечено значимое (p < 0,05) увеличение общего периферического сопротивления, снижение параметров, отражающих общую производительность сердца: сердечного и ударного индексов, а также существенное увеличение объемов внеклеточной жидкости. При этом более значимая отрицательная динамика показателей системной гемодинамики была в подгруппе пациентов с АГ.
При сравнительном анализе влияния Найза и диклофенака на функцию эндотелия у пациентов с остеоартрозом и АГ установлено, что прием Найза не влиял на показатели эндотелий-зависимой и эндотелий-независимой (проба с нитроглицерином) вазодилатации, тогда как прием диклофенака способствовал изменению этих показателей и количества десквамированных эндотелиоцитов. При этом полученные данные были статистически значимыми (p < 0,05). Следовательно, неселективный ингибитор ЦОГ-2 диклофенак существенно ухудшает функцию эндотелия и способствует дестабилизации АД, в большей степени — у пациентов с АГ[16].
Р.М. Балабанова и М.В. Подряднова изучали коморбидность у 220 пациентов с подтвержденным анкилозирующим спондилитом (по Нью-Йоркским критериям), длительно получавших нимесулид (Найзy) в дозе 200 мг/сут или диклофенак в дозе 100 мг/сут, при этом отмечено, что терапия нимесулидом не приводила к повышению АД даже у больных, имевших в анамнезе АГ[17].
В открытое исследование Н.В. Чичасовой и соавт. включались больные ревматическими заболеваниями со стажем АГ не менее 5 лет, получавшие антигипертензивную терапию в течение не менее 6 месяцев, без признаков СН. Всем больным после трехдневного перерыва в приеме НПВП назначали случайным образом либо диклофенак в дозе 100–150 мг/сут, либо нимесулид в дозе 200–400 мг/сут на 20 дней. По истечении стартового периода в течение 1-й недели АД повышалось у пациентов обеих групп, однако систолическое и диастолическое АД в группе диклофенака увеличилось статистически значимо сильнее (p < 0,001), а в группе нимесулида практически не отличались от исходного.
У 16 из 20 больных, принимавших диклофенак, отмечено отрицательное влияние препарата на течение АГ: повышение АД, головная боль, кардиалгии, развитие гипертонического криза (n = 2), потребовавшее отмены диклофенака, рост потребности в антигипертензивных препаратах (n = 6).
У получавших нимесулид не выявлены случаи значимого изменения АД и роста потребности в антигипертензивной терапии, все 20 больных закончили 3-недельное лечение. Диклофенак был отменен у 8 пациентов в связи с изменением течения АГ, головной болью, желудочно-кишечными осложнениями. Увеличение среднесуточного систолического АД у больных, закончивших лечение диклофенаком, было статистически значимым и составило 15,74 ± 11,0 мм рт. ст. (p < 0,05), тогда как к концу лечения нимесулидом данный показатель равнялся 1,71 ± 5,22 мм рт. ст. (р > 0,05)[18].
НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ И ТРОМБОЭМБОЛИЧЕСКИЕ ОСЛОЖНЕНИЯ (ИНФАРКТ МИОКАРДА, ИНСУЛЬТЫ)
В настоящее время как отечественные, так и зарубежные авторы признают, что все НПВП, независимо от механизма их действия, могут негативно влиять на сердечно-сосудистую систему, тромбоэмболические осложнения вызывают и селективные, и неселективные НПВП[19]. В исследовании MEDAL частота тромботических сердечно-сосудистых событий была сходной в группах диклофенака и эторикоксиба (OP = 0,95; 95%-ный ДИ: 0,81–1,11)[20].
По данным масштабного исследования риска острого инфаркта миокарда (ОИМ) у пациентов, получавших более 30 различных НПВП (включены 100 баз данных европейских стран: 79 553 пациента, получавших НПВП, и 7 448 603 не получавших), наиболее высокий риск ИМ отмечен при использовании кеторолака, индометацина, эторикоксиба, а наименьший — при применении целекоксиба и нимесулида[8]. Особенно высоким оказался риск осложнений у больных, ранее перенесших ИМ и/или операции на сердце и сосудах: он составлял для целекоксиба, диклофенака и ибупрофена 2,57, 2,40 и 1,50 соответственно[21].
В крупном метаанализе P. Kearney и соавт. (138 РКИ; n = 145 373) оценено влияние НПВП и коксибов, в частности, на риск ИМ: общий риск для коксибов составил 1,89 (р = 0,0003), для диклофенака — 1,63, для ибупрофена — 1,51[22].
Вероятность неблагоприятных сердечно-сосудистых исходов и осложнений в виде кровотечений не коррелирует с ЦОГ-селективностью и продолжительностью приема НПВП[23]. Эти результаты подтверждает крупнейший метаанализ 2013 г. (280 РКИ и 474 сравнительные работы). У больных, принимавших селективные НПВП, сердечно-сосудистые катастрофы возникали с такой же частотой, как и у пациентов, принимавших неселективные НПВП. Увеличение сердечно-сосудистого риска не зависело от исходного статуса пациента (имевшего/не имевшего сердечно-сосудистые риски)[24].
В исследовании А. Helin-Salmivaara и соавт. риск развития сердечно-сосудистых нарушений был чуть выше при применении индометацина, ибупрофена, диклофенака, напроксена, эторикоксиба, чуть ниже — при приеме кетопрофена, целекоксиба, нимесулида[25]. Схожие результаты представлены в публикации A. Arfè и соавт.: наименьший риск сердечно-сосудистых осложнений наблюдался при приеме кетопрофена, целекоксиба, нимесулида, а наибольший — при использовании кеторолака, индометацина, диклофенака, эторикоксиба[26].
Доказано, что нимесулид не повышает частоту тромбозов в отличие от других селективных ингибиторов ЦОГ-2[7]. Умеренная селективность нимесулида в меньшей степени затрагивает ЦОГ-2-зависимое подавление синтеза простациклина. Особенно важным учет протромбогенных эффектов НПВП становятся для пациентов, всю жизнь принимающих ацетилсалициловую кислоту (АСК): необходимо сбалансировать потенциальные риски побочных эффектов НПВП с эффектами пожизненно принимаемых низких доз АСК[27].
У женщин в менопаузе, принимающих АСК, использование селективных НПВП ассоциировано с более высоким риском сердечно-сосудистых катастроф, чем при приеме неселективных НПВП[28]. АСК способствует уменьшению вероятности неблагоприятных сердечно-сосудистых событий на фоне приема средств заместительной гормональной терапии, но избирательное ингибирование ЦОГ-2 селективными НПВП увеличивает число неблагоприятных сердечно-сосудистых событий. Эти данные получены в ходе исследования с участием 160 801 женщины в постменопаузе (средний срок наблюдения — 11,2 года) и стали ключевыми в проекте «Безопасность нестероидных противовоспалительных препаратов» в США[29].
Риски ОИМ при приеме отдельных НПВП оценены и в исследовании C. Varas-Lorenzo и соавт.: метаанализ 25 популяционных исследований, 18 независимых популяций и около 100 000 случаев фатального и нефатального ИМ. Наименьшим риском сопровождалось применение напроксена, а ОШ составило для мелоксикама 1,25, для диклофенака — 1,37, для эторикоксиба — 1,9[30].
Безусловно, необходимо помнить, что сочетанное применение НПВП и АСК значимо увеличивает и риски со стороны верхних отделов ЖКТ, что требует учета коморбидности, применения селективных НПВП и ингибиторов протонной помпы[31]. В крупных наблюдательных исследованиях рисков церебральных катастроф выявлены более высокие риски инсульта при применении НПВП. Механизмами развития инсультов, ассоциированных с применением НПВП, так же как и ИМ, признаются предрасполагающий к атеротромбозу дисбаланс в системах ЦОГ-1/2, простациклина и тенденция к повышению АД и развитию АГ.
В ретроспективном исследовании (n = 40 000) для инсультов всех типов риск оказался увеличен при приеме НПВП (ОР = 1,2)[32]. В известном Роттердамском исследовании при наблюдении за 7636 пациентами за 10 лет (70 063 пациенто-лет) определен риск инсульта для неселективных НПВП 1,72, а для коксибов — 2,75[33].
В ретроспективном наблюдательном исследовании в когорте 384 322 пациентов также выявлен высокий риск инсульта для коксибов — ОР = 1,6[34]. Метаанализ 6 наблюдательных и когортных исследований по сравнительной оценке риска инсульта показал значимое повышение его для рофекоксиба (ОР = 1,64) и диклофенака (ОР = 1,24), а для других препаратов — лишь небольшое увеличение риска в диапазоне 9–19%[35].
В другом метаанализе риск геморрагического инсульта для всей группы НПВП увеличивался на 9% (статистически незначимо), но для диклофенака (ОР = 1,27) и мелоксикама (ОР = 1,27) это повышение оказалось статистически значимым[36].
НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ И СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Патогенез неблагоприятных эффектов НПВП при развитии или прогрессировании СН связан с описанными ранее действиями на натрийурез, АД, состояние сосудистой стенки и ткань почек. Эти эффекты свойственны как селективным, так и неселективным НПВП.
Самые ранние сообщения о взаимосвязи приема НПВП и развития СН основаны на крупном когортном наблюдательном исследовании (1986–1992) 10 519 пациентов старше 55 лет, у которых был отмечен значимо увеличенный риск госпитализации в связи с ХСН — более чем в 2,2 раза[37]. Далее эти данные подтвердились: у 1023 пожилых пациентов риск госпитализаций в связи с ХСН на фоне приема НПВП достигал 2,1, однако был равен всего 1,6 у больных без анамнеза сосудистой патологии и 10,5 при наличии сердечно-сосудистых заболеваний[38].
Данные когортного исследования (1995–2004, n = 107 092) свидетельствуют об увеличенном риске госпитализаций в связи с ХСН для разных НПВП: 1,16 для ибупрофена и 1,18 для напроксена, 1,24 для целекоксиба, 1,35 для диклофенака, 1,40 для рофекоксиба (р < 0,05–0,01)[39]. Дополнительный анализ позволил уточнить, что в первый месяц применения НПВП риск развития ХСН еще более высок: 2,39 для рофекоксиба, 1,97 для диклофенака, 1,86 для целекоксиба, 1,41 для ибупрофена, но не для напроксена (ОР = 1,02)[39].
В настоящее время опубликованы два крупных метаанализа связи приема НПВП и риска СН: в первом из них проанализированы 7 исследований с участием 7 543 805 пациентов, случаи первичной госпитализации в связи с развитием ХСН; ОР развития ХСН составил 1,17 (р = 0,04), в том числе для неселективных НПВП ОР = 1,35 (р = 0,0002)[40]. Во втором метаанализе изучены риски обострения имеющейся ХСН на фоне применения НПВП: включены 6 исследований с участием 161 472 пациентов с компенсированной ХСН[41]. Риск обострения ХСН составил 1,39 для традиционных НПВП (р < 0,0001), 1,34 для целекоксиба (р = 0,07) и 2,04 для рофекоксиба (р < 0,00001).
Еще один анализ влияния приема НПВП на развитие или прогрессирование СН у 92 163 больных в 4 европейских странах выявил, что риск СН при использовании нимесулида оказался ниже (ОР = 1,18), чем у индометацина (ОР = 1,51) и эторикоксиба (ОР = 1,51)[26].
ОБСУЖДЕНИЕ
В настоящее время ученые пришли к заключению, что профиль безопасности современных НПВП лучше при сбалансированном ингибировании ЦОГ-1 и ЦОГ-2. Например, нимесулид в терапевтических дозах ингибирует около 88% активности ЦОГ-2 и 45% активности ЦОГ-1, при этом длительность воздействия на ЦОГ-2 значительно превышает период воздействия на ЦОГ-1, что также может объяснять низкую частоту развития нежелательных реакций со стороны ЖКТ и кардиоваскулярную безопасность.
К достоинствам нимесулида можно отнести и короткий период полувыведения: у короткоживущих НПВП безопасность выше, так как они быстро всасываются и элиминируются, не аккумулируясь в организме, особенно при наличии хронических нарушений функции почек и/или печени. Период его полувыведения составляет 1,8–4,7 ч, т. е. срок воздействия на ЦОГ-1 достаточно короток, и молекулы ЦОГ-1 получают возможность быстрого ресинтеза. А в очаге воспаления воздействие на ЦОГ-2 продолжается до 8–12 ч, обеспечивая мощные противовоспалительный и аналгезирующий эффекты[42].
Благодаря своим биохимическим свойствам нимесулид быстро попадает в очаг воспаления: через 30 мин после перорального приема его концентрация в плазме и синовиальной жидкости достигает 80% от максимальной, а полный терапевтический эффект отмечается через 1–3 ч. Безусловно важным признается и широкий спектр дополнительных эффектов, не опосредованных ингибированием ЦОГ[43].
Все эти преимущества нимесулида подкрепляются и благоприятным профилем безопасности в отношении ЖКТ и сердечно-сосудистой системы, что подтверждено крупными рандомизированными исследованиями и метаанализами и данными локальных российских исследований[14–16]4. Эффективность и безопасность нимесулида послужили обоснованием приверженности отечественных ученых и врачей разных специальностей к использованию нимесулида в своей практике[44, 45].
К аргументам в пользу нимесулида относятся и невысокие риски межлекарственных взаимодействий, что обусловлено особенностями строения молекулы, не требующей участия в метаболизме ни гликопротеина Р, ни цитохрома CYP2C9, являющегося основным цитохромом метаболизма большинства НПВП[46].
ЗАКЛЮЧЕНИЕ
Крупными международными рандомизированными исследованиями и метаанализами, а также данными локальных российских исследований подтверждены высокая эффективность и благоприятный профиль безопасности нимесулида, что позволяет использовать его при терапии коморбидных пациентов с сердечно-сосудистой патологией, факторами риска и противопоказаниями для применения других НПВП.
Поступила: 09.11.2021
Принята к публикации: 19.11.2021
________
1 Данные агентства IQVIA. URL: https://www.iqvia.com/our-customers/pharmaceutical-manufacturers (дата обращения — 20.12.2021).
2 Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т. и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018; 56(прил.1): 1–29.
3 Алексеева Л.И. Обновление клинических рекомендаций по лечению больных остеоартритом 2019 года. Рус. мед. журн. 2019; 4: 2–6.
4 Алексеева Л.И. Обновление клинических рекомендаций по лечению больных остеоартритом 2019 года...








