Моноклональная гаммапатия неопределенного значения (monoclonal gammopathies of undetermined significance, MGUS), связанная с выработкой аномальных моноклональных белков (парапротеинов, М-протеинов), представляет собой сложную неоднородную группу заболеваний, вызываемых нарушением моноклональной пролиферации клеток В-лимфоидного ряда, секретирующих один тип иммуноглобулинов и/или составляющие их цепей[1–3]1.
В настоящее время в клинической практике врачи сталкиваются с разнообразными почечными поражениями, связь которых с MGUS является доказанной. В 2012 году для дифференциации этих состояний, проявляющихся нефротоксичным эффектом моноклонального белка (парапротеина), состоящего из полноразмерной молекулы иммуноглобулина или его части (только легкой цепи или только тяжелой цепи), Международная группа по изучению поражения почек и моноклональной гаммапатии (International Kidney and Monoclonal Gammopathy Research Group) ввела новый термин — моноклональная гаммапатия ренального значения (monoclonal gammopathy of renal significance, MGRS)[4, 5].
Многие вопросы, в том числе касающиеся определения тактики лечения, недостаточно разработаны в практической медицине России, что вызывает существенные проблемы при оказании помощи больным. Недоступность лечения обусловлена тем, что диагноз в России не рассматривается как отдельное заболевание, таких пациентов относят к группе MGUS или к случаям В-клеточной пролиферации без критериев для начала терапии[1–3]2.
Недостаточная оценка клинического прогноза данного поражения — это еще одна проблема при лечении пациентов с MGRS. MGRS нельзя отнести к доброкачественным состояниям, поскольку клон — популяция клеток, возникшая из клетки-предшественницы и наследующая все ее свойства, которая способна неуклонно продуцировать моноклональный белок и поражать любую структуру нефрона (клубочка, канальцев, интерстиции, сосудов); для нее характерно наличие организованных депозитов (фибриллярных при AL- и AH-амилоидозе; микротубулярных при криоглобулинемическом и иммунотактоидном гломерулонефрите; кристаллических при проксимальной тубулопатии легких цепей с наличием или отсутствием синдрома Фанкони) или неорганизованных депозитов (при болезни отложения моноклональных иммуноглобулинов, С3-гломерулопатии, тромботической микроангиопатии)[5–8]. Все это ведет к дисфункции почечной паренхимы и, в итоге, к развитию терминальной стадии хронической болезни почек (С5 ХБП)[9].
Целью данного обзора является привлечение внимания к новым возможностям лечения пациентов с MGRS.
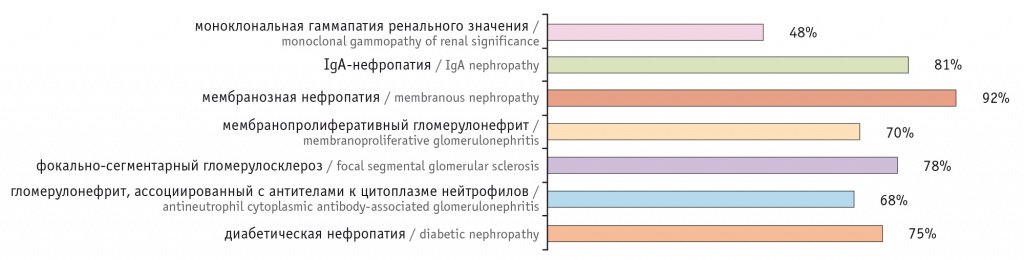
По данным клиники НИИ нефрологии г. Санкт-Петербурга, 5-летнняя почечная выживаемость при MGRS значительно ниже, чем при других вариантах нефропатий (IgА-нефропатии, мембранозной нефропатии, мембранопролиферативном гломерулонефрите, фокально-сегментарном гломерулосклерозе, гломерулонефрите, ассоциированном с антителами к цитоплазме нейтрофилов, диабетической нефропатии) (рис. 1)3.
Рис. 1. Данные Научно-исследовательского института нефрологии г. Санкт-Петербурга — 5-летняя почечная выживаемость при различных нефропатиях
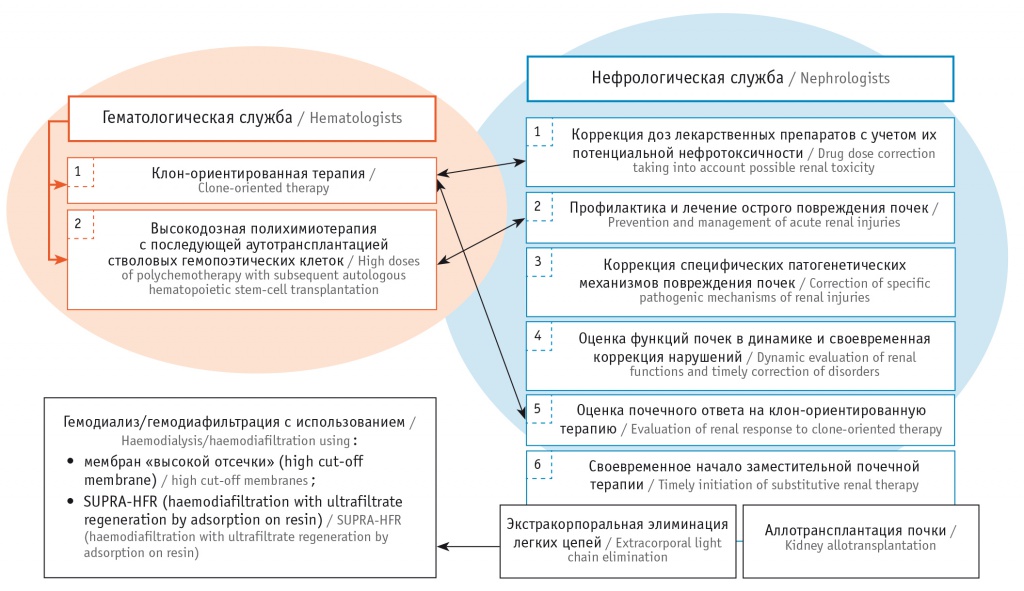
При MGRS риск трансформации клона в злокачественную форму на первом году составляет 10% (в 3,3 раза выше, чем при иных патологиях)[6], что определяет прогноз жизни. С учетом крайне неблагоприятного прогноза у данной категории пациентов необходим верный подход к выбору терапии, однако в настоящее время отсутствуют утвержденные рекомендации и стандарты лечения[10]. Сейчас терапия пациентов с MGRS основывается на гематологических критериях[1–3]4. Вместе с тем таких больных должны вести врачи двух специальностей — нефрологи и гематологи (рис. 2)[1–3]5.
Рис. 2. Взаимодействие гематологической и нефрологической служб при лечении пациента с моноклональной гаммапатией ренального значения[1–5]
Диагноз MGRS должен быть выставлен на основе установления патогенетической связи поражения почек и парапротеина, продуцируемого клоном В-лимфоцитов. Поэтому при гематологическом обследовании тип моноклонального белка (парапротеина, М-протеина), выявленного в сыворотке крови или моче, должен быть идентичен типу моноклонального белка, определенного в почечном биоптате[1–5]6.
ГЕМАТОЛОГИЧЕСКАЯ СЛУЖБА
Терапевтическая стратегия врачей-гематологов заключается в выявлении парапротеина и клона B-клеточной линии дифференцировки и принятии решения о назначении клон-ориентированной терапии[11].
Для обнаружения клона и парапротеина в практике используют следующие высокочувствительные методики: иммунофенотипирование костного мозга, генетическое исследование, иммунофиксацию сыворотки крови, мочи, определение в сыворотке свободных легких цепей методом Freelite или другими методами[1–5]. Химиотерапия должна быть адаптирована к природе клона.
В настоящее время в России клон-ориентированной терапией обеспечены только пациенты с гемобластозами (лимфомами, множественной миеломой, хроническим лимфолейкозом), в то время как больные MGRS не входят в программу обеспечения необходимыми лекарственными препаратами (Федеральный закон № 299 от 03.08.2018 г. «О внесении изменений в Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации»)[1–3]7. Отсутствие лечения обусловлено тем, что этих пациентов относят к группе MGUS или к случаям В-клеточной пролиферации без критериев для начала терапии[1–5]. В стандарты оказания помощи больным с MGRS (кроме AL-aмилоидоза) не входит высокодозная полиохимиотерапия с последующей аутотрансплантацией стволовых гемопоэтических клеток крови (аутоТГСК), применение которой позволяет достигнуть консолидации гематологического ответа. В рандомизированных клинических исследования оценена эффективность терапии при MGRS только в группе с амилоидозом[1–5].
Клон-ориентированная терапия MGRS проводится известными химиотерапевтическими лекарственными препаратами, применяемыми при множественной миеломе, В-лимфоме, хроническом лимфолейкозе и макроглобулинемии Вальденстрема: цитостатиками (циклофосфамидом, бендамустином, флударабином, доксорубицином и др.), глюкокортикоидами (дексаметазоном, преднизолоном), ингибиторами протеасом (бортезомибом и др.), моноклональными антителами (ритуксимабом, обинутузумабом, даратумумабом и др.). Многие из этих лекарственных средств назначаются в комбинированной форме из-за синергетического воздействия на В-клетки и плазматические клетки. Основные комбинации включают бортезомиб, циклофосфамид и дексаметазон; бендамустин и ритуксимаб, а также иммуномодуляторы (талидомид и леналидомид)[1–3, 12–15]8.
В семействе иммуномодулирующих препаратов талидомид считается более подходящим, чем леналидомид, поскольку последний выводится почками и в некоторых случаях может вызвать ухудшение функции почек. Однако сообщалось и о побочных эффектах талидомида, таких как развитие гиперкалиемии[16].
Бортезомиб — основной препарат в терапевтическом арсенале из-за безопасности и возможности назначения в полных дозах пациентам с терминальной стадией заболевания почек. Механизм его действия основан на ингибировании активности протеасом, которая вызывает апоптоз плазматической клетки, а также ингибирует путь NF-κB за счет снижения высвобождения провоспалительных цитокинов и индукции антиапоптотических путей на канальцевом уровне. Обычно побочные эффекты несерьезны. Бортезомиб вызывает развитие или обострение периферической нейропатии, хотя это нежелательное явления встречается реже при подкожном введении. Рекомендуется профилактика опоясывающего герпеса из-за риска реактивации[13, 16].
Среди цитотоксических агентов мелфалан и циклофосфамид действуют на В-клетки и плазматические клетки, однако циклофосфамид используется более часто, поскольку он менее токсичен. Другой альтернативой является бендамустин, одобренный для лечения некоторых лимфом и подходящий для пациентов с почечной недостаточностью, поскольку он преимущественно метаболизируется в печени[17].
Кроме того, используется высокодозная полихимиотерапия с последующей аутоТГСК. При аутоТГКС чаще применяется мелфалан в миелоаблативных дозах в качестве кондиционирующей терапии[16–20]. Опыт аутоТГКС и применения различных режимов кондиционирования при множественной миеломе, безусловно, шире, чем при неамилоидных вариантах MGRS.
Так, в исследовании I. Breitkreutz и соавт. с участием 27 диализных пациентов с множественной миеломой у 13 больных при использовании в качестве средства индукционной терапии бортезомиб показал более высокие результаты, чем у пациентов, которые получали винкристин, адриамицин, дексаметазон[21, 22].
В исследование C. Scheid и соавт. включены 827 пациентов с диагностированной множественной миеломой в возрасте от 18 до 65 лет. У больных с миеломой с исходным уровнем креатинина ≥ 2 мг/дл частота ответа со стороны почек составила 63% в группе, получавшей винкристин, адриамицин, дексаметазон (VAD), и 81% в группе, получавшей бортезомиб, адриамицин, дексаметазон (PAD) с последующей ауто-ТГСК PAD (p = 0,31)[22, 23].
Таким образом, лечение бортезомибом до и после ауто-ТГСК преодолевает негативное прогностическое влияние почечной недостаточности у пациентов с впервые диагностированной множественной миеломой[21, 23]. Данные подходы к аутоТГСК отчасти могут быть экстраполированы и на неамилоидные варианты MGRS.
Схемы химиотерапии при амилоидных вариантах MGRS основаны на вариантах лечения, используемых при множественной миеломе, и имеют накопительную базу и клинически значимые результаты.
Согласно анализу V. Sanchorawala и соавт., 35 пациентов с AL-амилоидозом получали 2 цикла индукции бортезомибом и дексаметазоном по графику 2 раза в неделю с последующим использованием бортезомиба и высоких доз мелфалана (HDM) и ауто-ТГСК. Из них 30 пациентов продолжили курс ауто-ТГСК, а 5 прекратили из-за клинического ухудшения во время индукции. У двух пациентов после ауто-ТГСК развились признаки аутологичного синдрома «трансплантат против хозяина», который отреагировал на стероиды; никаких других необычных осложнений не наблюдалось. Гематологический ответ был достигнут у 100% из 27 оцениваемых пациентов, которые завершили запланированное лечение: (63% — полный ответ (CR), 37% — очень хороший частичный ответ (VGPR). Включение бортезомиба в схему терапии способствует высокому уровню гематологических ответов после HDM/ауто-ТГСК у пациентов с AL-амилоидозом[21, 23, 24].
Из группы моноклональных антител ритуксимаб, нацеленный на антиген CD20, является эффективным препаратом при различных формах MGRS, опосредованных В-лимфоцитарной клональной пролиферацией, благодаря хорошей переносимости и ограниченному числу побочных эффектов. Одобрен и даратумумаб (человеческое моноклональное антитело IgG1к, связывающееся с белком CD38), тем не менее в настоящее время данные о применение его у пациентов с MGRS ограничены[25, 26].
В работе E. Kastritis и соавт. обобщен 14-месячный опыт использования терапии на основе даратумумаба у 25 пациентов с MGRS, 12 из которых ранее не получали лечения. Гематологический ответ в данной группе составил 74%: CR был у 5 пациентов (22%), VGPR — у 5 (22%), частичный ответ (PR) — у 7 (30%)[27].
Частота гематологического ответа у ранее не леченных пациентов составила 83% против 69% у больных, которые ранее получали другие комбинации химиопрепаратов.
Через 6 месяцев 55% пациентов, не находившихся на диализе, достигли снижения протеинурии менее чем на 30%, по крайней мере на 0,5 г/сут, без предполагаемого снижения скорости клубочковой фильтрации (СКФ)[27].
К группе иммуномодулирующих препаратов нового поколения относят помалидомид, который первоначально был зарегистрирован для лечения пациентов с множественной миеломой, у которых возник рецидив после терапии леналидомидом[28].
Так, в исследовании F.A. Sharpley и соавт. по данным Национального центра амилоидоза (National Amylooidosis Centre) обобщен опыт применения помалидомида при рецидиве AL-амилоидоза у 29 пациентов (поражение почек было у 14 (48,3%) человек). Гематологический ответ оценивали через 3 месяца: VGPR наблюдался у 10 (34,5%) больных, PR — у 9 (31%), стабильное или прогрессирующие заболевание — у 7 (24,1%). Окончательная оценка проводилась через 6 месяцев: ни один из пациентов не достиг CR, 11 (37,9%) пациентов имели VGPR, 2 (6,9%) — PR, а у остальных зафиксировано стабильное или прогрессирующее заболевание. У 2 больных, достигших через 3 месяца VGPR, через 6 месяцев наблюдения снова отмечалось прогрессирование заболевания[28].
Прием помалидомида не так хорошо переносится при AL-амилоидозе, как при множественной миеломе. Наиболее частыми нежелательными явлениями были инфекция (56%), сонливость и апатия (56%), сенсорная (44%) и периферическая моторная нейропатия (11%), нейтропения (33%), боль (33%), запор (22%), диарея (22%), отеки (22%), гипотензия (11%), крапивница (11%) и прогрессирование почечной недостаточности (11%)[28]. В начале терапии помалидомидом у 7 пациентов уровень креатинина увеличивался на 25%, но только одному из них потребовалась заместительная почечная терапия (ЗПТ). На протяжении всего курса химиотерапии показатели креатинина оставались стабильными. При оценке почечного ответа через 6 месяцев прогрессирование заболевания почек наблюдалось у 33% пациентов, почечный ответ — у 44%, отсутствие ответа на лечение — у 22%[28].
Эти данные подтверждают, что использование помалидомида у пациентов с AL-амилоидозом при рецидиве позволяет достигнуть быстрого гематологического ответа через 3 месяца, но многие больные умирают (12 смертей в течение 13 месяцев наблюдения) или прекращают терапию в связи с развитием побочных эффектов[28].
Таким образом, задача гематологического лечения сводится к уменьшению выработки В-клоном или плазматическими клетками патогенных моноклональных белков и/или составляющих их фрагментов, отложения парапротеина в органах и тканях и к предупреждению трансформации клона в злокачественную форму[6]. Достижение CR приводит к улучшению реакции организма и тем самым предотвращает прогрессирование патологического повреждения[1–3]9. Все это эффективно в отношении как почечных исходов, так и общей выживаемости таких больных[1–5].
НЕФРОЛОГИЧЕСКАЯ СЛУЖБА
Исторически сложилось так, что трудности лечения MGRS были связаны с проблемами токсичности химиотерапевтических лекарственных препаратов. В настоящее время лечение основано на комбинации химиотерапевтических агентов с оптимизацией безопасности[1–3, 29]10.
Задачи лечения для нефролога — это подбор и регулирование доз препаратов, обладающих нефротоксичностью, предупреждение развития и лечение острого почечного повреждения, обеспечение влияния на патогенетические механизмы нарушения функций почек (лечение тромботической микроангиопатии и иммунокомплексного повреждения, увеличение скорости клиренса депозитов нефротоксичных иммуноглобулинов). В задачи нефрологов входят и динамическое наблюдение за функцией почек, решение вопроса о необходимости применения экстракорпоральных методов лечения[1–5].
Исследования показали, что выживаемость данной группы пациентов улучшается и достижение гематологического ответа на лечение коррелирует с почечным ответом[23–25]. Известным фактором, определяющим почечный прогноз, является значение СКФ, поэтому рекомендуется незамедлительно начать терапию до того, как произойдет необратимое повреждение почек и снизится СКФ[1–4, 12, 29–32]11. Раннее начало химиотерапии показано при С1–С3 стадии ХБП для уменьшения выработки моноклонального иммуноглобулина и достижения глубокого гематологического ответа и почечной ремиссии[29, 33].
У пациентов с C1–C2 стадией заболевания лечение первой линии основывается на мелфалане (HDM) и дексаметазоне (MDex)[33]. При отсутствии гематологического ответа после первого или второго курса к комбинации MDex добавляют бортезомиб[33]. Продемонстрировала свою эффективность и схема циклофосфамид + бортезомиб + дексаметазон (CBD, также называемая CyBorD или VCD). Другой вариант — талидомид вместо бортезомиба (режим CTD)[33].
Высокие дозы мелфалана (HDM) при ауто-ТГСК следует назначать пациентам при отсутствии явной почечной недостаточности и другой выраженной органной недостаточности из-за высокой токсичности препарата[33].
У пациентов с С3 стадией ХБП, имеющих сопутствующее поражение сердца, предпочтительно в химиотерапии использовать режим CBD, который снижает уровень ранней смертности[33].
У больных с ХБП С4 и С5 стадии вероятность восстановления нарушенной функции почек низкая. Поэтому у пациентов, которым не требуется трансплантация почки, основной целью лечения является сохранение функции сердца, печени, легких. Рекомендуются схемы на основе бортезомиба, например комбинация циклофосфамида, бортезомиба и дексаметазона (CBD)[33].
У больных, у которых планируется трансплантация почки, терапевтической целью становится сохранение долгосрочной функции аллотрансплантата, что требует оптимального гематологического ответа на терапию. В данной группе пациентов при ауто-ТГСК назначение высоких доз мелфалана (HDM) следует рассматривать только после 3–4 циклов схемы циклофосфамид + бортезомиб + дексаметазон (CBD). Из-за высокого риска рецидива многие из этих пациентов получают ЗПТ[33].
Поэтому задачей нефролога является подготовка реципиента к трансплантации почки совместно с гематологом. Необходимо достижение CR до трансплантации почки, чтобы избежать риска рецидива заболевания в почечном аллотрансплантате, которое приведет к нарушению его функции[1–3, 29, 33]. У больных с внепочечными поражениями терапия может улучшить функцию органа (сердца, печени, легких)[29].
Почечный ответ обычно характеризуется снижением протеинурии без уменьшения СКФ, но может быть отсрочен на несколько месяцев после гематологического ответа. Однако у некоторых пациентов функция почек не улучшается и, в итоге, развивается терминальная стадия почечной недостаточности, несмотря на гематологический ответ[34].
По данным G. Palladini и соавт., в группе пациентов (n = 732), наблюдавшихся в европейских центрах в Павии (n = 461) и Гейдельберге (n = 271), оценивали почечную реакцию через 3 и 6 месяцев от начала терапии. Неблагоприятный почечный прогноз определяли с начала перехода пациента на ЗПТ, со снижения СКФ менее 15 мл/мин, суточной протеинурии более 0,5 г/сут. Исследователи обнаружили, что раннее снижение протеинурии по крайней мере на 30% или до значений менее 0,5 г/сут связано с повышенной вероятностью сохранения функции почек и возможностью отсрочить переход на ЗПТ. В свою очередь, раннее уменьшение СКФ (≥ 25%) было ассоциировано с низкой почечной выживаемостью[35].
N. Leung и соавт. в группе наблюдения (n = 141) выявили, что общая выживаемость пациентов улучшается при снижении протеинурии на > 95% по сравнению с таковой у больных со снижением протеинурии от > 75% до ≤ 95% (p = 0,006)[36]. Обнаружена взаимосвязь между гематологическим ответом (уменьшением числа свободных κ/λ-цепей иммуноглобулинов в крови на > 86%) и снижением протеинурии (> 75%)[36].
По данным E. Kastritis и соавт., в 2005–2015 гг. у 125 больных AL-амилоидозом маркером почечного ответа на терапию считали отношение суточной протеинурии к СКФ (в мг на мл/мин/1,73 м2) через 3 и 6 месяцев. Первичная терапия основывалась у 54% пациентов на бортезомибе (в сочетании с дексаметазоном отдельно или в дополнение к циклофосфамиду или мелфалану), у 23% — на леналидомиде, у 15% — на дексаметазоне, у 8% — других схемах на основе дексаметазона[37].
У пациентов, получавших терапию 3 месяца и достигших гематологического ответа, уменьшилось соотношение суточной протеинурии к СКФ (на 25% или ниже 100 мг), в этой группе через 2 года динамического наблюдения ни один из больных не перешел на ЗПТ. Пациенты (n = 30), у которых отношение суточной протеинурии к СКФ не снизилось либо все еще было больше 100 мг на мл/мин/1,73 м2, через этот же промежуток времени стали нуждаться в ЗПТ[37].
При 6-месячном анализе с применением тех же критериев среди больных, которые имели гематологический ответ после 2 лет от начала терапии, ни один не нуждался в ЗПТ, в отличие от лиц, которые не ответили на терапию, — 28 (22%) (p < 0,001)[37].
Гематологический ответ был связан с переходом пациента на ЗПТ. Так, через 3 года наблюдения частота перехода на диализ у больных с VGPR или CR составила 10% против 22% у больных с PR и 28% у пациентов без гематологического ответа на первичную терапию (p = 0,023). Соответствующая частота смерти без диализа составила 15% против 17%, 26% против 28% и 30% против 31% для первого, второго и третьего года наблюдения соответственно (p = 0,9)[37].
Увеличение отношения суточной протеинурии к СКФ на ≥ 25% или до ≥ 100 мг на мл/мин/1,73 м2 авторы определили как «почечную прогрессию», оно было связано с неблагоприятными почечными исходами с риском перехода на ЗПТ. Поэтому в процессе лечения отношение суточной протеинурии к СКФ может идентифицировать пациентов с высоким риском перехода на ЗПТ[37].
Кроме того, первичная терапия у пациентов c AL-амилоидозом и ХБП С2 и С3 стадии на основе бортезомиба была более эффективной, чем терапия на основе леналидомида или комбинации с высокими дозами дексаметазона, она снижала риск прогрессирования почечной недостаточности до терминальной стадии. Пациенты с ХБП С1 имели отличные результаты при любой назначаемой схеме химиотерапии[37].
Ранние изменения СКФ и протеинурии следует использовать для оценки эффективности лечения в дополнение к критериям гематологического ответа. Эти новые критерии ответа и прогрессирования позволяют оценить адекватность ответа на терапию на очень раннем этапе, когда ее стратегию еще можно изменить, если ответ неудовлетворительный[37].
Поэтому своевременное выявление нефрологом пациентов c MGRS позволит вовремя назначить клон-ориентированную терапию и предотвратить необратимое повреждение почек.
Нефрологу важно иметь в арсенале возможность использования других биомаркеров, кроме СКФ и протеинурии, которые позволили бы своевременно изменить подход к лечению. Нужно иметь систему стадирования, которая основана на определении протеинурии и СКФ и дает возможность различать пациентов с разной степенью риска перехода на ЗПТ[34–37].
Другим важным аспектом является оценка исходов трансплантации почки у пациентов с MGRS, получавших и не получавших клон-ориентированную терапию до трансплантации. Так, в ретроспективное исследование C. Heybeli и соавт. вошли 28 пациентов, перенесших трансплантацию почки с 1987 по 2016 г. после постановки диагноза MGRS-ассоциированных поражений, включая болезнь отложения легких цепей (n = 19), С3-гломерулопатию с моноклональной гаммопатией (n = 5) и проксимальную тубулопатию легких цепей (n = 4). Среди пациентов с болезнью отложения легких цепей 10 человек до трансплантации получали химиотерапию, а 9 нет. Среди пролеченных пациентов у 3 (30%) наблюдался гистологический рецидив, у 2 (20%) — отторжение трансплантата, 2 (20%) умерли после трансплантации (в среднем от 3 до 162 месяцев наблюдения). В группе не получавших лечение у 8 (89%) больных был гистологический рецидив заболевания, у 6 (67%) — отторжение трансплантата, 4 (44%) умерли в течение 60 месяцев наблюдения[38].
Среди пациентов с С3-гломерулопатией и моноклональной гаммапатией трое не получали лечения перед трансплантацией, из них у 2 человек развился гистологический рецидив и у одного — отторжение трансплантата, что привело к смерти. У 2 больных, которые получали химиотерапию, наблюдался CR, ни один из них не умер, но через 162 месяца после трансплантации у одного пациента произошло отторжение трансплантата[38].
Среди 4 больных, страдающих проксимальной тубулопатией легких цепей, гистологический рецидив наблюдался у троих, которые не получали клон-направленную терапию до трансплантации (двое из них умерли). У одного пациента с проксимальной тубулопатией легких цепей, получавшего терапию перед трансплантацией, не было гистологического рецидива и отторжения трансплантата[38].
Таким образом, химиотерапия направлена на улучшение почечной выживаемости, снижение протеинурии, отсроченное назначение или отсутствие необходимости в ЗПТ и уменьшение риска рецидива после трансплантации почки[4, 28–32, 34–37].
ЗАКЛЮЧЕНИЕ
Моноклональная гаммапатия ренального значения (monoclonal gammopathy of renal significance, MGRS) — это группа заболеваний, в развитии которых ведущую роль отводят патогенным клональным пролиферативным нарушениям, синтезу нефротоксичного белка. При обследовании пациентов с подозрением на MGRS необходимо проводить полное гематологическое обследование с использованием иммунофенотипических, молекулярных методов выявления клона, включая обнаружение парапротеина. Понимание механизмов повреждения позволяет улучшить клиническое течение заболевания и выживаемость пациентов с MGRS[1–5, 39, 40]12.
Любой вариант MGRS требует назначения клон-ориентированной терапии, цель которой — сохранение функции почек и предупреждение прогрессирования клона в сторону злокачественного процесса. Достижение полного гематологического ответа приводит к увеличению почечной и общей выживаемости больных с MGRS.
При выборе терапевтической стратегии следует учитывать особенности заболевания почек, такие как риск прогрессирования хронической болезни почек (ХБП), наличие и тяжесть внепочечных проявлений, а также профиль безопасности противоопухолевых лекарственных препаратов при почечной недостаточности. Ранняя диагностика на С1–С3 стадиях ХБП, когда функция почек все еще сохранна, облегчает лечение и улучшает отдаленный прогноз заболевания[27].
Современным приоритетным подходом при ведении пациентов с MGRS является тесное сотрудничество нефрологов и гематологов с целью индивидуализации лечения в соответствии с клиническими вариантами течения заболевания и наличием сопутствующих патологий[1–3, 37–40]13.
Поступила: 24.08.2021
Принята к публикации: 15.11.2021
________
1 Смирнов А.В., Добронравов В.А., Храброва М.С. и др. Междисциплинарный подход в практике врача-терапевта: фокус на моноклональную гаммапатию ренального значения (сокращенная версия Консенсуса гематологов и нефрологов России по введению нозологии, диагностике и обоснованности клон-ориентированной терапии). Терапия. 2020; 2(36): 22–33. DOI: 10.18565/therapy.2020.2.22-33; Смирнов А.В., Афанасьев Б.В., Поддубная И.В. и др. Моноклональная гаммапатия ренального значения: Консенсус гематологов и нефрологов России по введению нозологии, диагностике и обоснованности клон-ориентированной терапии. Архивъ внутренней медицины. 2020; 10(2): 102–18. DOI: 10.20514/2226-6704-2020-10-2-102-118
2 Там же.
3 Там же.
4 Там же.
5 Там же.
6 Там же.
7 Там же.
8 Там же.
9 Там же.
10 Там же.
11 Там же.
12 Там же.
13 Там же.








