В соответствии с утвержденными на IV Конгрессе гематологов России (2018) национальными клиническими рекомендациями, перегрузка железом определяется как состояние, характеризующееся избыточным его накоплением в органах и тканях, что сопровождается:
-
появлением свободных ионов железа в плазме крови, внеклеточном пространстве и внутри клеток;
-
окислительными повреждениями белков и клеточных структур, ведущими к гибели клеток;
-
дегенеративно-дистрофическими изменениями и фиброзной трансформацией вовлеченных в процесс органов и тканей;
-
необратимыми нарушениями структуры и функции печени, сердца, поджелудочной железы и других органов эндокринной системы1.
Цель нашего обзора — описать механизмы и клиническое значение печеночного фиброгенеза при перегрузке железом у пациентов с наследственным гемохроматозом и хроническими заболеваниями печени.
МЕХАНИЗМЫ ПЕЧЕНОЧНОГО ФИБРОГЕНЕЗА ПРИ ПЕРЕГРУЗКЕ ЖЕЛЕЗОМ
В обычных условиях системная регуляция железа обеспечивается секретируемым печенью белком гепсидином, который соединяется с присутствующим на поверхности хранящих железо макрофагов и гепатоцитов трансмембранным белком-экспортером клеточного железа ферропортином, расщепляет его и тем самым препятствует поступлению железа в кровоток. На апикальной поверхности энтероцитов гепсидин также связывается с ферропортином, снижает экспрессию белка-транспортера двухвалентных металлов, который обеспечивает усвоение негемового железа, и таким образом уменьшает всасывание железа в кишечнике.
Находящиеся в физиологических условиях в неподвижном состоянии звездчатые клетки печени (ЗКП) под влиянием молекулярных стимулов вступают в клеточный цикл и проходят фазу начальной, а затем устойчивой активации с приобретением ими фиброгенных и провоспалительных свойств[1]. Следует отметить, что неактивные ЗКП не экспрессируют трансферриновые рецепторы, что предполагает их минимальные потребности в железе. В то же время серия экспериментов на клеточных культурах продемонстрировала роль железа в продукции активированными ЗКП компонентов внеклеточного матрикса. В частности, отмечалась способность железа и трансферрина повышать экспрессию α-гладкомышечного актина (α-SMA) и усиливать синтез коллагена[2].
Печеночный фиброгенез при перегрузке железом обусловлен многочисленными механизмами, включая реакцию Фентона (Fe2+ + H2O2 → Fe3+ + OH· + OH–), клеточные сигнальные пути, активацию ЗКП связанными с железом белково-рецепторными комплексами и, возможно, опосредованное железом ремоделирование внеклеточного матрикса[3].
Реакция Фентона является источником гидроксильных радикалов, небольшая доля которых, генерируемая во время клеточного метаболизма, подавляется антиоксидантными механизмами и электронодонорными компонентами, такими как витамины А, С и Е. Кроме того, связывание железа с клеточными и циркулирующими белками (например, ферритином и трансферрином) ограничивает количество доступного для поддержания реакции Фентона свободного железа.
Гепсидин путем ингибирования поступления избытков железа в кровоток также обеспечивает косвенную защиту от вызванных ими токсических эффектов. Однако при перегрузке железом, например вследствие наследственного гемохроматоза, уровень циркулирующего в плазме не связанного с трансферрином свободного железа увеличивается. Это приводит к ускорению реакции Фентона и образованию индуцирующих перекисное окисление липидов реактивных форм кислорода (ROS), что способствует апоптозу и некрозу гепатоцитов, а также высвобождению фиброгенных медиаторов активации ЗКП[4].
К членам суперсемейства одного из ключевых триггеров фиброгенеза — трансформирующего фактора роста (TGF) β1 — относятся костные морфогенетические белки (bone morphogenetic proteins, BMPs), некоторые из которых, в частности важный регулятор гепсидина BMP6, играют главную роль в гомеостазе железа. Этот процесс происходит при участии клеточных сигнальных молекул SMAD (similar to mothers against decapentaplegic) и модулируется корецептором BMP гемоювелином.
Мутации в некоторых генах, влияющих на передачу сигналов гепсидину через путь BMP/SMAD, приводят к связанным с нарушением метаболизма железа заболеваниям, в т. ч. к наследственному гемохроматозу и железодефицитной анемии[5]. Таким образом, в то время как TGF-β активирует канонический сигнальный путь печеночного фиброгенеза TGF-βRII/RI-SMAD2/3-SMAD4, опосредованная BMP6 стимуляция сигнального пути ALK-2/3-SMAD1/5/8-SMAD4 занимает центральное место в железозависимой регуляции гепсидина. Поскольку избыток железа в печени способствует экспрессии как TGF-β, так и BMP6, в ряде исследований показана взаимосвязь между этими сигнальными путями[3].
Установлено, что некоторые связанные с железом белково-рецепторные комплексы либо активируют ЗКП, либо содействуют поступлению железа в предварительно активированные ЗКП, что вызывает сопровождающиеся фиброгенезом воспалительные процессы. В одной из таких ассоциаций посредством расположенного на мембране активированных ЗКП специфического рецептора участвует белок ферритина. В результате стимуляции железонезависимого сигнального каскада, включающего фосфорилирование Tim-2-независимой фосфоинозитид-3-киназы, протеинкиназы С типа ζ и p44/p42-митоген-активируемой протеинкиназы, он способствует активации NF-κB и повышению в печени экспрессии провоспалительных медиаторов[6]. Другой участвующий в метаболизме железа белок трансферрин может активировать ЗКП, а его связывание с находящимся на их поверхности специфическим рецептором TFR1 приводит к увеличению уровней классических фиброгенных маркеров, таких как матричная РНК (мРНК) α-SMA и проколлагена I типа[7].
Недавно выяснено, что избыточное накопление железа в печени вызывает снижение регуляции передачи сигналов PPARα-Sirt3-Wnt, которое способствует печеночному фиброгенезу[8].
ПЕЧЕНОЧНЫЙ ФИБРОГЕНЕЗ ПРИ НАСЛЕДСТВЕННОМ ГЕМОХРОМАТОЗЕ
Наследственный гемохроматоз определяется как системная перегрузка железом генетического происхождения, вызванная снижением концентрации железо-регуляторного гормона гепсидина или уменьшением связывания гепсидина с ферропортином. Наиболее распространенная форма наследственного гемохроматоза обусловлена гомозиготными мутациями (в частности, мутацией C282Y) в гене HFE, который кодирует наследственный белок гемохроматоза. Не связанные с геном HFE формы гемохроматоза, например из-за мутаций в гене HAMP, гемоювелина или TFR2, встречаются значительно реже.
Мутации в кодирующем ферропортин гене SLC40A1 (известном как FPN1) предотвращают связывание гепсидина с ферропортином и также способны вызывать гемохроматоз. Избыток железа и при связанных, и при не связанных с геном HFE формах наследственного гемохроматоза приводит к повышению его концентрации в плазме и паренхиматозных клетках, в частности гепатоцитах[9].
Если нормальное содержание железа в печени колеблется от 300 мг до 1 г, то у пациентов с наследственным гемохроматозом оно может достигать 25–30 г, что повышает риск развития фиброза печени (ФП)[10]. Вероятность формирования цирроза печени (ЦП) значительно возрастает при исходном уровне сывороточного ферритина более 1000 нг/мл[11]. Среди многочисленных факторов, влияющих на развитие и прогрессирование ФП при наследственном гемохроматозе, наиболее существенное значение имеют возраст, СД, алкоголь и количество удаленного путем лечебной флеботомии железа (г)[12].
Наследственные факторы
Влияние наследственных факторов на риск развития ЦП у гомозигот C282Y изучено в исследовании S. Buch и соавт.[13], которые оценили связанные с ним генотипические и аллельные ассоциации с поправкой на возраст и пол у 1319 пациентов с наследственным гемохроматозом из шести европейских стран. После метаанализа скорректированных сводных данных вариантов генов PCSK7, PNPLA3, TM6SF2, MBOAT7 и HSD17B13 статистически значимые ассоциации наблюдались с PCSK7 rs236918 (ОШ = 1,52, 95%-ный ДИ: 1,06–2,19; p = 0,022; I2 = 0%); PNPLA3 rs738409 (ОШ = 1,60, 95%-ный ДИ: 1,22–2,11; p = 7,37 × 10–4; I2 = 45,5%) и TM6SF2 rs58542926 (ОШ = 1,94, 95%-ный ДИ: 1,28–2,95; p = 1,86 × 10–3; I2 = 0%).
Полиморфизм генов цитокинов
В исследовании, включающем 149 больных наследственным гемохроматозом с гомозиготной мутацией C282Y в гене HFE (из них 111 мужчин, средний возраст: 51,0 ± 12,9 года), после биопсии печени была изучена роль функционального генетического полиморфизма TGF-β1 (кодон 10 Leu/Pro, кодон 25 Arg/Pro), ФНО-α (–308 G/A, –238 G/A) и ангиотензиногена (–6 G/A) в формировании ЦП. TGF-β1 кодон 25 генотипов Arg/Pro и Pro/Pro чаще встречался у пациентов с ЦП, чем без него (23,6% против 7,4%, p = 0,005). В то же время отличий в распределении генотипов TGF-β1 кодона 10, ФНО-α и ангиотензиногена не было.
Логистический регрессионный анализ определил мужской пол, возраст, уровень сывороточного ферритина и кодон TGF-β1 25 Arg/Pro и Pro/Pro в качестве независимых предикторов ЦП. Скорректированное ОШ для кодона TGF-β1 25 Arg/Pro и Pro/Pro составляло 2,8 (95%-ный ДИ: 1,4–5,7; p = 0,004)[14].
Окислительный стресс
Несколько участвующих в деградации ROS и ксенобиотиков ферментов, в частности глутатион-S-трансфераза P1 (GSTP1) и марганцевая супероксиддисмутаза (MnSOD), показали функциональный генетический полиморфизм (соответственно кодон 105 Ile -> Val и кодон 16 белка-предшественника Ala -> Val), который влияет на их антиоксидантную способность, что может модулировать прогрессирование ФП до ЦП.
В исследовании 172 больных наследственным гемохроматозом с гомозиготной мутацией C282Y в гене HFE выявлена бо́льшая распространенность GSTP1 генотипа Val/Val у имеющих ЦП (14,8% против 2,1%, p = 0,009). Логистический регрессионный анализ идентифицировал GSTP1 генотип Val/Val, уровень сывороточного ферритина, мужской пол и возраст в качестве независимых предикторов ЦП. Скорректированное ОШ для GSTP1 генотипа Val/Val составляло 3,85 (95%-ный ДИ: 1,18–12,62; p = 0,03)[15].
Миелопероксидаза представляет собой присутствующий в нейтрофилах и моноцитах фермент, ответственный за катализирующие реакции с образованием хлорноватистой кислоты, оказывающей повреждающее действие на клетки. C.H. Osterreicher и соавт.[16] обнаружили, что среди пациентов с наследственным гемохроматозом с гомозиготной мутацией C282Y в гене HFE миелопероксидаза генотипа GG чаще встречается у имеющих ЦП (78,7% против 55,7%, р = 0,003). Логистический регрессионный анализ определил миелопероксидазу генотипа GG, уровень сывороточного ферритина, возраст и мужской пол в качестве независимых предикторов ЦП.
Активация клеток-предшественников
Из-за чрезмерного отложения железа в гепатоцитах, препятствующего их способности к репликации, у больных наследственным гемохроматозом с гомозиготной мутацией C282Y в гене HFE активация клеток-предшественников происходит на ранней стадии заболевания. Установлена положительная корреляция старения гепатоцитов с концентрацией железа в печени, уровнем сывороточного ферритина и окислительным стрессом. При многомерном анализе перегрузка железом, задержка репликации гепатоцитов и портальное воспаление оставались независимыми и достоверно связанными с активацией клеток-предшественников. После корректировки на кофакторы прогрессированию ФП наиболее значимо способствовали активация клеток-предшественников (ОШ = 10,86, p < 0,0001) и наличие портального воспаления (ОШ = 4,31, p = 0,028)[17].
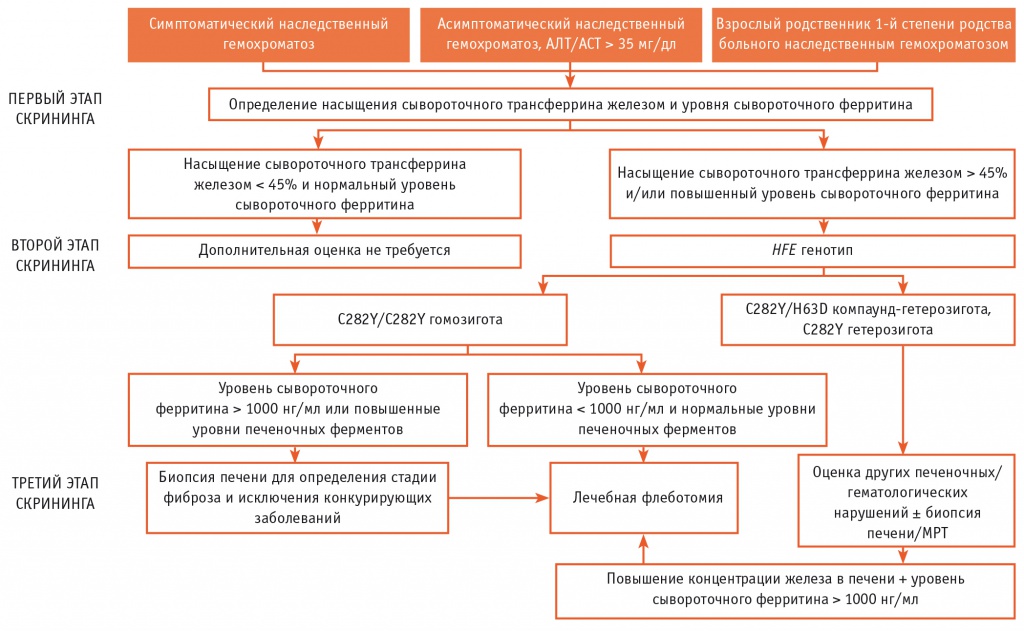
АЛГОРИТМ ВЕДЕНИЯ ПАЦИЕНТОВ С НАСЛЕДСТВЕННЫМ ГЕМОХРОМАТОЗОМ
Американской коллегией гастроэнтерологов предложен алгоритм ведения пациентов с наследственным гемохроматозом. В соответствии с ним первоначальный скрининговый тест должен включать определение насыщения сывороточного трансферрина железом и уровень сывороточного ферритина. При насыщении сывороточного трансферрина железом менее 45% и нормальном уровне сывороточного ферритина дальнейшая оценка не требуется. Если насыщение сывороточного трансферрина железом составляет более 45%, а уровень сывороточного ферритина повышен, следует установить генотип HFE.
Всем гомозиготным по C282Y пациентам показана лечебная флеботомия. Не допуская снижения уровня гемоглобина менее 11 г/дл, вначале еженедельно удаляют 500 мл крови, а в дальнейшем при необходимости объем может быть увеличен до 1000 мл. В то же время у больных, которые подобный режим не переносят, возможно как уменьшение объема кровопускания, так и увеличение интервалов между сеансами. Сывороточный ферритин следует контролировать ежемесячно до достижения его целевого уровня 50–100 нг/мл.
Гомозиготным по C282Y больным при уровне сывороточного ферритина более 1000 нг/мл и повышенном содержании печеночных ферментов для определения стадии ФП и исключения конкурирующих заболеваний печени рекомендуется биопсия печени. Больные ЦП должны пройти скрининг на гепатоцеллюлярную карциному.
У пациентов, не являющихся гомозиготами по C282Y, необходимо провести оценку других причин повышенного печеночного индекса железа, включая нарушения со стороны печени и гематологические расстройства. Если их установить не удалось, концентрацию железа в печени следует определить с помощью биопсии печени или МРТ. Имеющим повышенную концентрацию железа в печени и сывороточный уровень ферритина более 1000 нг/мл показана лечебная флеботомия[18] (рис. 1).
Рис. 1. Алгоритм ведения пациентов с наследственным гемохроматозом[18]
ПОТЕНЦИРУЮЩЕЕ ВЛИЯНИЕ ВТОРИЧНОЙ ПЕРЕГРУЗКИ ЖЕЛЕЗОМ НА ПЕЧЕНОЧНЫЙ ФИБРОГЕНЕЗ ПРИ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЯХ ПЕЧЕНИ
При хронических заболеваниях печени перегрузка железом начинается в гепатоцитах, расположенных в зоне 1 ацинуса Раппопорта, и прогрессирует в направлении зон 2 и 3. Последующая перегрузка железом клеток Купфера считается триггером ФП[19]. Оба типа клеток совместно продуцируют большое количество пролиферативных, провоспалительных и профиброгенных медиаторов, что приводит к ранней активации ЗКП. Это обычно происходит в местах, удаленных от областей с большой перегрузкой железом, вызывает инфильтрацию тканей циркулирующими иммунными клетками, тем самым поддерживает воспалительное состояние и способствует появлению ФП[20].
Хроническая инфекция гепатитов В и С
Повышенное содержание железа в печени при хронической инфекции гепатита В (HBV) и гепатита С (HCV) может быть следствием нарушений регуляции его гомеостаза и нормальных защитных процессов организма, которые включают секвестрацию железа клетками печени с целью ограничения доступа к патогенам для подавления их пролиферации. Это может объяснить различия в концентрации железа в печени на разных стадиях патологического процесса: низкую в начале заболевания с постепенным увеличением через 2 недели, что положительно коррелирует с числом активированных ЗКП и может играть решающую роль в прогрессировании ФП[21].
Хотя перегрузка железом при хронической HBV и HCV инфекции объясняется снижением уровня гепсидина из-за вызванного вирусом окислительного стресса, в некоторых публикациях причинно-следственная связь между этими патофизиологическими процессами не выявлена[22]. Действительно, в исследовании Y.H. Gao и соавт.[23] у пациентов с хронической HBV инфекцией уровень сывороточного гепсидина был ниже, а уровень сывороточного ферритина выше, чем у здоровых лиц. При этом содержание сывороточного железа и трансферрина, так же как общая железосвязывающая способность, оказались сниженными, а уровень гепсидина — повышенным у пациентов с ЦП и гепатоцеллюлярной карциномой по сравнению с таковыми у больных хроническим гепатитом В.
Корреляционный анализ показал отрицательную взаимосвязь показателей гепсидина с вирусной нагрузкой — концентрацией ДНК HBV (p < 0,01). Уровни сывороточного ферритина и трансферрина увеличивались пропорционально степени тяжести ЦП и ухудшению показателей шкалы Чайлд — Пью (p < 0,05). По мере прогрессирования ФП имела место возрастающая тенденция отложения в печени железа, которая стала очевидной на поздних стадиях ФП и при ЦП (METAVIR F3-4).
Как правило, у 30–40% больных хроническим гепатитом С наблюдаются высокие уровни сывороточного железа и увеличение насыщения трансферрина и ферритина[24]. Так, в исследовании Y. Shan и соавт.[25] средние уровни сывороточного железа и ферритина были значительно выше у пациентов с хронической HCV инфекцией (229 ± 17 мг/дл и 100 ± 3 нг/мл соответственно), чем у здоровых субъектов (101 ± 2,1 мг/дл и 83 ± 0,3 нг/мл соответственно). При этом показатели ферритина прямо и значимо коррелировали с сывороточными уровнями АЛТ, АСТ и γ-глутамилтрансферазы (r = 0,25; r = 0,24; r = 0,28 соответственно; p < 0,0001), но были обратно пропорциональны количеству тромбоцитов (r = –0,12; p < 0,0001).
В исследовании типа «случай — контроль» у пациентов с хронической HCV инфекцией экспрессия мРНК гепсидина и отложение железа в гепатоцитах оказались ниже, чем у имеющих HBV инфекцию[26]. У последних также наблюдалась повышенная концентрация железа в печени, что усугубляло тяжесть заболевания[27]. Кроме того, поддерживать HBV инфекцию, способствовать воспалению и тем самым содействовать прогрессированию ФП может усиленная железом экспрессия мРНК HBV в клетках HepG2[28].
Некоторые литературные данные свидетельствуют о негативном влиянии повышенного содержания железа в печени на результаты противовирусной терапии хронического гепатита С[29]. В то же время адъювантная лечебная флеботомия сама по себе может улучшить биохимические и гистологические показатели, увеличить эффективность устойчивого вирусологического ответа у получавших интерферон и рибавирин пациентов[30].
Однако существуют исследования, которые не выявили зависимость между концентрацией железа в печени и реакцией на противовирусную терапию. Кроме того, связанная с повторными лечебными флеботомиями железодефицитная анемия может служить усугубляющим фактором ее неудачного исхода из-за вынужденного снижения дозы рибавирина[31].
Алкогольная болезнь печени
Примерно 50% страдающих алкогольной болезнью печени (АБП) пациентов имеют вторичную перегрузку железом. Хроническое употребление алкоголя в умеренных или избыточных количествах связано с повышением уровня сывороточного ферритина, насыщением трансферрина железом и может привести к накоплению запасов железа в печени[32]. Процесс усугубляется увеличением его всасывания из кишечника.
Кумулятивное воздействие на клетки печени этанола и железа, вызывающих окислительный стресс и перекисное окисление липидов, ухудшает течение заболевания и способствует прогрессированию ФП[33]. При этом повышенный уровень сывороточного трансферрина у злоупотребляющих алкоголем субъектов сопровождается реальной угрозой развития ЦП и гепатоцеллюлярной карциномы[34].
Системная перегрузка железом при АБП объясняется опосредованным подавлением этанолом продукции гепсидина[35], повышенной активностью рецептора TFR1 гепатоцитов[36] и сопутствующим увеличением экспрессии дуоденального белка-транспортера двухвалентных металлов 1 и ферропортина[37]. Кроме того, алкоголь активирует TGF-β1 и фосфорилирует SMAD2. Такая повышенная доступность SMAD2/3 снижает индуцированную TGF-β1 регуляцию гепсидина. Он также ингибирует активацию рецепторов BMP и SMAD1/5 и ослабляет связывание SMAD4 с промотором гепсидина[38]. В совокупности это уменьшает экспрессию гепсидина и нарушает метаболизм железа в печени.
Критической характеристикой АБП считается накопление железа в макрофагах печени. Хроническое употребление алкоголя усиливает экспрессию рецептора трансферрина 1 и гена HFE, поглощение железа и внутриклеточный лабильный ответ железа на активацию NF-κB в клетках Купфера, что приводит к значительной продукции ФНО-α. Повышенное усвоение железа способствует его перегрузке в клетках Купфера, а внутриклеточный лабильный ответ железа является приобретаемой дифференцированными макрофагами функцией и механизмом праймирования при АБП[39].
Неалкогольная жировая болезнь печени
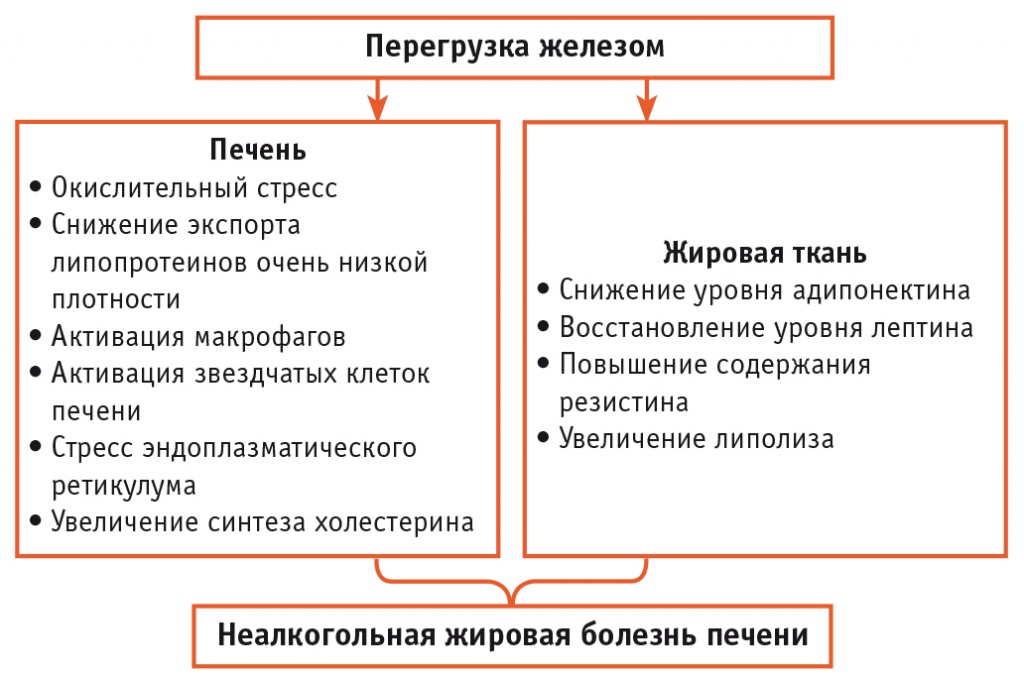
Повышение концентрации железа в печени встречается примерно у трети взрослых пациентов с неалкогольной жировой болезнью печени (НАЖБП) и ассоциируется с риском развития и прогрессирования ФП. Это связано с тем, что вместе с избытком липидов перегрузка железом катализирует патологические процессы, сопровождающиеся окислительным стрессом и стрессом эндоплазматического ретикулума, активацией макрофагов и ЗКП, снижением экспорта липопротеинов очень низкой плотности и увеличением синтеза холестерина[40]. Кроме того, поскольку жировая ткань является преобладающим источником поступления в печень свободных жирных кислот, усиленный железом липолиз представляется очень важным патогенетическим механизмом НАЖБП[42]. Связанные с перегрузкой железом потенциальные механизмы патогенеза НАЖБП показаны на рисунке 2.
Рис. 2. Потенциальные механизмы патогенеза неалкогольной жировой болезни печени, связанные с перегрузкой железом
У пациентов с НАЖБП наблюдается высокое содержание сывороточного гепсидина, гепсидина белой жировой ткани и белка-транспортера двухвалентных металлов 1. Кроме того, у мышей, получающих питание с высоким содержанием жиров, выявлена повышенная активность рецептора TFR1 гепатоцитов[42].
Хотя гиперферритинемия при НАЖБП не эквивалентна концентрации железа в печени, она может являться маркером серьезных гистологических нарушений. Так, в исследовании K.V. Kowdley и соавт.[43], включающем 628 пациентов с НАЖБП, уровни сывороточного ферритина, превышающие верхний предел нормы в 1,5 раза, независимо коррелировали с прогрессирующим ФП и показателями шкалы NAFLD activity score. Тем не менее другие авторы показали, что уровень сывороточного ферритина не столько отражает процессы некровоспаления, сколько служит сильным предиктором стеатоза печени[44]. Возможно, процессы, способствующие повышению его уровня, вносят вклад в патогенез НАЖБП на очень ранней стадии заболевания и могут быть связаны с инсулинорезистентностью[45].
В настоящее время жировая ткань рассматривается в качестве места, в котором железо может играть главную патогенную роль при НАЖБП[46]. Доказательства этому в основном были получены косвенно из связи между содержащимся в адипоцитах железом и инсулинорезистентностью. В исследовании J.S. Gabrielsen и соавт.[47] установлена обратная корреляция нормального уровня сывороточного ферритина с концентрацией адипонектина независимо от выраженности воспаления. Уровень сывороточного ферритина повышался, а адипонектина — падал у больных СД 2 типа и ожирением.
В экспериментах на мышах, получавших рацион с высоким содержанием железа, и в обработанных железом культивированных адипоцитах наблюдалась опосредованная репрессией FOXO1 редукция мРНК адипонектина. Кроме того, утрата ферропортином активности приводила к перегрузке железом адипоцитов, уменьшению экспрессии адипонектина и снижению инсулинорезистентности. Наоборот, обусловленная гемохроматозом перегрузка железом и увеличение активности ферропортина в адипоцитах сопровождались редукцией концентрации в них железа, повышением экспрессии адипонектина, улучшением толерантности к глюкозе и уменьшением инсулинорезистентности.
Отмечалось, что у перенесших бариатрическую операцию пациентов с ожирением два маркера перегрузки железом адипоцитов, а именно повышенная экспрессия мРНК гена гепсидина HAMP и пониженная экспрессия мРНК рецептора трансферрина 1, были связаны со снижением экспрессии мРНК гена адипонектина ADIPOQ[48].
Предполагается, что наиболее полезную информацию, позволяющую точно оценить причинно-следственную связь между умеренной перегрузкой железом и НАЖБП и/или СД, могут предоставить исследования, в которых она устранялась посредством лечебной флеботомии. Действительно, выявлено, что эта процедура улучшала толерантность к глюкозе у здоровых людей и повышала чувствительность к инсулину у страдающих СД 2 типа с высоким уровнем сывороточного ферритина[49]. Кроме того, отмечалось положительное влияние лечебной флеботомии на метаболический синдром, что проявлялось снижением АД, уровней глюкозы в крови и гликозилированного гемоглобина, а также показателя соотношения ЛПНП и ЛПВП[50]. Тем не менее рандомизированное клиническое испытание, включающее 74 пациентов с НАЖБП и широким диапазоном уровней сывороточного ферритина, не подтвердило позитивное влияние лечебной флеботомии на стеатоз печени и степень ее повреждения, а также показатели гомеостаза глюкозы, включая индекс HOMA-IR и индекс чувствительности к инсулину[51].
Гистологически отложение железа в печени бывает паренхиматозным (гепатоцеллюлярным), мезенхимальным (клетки Купфера и/или портальные макрофаги ретикулоэндотелиальной системы) или смешанным. Паренхиматозная перегрузка железом обычно встречается на ранних стадиях НАЖБП и сопровождается окислительным стрессом, мезенхимальная его локализация связана с ФП и усиленным апоптозом[52], тогда как смешанное распределение железа или скопление в ретикулоэндотелиальных структурах ассоциируется с плохими отдаленными результатами, в частности более высокой смертностью, обусловленной патологией печени или сердечно-сосудистыми заболеваниями[53].
ЗАКЛЮЧЕНИЕ
Ассоциированный с перегрузкой железом печеночный фиброгенез как при наследственном гемохроматозе, так и при хронических заболеваниях печени является неблагоприятным событием их естественного течения, поскольку может привести к циррозу печени и гепатоцеллюлярной карциноме. Механизм его развития сложен и включает реакцию Фентона, клеточные сигнальные пути, активацию звездчатых клеток печени связанными с железом белково-рецепторными комплексами и, возможно, опосредованное железом ремоделирование внеклеточного матрикса.
С целью ранней диагностики ФП и определения оптимальной лечебной тактики больные с перегрузкой железом должны быть стратифицированы по группам риска. Уровень сывороточного ферритина менее 1000 нг/мл на момент постановки диагноза наследственного гемохроматоза остается важным тестом для идентификации пациентов с низкой вероятностью прогрессирующего ФП и должен использоваться как часть начального этапа скрининга. Для выявления перегрузки железом и неинвазивной оценки концентрации железа в печени может быть выполнена МРТ с Т2-взвешенным изображением.
При веских подозрениях на ФП у пациентов с наследственным гемохроматозом предпочтительным методом его диагностики считается биопсия печени, тогда как у страдающих хроническими заболеваниями печени возможно применение неинвазивных тестов.
Для удаления излишка железа предложены три подхода, среди которых флеботомия в настоящее время служит общепринятым стандартом лечения наследственного гемохроматоза. Ее целесообразность у пациентов с хроническими заболеваниями печени при наличии умеренной перегрузки железом обсуждается. Имеющим противопоказания к лечебной флеботомии могут быть назначены хелаторы железа. Эритроцитофорез широкого распространения не получил2.
Поступила: 25.10.2021
Принята к публикации: 28.01.2022
________
1 Перегрузка железом: диагностика и лечение. Национальные клинические рекомендации. М.: Национальное гематологическое общество; 2018. 14 c.
2 European Association For The Study Of The Liver. EASL clinical practice guidelines for HFE hemochromatosis. J. Hepatol. 2010; 53(1): 3–22. DOI: 10.1016/j.jhep.2010.03.001







