ВВЕДЕНИЕ
Рак желудка занимает третье место среди причин онкологической смертности[1]. В 2018 г. в мире было зарегистрировано более 1 млн новых случаев рака желудка и более 800 тыс. человек умерли от этого заболевания[2]. Ведущей парадигмой возникновения рака желудка продолжает оставаться каскад Корреа, который заключается в том, что предраковые изменения в слизистой оболочке желудка предшествуют развитию опухоли[3]. В связи с этим современные международные консенсусы уделяют огромное внимание диагностике, патогенезу, лечению и профилактике атрофического гастрита[4–6]. Несмотря на проведение многих исследований, молекулярные аспекты патогенеза предраковых изменений в желудке остаются неясными[7, 8]. С учетом чрезвычайно высокой заболеваемости раком желудка в Республике Тыва[9] актуальность нашего исследования не вызывает сомнений.
Цель исследования: изучить показатели апоптоза и пролиферации в эпителиоцитах желудка у коренных и пришлых жителей Республики Тыва с атрофическим и неатрофическим гастритом.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследования был выбран п. Сарыг-Сеп Каа-Хемского района Республики Тыва. На основании 30%-ной случайной выборки из общего населения поселка в возрастной группе от 40 до 55 лет нами осуществлен клинический осмотр с проведением фиброэзофагогастродуоденоскопии (ФЭГДС) и забором биопсий из антрального отдела и тела желудка у 673 человек (324 пришлых жителя и 349 тувинцев). Перед ФЭГДС пациентам объясняли целесообразность скрининга предраковых изменений и рака желудка в регионе, характеризующемся аномально высокой заболеваемостью раком желудка независимо от наличия клинической симптоматики. ФЭГДС с забором биопсий осуществлялась только после подписания пациентом информированного согласия.
С учетом того, что 95% пришлых жителей являлись русскими, украинцами и белорусами, в работе в качестве синонима термина «пришлые жители» применяется термин «европеоиды». В работе не ставились задачи изучать влияние длительности проживания пришлых жителей в Республике Тыва, состояния фактического питания и образа жизни на структуру слизистой оболочки желудка.
Клинический осмотр с проведением ФЭГДС и забором биопсий из антрального отдела и тела желудка выполнен у 86 тувинцев и у 91 пришлого жителя в п. Сарыг-Сеп Каа-Хемского района Республики Тыва. Из работы исключались пациенты с эрозивными и язвенными дефектами пищевода, желудка и двенадцатиперстной кишки, а также лица с новообразованиями ЖКТ. В итоге для выполнения исследования отобран 61 тувинец (30 мужчин и 31 женщина, средний возраст — 46,1 года) и 65 пришлых жителей (31 мужчина и 34 женщины, средний возраст — 46,8 года), из них у 91 человека был неатрофический, а у 35 — атрофический гастрит.
Helicobacter pylori определяли у всех 126 пациентов двумя методами: морфологическим (в биоптатах из антрального отдела желудка после окраски по Гимзе и световой микроскопии) и уреазным (в биоптатах из антрального отдела желудка при помощи реактива, приготовленного по прописи: мочевина — 2 г, фенол-рот 0,5% — 10 мл, азид Na — 20 мг в 100 мл 0,01М фосфатного буфера рН = 5,5).
Для морфологического исследования биоптаты слизистой оболочки желудка фиксировались в течение 24 часов в 10%-ном нейтральном формалине, далее по общепринятой методике обезвоживались в спиртах возрастающей концентрации и заливались в парафин. Затем производились срезы толщиной 5 мкм. Для качественной гистологической оценки срезы окрашивались гематоксилином и эозином. Морфологическая диагностика гастрита выполнялась в соответствии с модифицированной Сиднейской классификацией (1994)[10].
Определение маркеров пролиферации и апоптоза осуществлялось иммуногистохимическим методом. Забор биоптатов производился в 10%-ный забуференный формалин по Лилли. Обработка биоматериала выполнялась по стандартным гистологическим методикам с заливкой в парафин. Парафиновые срезы толщиной 5–7 мкм были посажены методом флотации на предметные стекла, обработанные полизином (Thermo Fisher Scientific). Демаскировка антигенов производилась при температуре 95°С в течение 20 минут в термостатируемой водяной бане WB-4MS (BioSan, Латвия) с трис-этилендиаминтетрауксусной кислотой буфером рН 9,0 (Dako, Дания) после депарафинизации в ксилоле с последующей обработкой 3%-ной перекисью водорода.
Далее на срезы наносились разведенные антитела маркеров пролиферации Ki67 (Clone: MIB-1, 1 : 25) и PCNA (Clone: РС10, 1 : 200) и маркеров апоптоза bcl-2 (Clone: 124, 1 : 50) и p53 (Clone: DO-7, 1 : 25) производства фирмы Dako, Дания. Срезы выдерживались 30 минут во влажной камере при комнатной температуре. После этого стекла отмывались в нескольких растворах промывочного буфера (Dako, Дания). Затем на срезы наносилась система визуализации EnVision Detection Systems Peroxidase/DAB (Dako, Дания) в соответствии с протоколом производителя.
Докраска гистологических структур осуществлялась с использованием гематоксилина с последующим закрытием гистологических препаратов монтирующей жидкостью. Препараты оценивались с помощью микроскопа Olympus CX41 (Япония) с системой визуализации БВО-3. Основным рабочим увеличением являлось 400-кратное.
Индекс апоптоза измерялся в процентах с применением стереометрической сетки Г.Г. Автандилова, вмонтированной в окуляр микроскопа в 10 случайных полях зрения в препарате для каждого пациента, и был равен доле клеток и ядер с признаками апоптоза от общего количества клеток. Планиметрическое оборудование тестировалось по объект-микрометру.
В соответствии со ст. 24 Конституции РФ и Хельсинкской декларацией о проведении научных исследований все обследованные были ознакомлены с целями, методами и возможными осложнениями в ходе исследования и подписали информированное согласие на участие в обследованиях.
Статистический анализ данных производился с использованием программной версии MS Exel 2000 и Statistica for Windows, версия 6.0 (StatSoft Inc., США). Результаты исследования показателей, выражающих количественные характеристики, представлены медианой (Ме) и интерквартильным интервалом (С25–С75). Статистическую значимость различий между количественными признаками анализировали с помощью критерия Манна — Уитни. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
РЕЗУЛЬТАТЫ
H. pylori обнаружена у 52 (85,2%) из 61 обследованного коренного жителя и у 53 (81,5%) из 65 пришлых пациентов (ОШ = 1,29; 95%-ный ДИ: 0,51–3,26; p = 0,75).
В обеих популяциях у больных с атрофией в антральном отделе и теле желудка индекс апоптоза, определявшийся по визуализации белка p53, был существенно выше, чем у лиц с неатрофическим гастритом. Индекс антиапоптотического белка bcl-2 не имел существенных колебаний в зависимости от наличия атрофии как у тувинцев, так и у пришлых жителей. Интенсивность пролиферации эпителиоцитов желудка, измерявшаяся по индексам Ki67 и PCNA, не зависела от диагностики атрофии у коренных пациентов, тогда как у пришлых жителей с атрофическим гастритом регистрировалось значимое снижение индексов пролиферации по сравнению с таковыми у больных неатрофическим гастритом (табл. 1, 2).
Таблица 1
Показатели клеточного обновления эпителиоцитов в антральном отделе желудка в зависимости от наличия атрофии у коренного и пришлого населения Республики Тыва, %, Me (C25–C75)
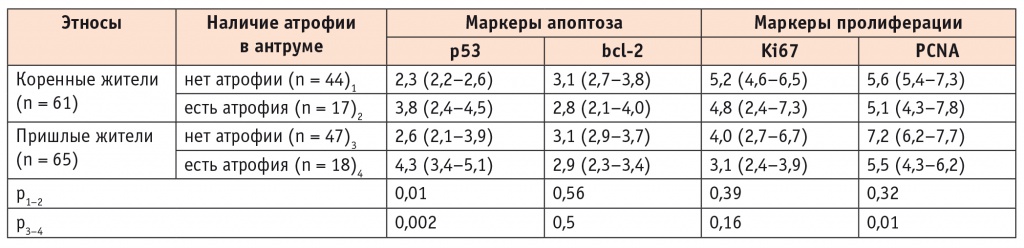
Таблица 2
Показатели клеточного обновления эпителиоцитов в теле желудка в зависимости от наличия атрофии у коренного и пришлого населения Республики Тыва, %, Me (C25–C75)
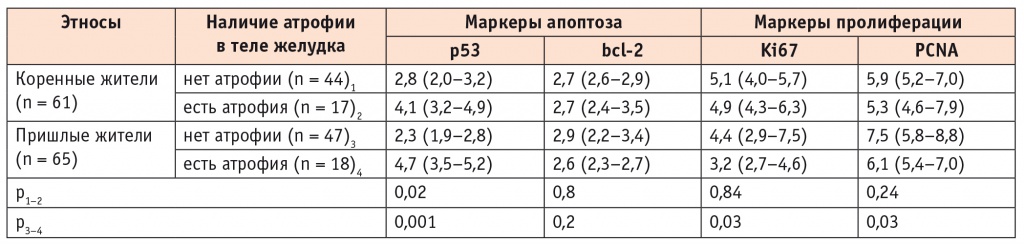
В целом повышение активности апоптоза эпителиоцитов желудка являлось важным аспектом патогенеза атрофии в антральном и фундальном отделах желудка у тувинцев и европеоидов. Но атрофический гастрит у пришлых жителей характеризовался очевидным уменьшением маркеров пролиферации, чего не отмечалось у тувинцев. Это позволяет считать, что развитие атрофии у пришлых пациентов характеризуется более выраженными нарушениями показателей клеточного обновления эпителиоцитов, чем у тувинцев.
ОБСУЖДЕНИЕ
Следует заметить, что результаты изучения процессов апоптоза и пролиферации у больных атрофическим гастритом являются достаточно противоречивыми. Увеличение активности апоптоза — это одна из стандартных концепций объяснения патогенеза атрофического гастрита[11]. Мы обнаружили подобную закономерность в исследовании, выполненном в Эвенкии у коренных и пришлых жителей[12]. Группа исследователей с участием P. Malfertheiner сообщила о снижении активности белка bcl-2, ингибирующего апоптоз, у пациентов с атрофическим гастритом[7].
Вместе с тем в конкретных работах по исследованию клеточной пролиферации существует разногласие. Некоторые авторы полагают, что активность пролиферации эпителиоцитов желудка повышается у пациентов с атрофическим гастритом и кишечной метаплазией[13], другие ученые отрицают эту точку зрения[14].
Возможны два объяснения указанных противоречий. С одной стороны, активно влияет на клеточную пролиферацию генетический полиморфизм белков-регуляторов. В специальном метаанализе установлено, что полиморфизм TP53 72PRO ассоциирован с увеличением заболеваемости раком желудка в азиатских популяциях, но снижал риск рака желудка среди европеоидов[15]. Генетические факторы H. pylori и ее филогенетическое происхождение также могут влиять на экспрессию провоспалительных цитокинов и развитие патологии в желудке[16].
С другой стороны, нам кажется рациональным предположить, что снижение пролиферации соответствует классическому и, видимо, относительно безопасному течению атрофического гастрита. Увеличение активности пролиферации у лиц с атрофическим гастритом, по всей видимости, может стать фактором риска рака желудка.
ЗАКЛЮЧЕНИЕ
В регионе с высокой заболеваемостью раком желудка у больных атрофическим гастритом мы обнаружили повышение активности апоптоза эпителиоцитов как в антральном отделе, так и в теле желудка в обеих обследованных популяциях. Снижение активности пролиферации эпителиоцитов при атрофическом гастрите определялось только у европеоидов, что свидетельствовало о более глубоких нарушениях клеточного обновления желудка у пришлых жителей, чем у коренного населения. Мы предполагаем, что показатели, характеризующие пролиферацию эпителиоцитов, у больных атрофическим гастритом могут быть маркерами риска развития рака желудка.
Поступила: 18.02.2022
Принята к публикации: 18.03.2022







