Рак толстой кишки является актуальной проблемой современной онкологии[1, 6, 13, 27]. Ежегодно в мире регистрируют около миллиона случаев заболевания колоректальным раком (КРР), их них в России — более 50 тысяч[6, 16]. Смертность от рака ободочной и прямой кишки, основной причиной которой является диссеминация процесса в виде отдаленных метастазов, остается высокой[9, 22].
Хирургический метод является золотым стандартом в лечении метастатических очагов, при котором медиана общей выживаемости достигает 35–40 месяцев. К сожалению, резектабельность метастазов КРР в печени и легких не превышает 15–20%[7, 8]. Лишь каждый пятый пациент из общего числа заболевших может рассчитывать на потенциально радикальное лечение, включающее в себя как удаление первичного опухолевого очага, так и резекцию пораженной печени. Хирургический метод лечения позволяет достичь пятилетней выживаемости у 37–45% пациентов, а при комбинированном воздействии — у 50% и более[4, 7, 15]. К сожалению, резектабельность у данной категории больных невысока, и более 80% больных КРР с метастазами в печень подлежат различным методам минимально инвазивного или химиотерапевтического лечения. Поэтому оптимизация терапии метастатических образований в печени и легких является важной задачей современной онкологии, направленной на увеличение продолжительности жизни и улучшение ее качества[5, 9].
С начала 90-х годов прошлого века во всем мире началось широкое внедрение метода минимально инвазивной технологии — радиочастотной абляции (РЧА) опухолей печени[12, 30, 32]. РЧА исходно применяли в качестве циторедуктивной методики у неоперабельных больных, постепенно она заняла более широкую нишу в хирургической гепатологии, включив в себя аспекты обработки среза при резекции печени, а также альтернативы классическому хирургическому лечению операбельных больных с очаговыми новообразованиями печени с высокой степенью операционного риска.
Однако, как и любая другая быстро развивающаяся лечебная методика, РЧА имеет свои нерешенные проблемы. Об этом свидетельствует тот факт, что предложение о стандартизации терминологии, относящейся к РЧА, было принято Международным обществом интервенционных радиологов только в 2005 г. [21].
Целью исследования явились анализ объема и значения предоперационного обследования больных с метастазами КРР в печень и дальнейшее определение показаний и методики выполнения РЧА.
МАТЕРИАЛЫ И МЕТОДЫ
В ФГБУ «Институт хирургии им. А. В. Вишневского» Минздрава России с 2002 по 2014 г. РЧА по поводу метастазов КРР выполнено 112 больным, из них мужчин было 49 (43,7%), женщин — 63 (56,3%). Средний возраст больных составил 51,2 ± 8,2 года. Резекция печени до выполнения термодеструкции была осуществлена 68 (37,4%) больным.
Всем пациентам проводили предоперационное обследование, позволявшее оценить соматический статус пациента, определить характер и объем поражения печени (УЗИ, КТ, МРТ, позитронно-эмиссионную томографию — ПЭТ) и выявить внепеченочные проявления заболевания (первичную опухоль, локальный рецидив, экстрапеченочные метастатические очаги).
УЗИ в В-режиме выполняли на приборах Acuson-128 ХР/10М (Acuson, США), Siemens Sonoline Sienna, Siemens Elegra (Siemens, Германия), Logiq 400, Voluson 730 (General Electric, США) с применением конвексного датчика частотой 3,5 МГц.
КТ проводили на спиральном компьютерном томографе Tomoscan SR7000 (Philips, Нидерланды). Для улучшения визуализации очаговых образований печени применяли метод внутривенного болюсного контрастирования (йогексол 300) с использованием автоматического инъектора.
МРТ выполняли на магнитно-резонансном томографе Gyroscan Intera (Philips, Нидерланды) с напряженностью магнитного поля 1 Тл.
При подозрении на наличие отдаленных метастазов в шести наблюдениях использовали ПЭТ, результаты которой особенно информативны при метастатическом поражении легких и костной системы.
Клиническое обследование включало сбор анамнестических данных с учетом характера ранее выполнявшихся оперативных вмешательств, особенностей перенесенной химиотерапии, времени с момента выявления очаговых образований печени, а также выявление симптомов злокачественности поражения и сопутствующих заболеваний.
Пациентам выполняли лабораторные исследования по принятым методикам, включавшим в себя общие анализы крови и мочи, биохимический анализ крови, определение показателей коагулограммы, исследование уровней опухолевых маркеров крови: α-фетопротеина (АПФ, N до 15 нг/мл), СА 19-9 (N до 37 ед/мл) и ракового эмбрионального антигена (РЭА, N до 3 нг/мл).
Для верификации диагноза применяли тонкоигольную, а в случае сложной диагностики — толстоигольную биопсию образований под ультразвуковым контролем с последующим цито- либо гистологическим исследованием. В ряде случаев при установлении диагноза ограничивались данными анамнеза в совокупности с результатами визуализационных методов исследования и определением уровней опухолевых маркеров крови: АФП, СА 19-9, РЭА.
Методом световой микроскопии оценивали стандартные гистологические срезы (толщиной 5 мкм, окраска гематоксилин-эозином), полутонкие срезы (толщиной 1–2 мкм, окраска толуидиновым синим). Применяли также метод электронной микроскопии.
Для исключения локального рецидива больным с метастазами КРР выполняли колоноскопию (по показаниям — ирригографию).
С целью выявления экстрапеченочной диссеминации всем больным проводили рентгенографию, а начиная с сентября 2004 г. — КТ грудной клетки с болюсным контрастным усилением.
В послеоперационном периоде все больные получали адъювантную химиотерапию.
Для статистической обработки информации использовали пакет статистических программ Statistica (StatSoft Inc., США). Сравнение двух групп количественных признаков, имевших нормальное распределение, проводили с помощью Т-критерия Стьюдента. Качественные признаки и количественные признаки, не имевшие нормального распределения, сравнивали с использованием непараметрических методов: критерия Уилкоксона и U-критерия Манна — Уитни. Для выявления корреляций двух признаков применяли критерий Спирмена[2]. Результаты представлены в форме, рекомендованной Международной рабочей группой по вопросам абляции опухолей под контролем визуализационных методов технологического комитета Между-народного общества интервенционных радиологов (Society of Interventional Radiology Technology Assessment Committee; International Working Group on Image-Guided Tumor Ablation) [20, 21].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При выполнении УЗИ оценивали число, размеры, форму, структуру, контуры и сегментарную локализацию образований печени (рис. 1). Дуплексное сканирование в режимах цветового доплеровского картирования, энергии отраженного доплеровского сигнала и импульсной доплерографии помогало провести оценку васкуляризации очага, его взаимоотношений с магистральными сосудами печени (рис. 2) и крупными желчными протоками, определить безопасные трассы для предстоящего введения электродов.
Рис. 1. Ультразвуковое изображение метастазов колоректального рака в печень в В-режиме: различные типы изображения метастатических очагов. Фото авторов.
Примечание. А: MET — метастаз; Б: M — метастаз (указан метками), VHD — правая печеночная вена, VHM — срединная печеночная вена, VHS — левая печеночная вена
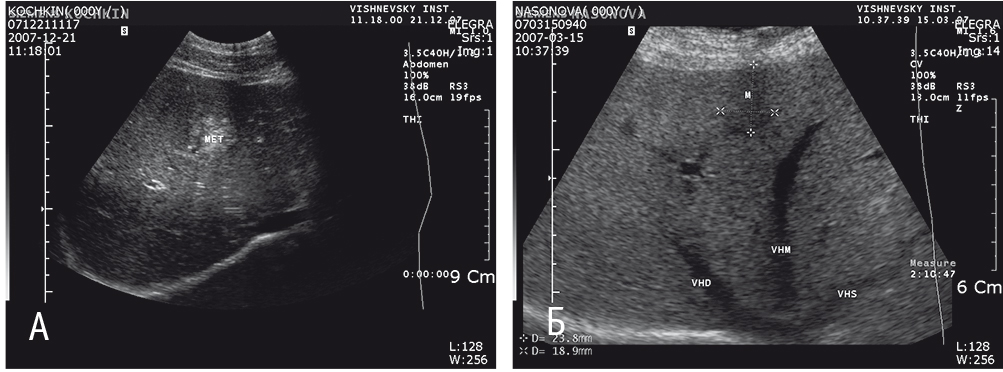
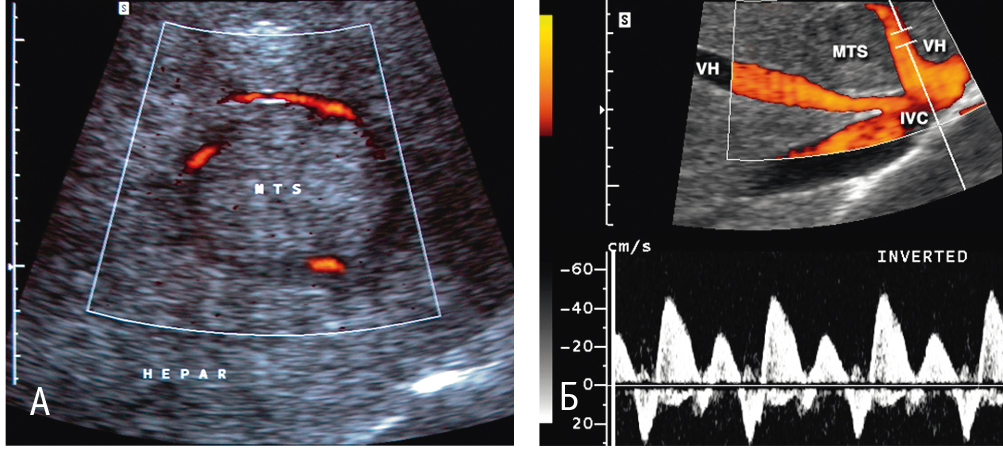
Рис. 2. Ультразвуковое изображение метастаза колоректального рака в печень при дуплексном сканировании. Фото авторов.
Примечание. А — в режиме энергии отраженного доплеровского сигнала — ЭОДС (MTS — метастаз, HEPAR — печень); Б — в режимах ЭОДС и импульсной доплерографии (MTS — метастаз, IVC — нижняя полая вена, VH — печеночная вена)
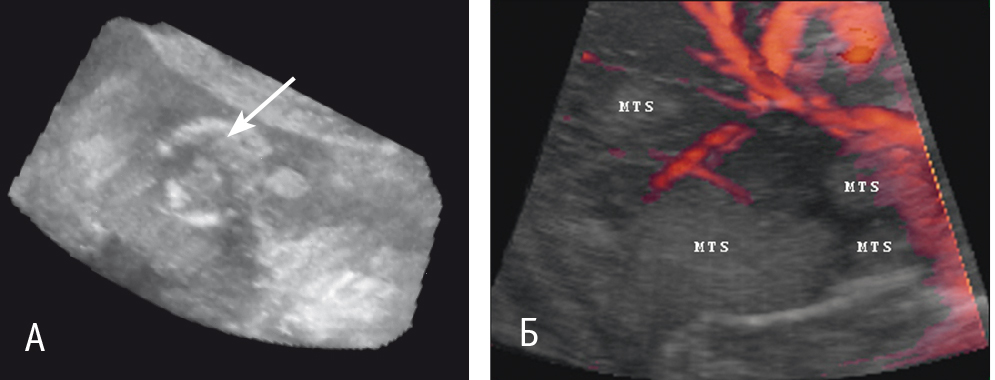
Оценка взаимоотношений образований с магистральными сосудами печени не всегда была возможна при двухмерном исследовании, так как вследствие разнонаправленности хода смещенных и патологических сосудов они прослеживались отдельными локусами. Построение трехмерной реконструкции ультразвукового изображения образований печени и окружающих их сосудов (в В-режиме, режиме ультразвуковой ангиографии, а также при их сочетании) позволило визуализировать магистральные сосуды печени на всем протяжении (рис. 3).
Рис. 3. Трехмерная реконструкция ультразвукового изображения метастазов колоректального рака в печень. Фото авторов.
Примечание. А — в В-режиме (метастаз указан стрелкой); Б — совмещенное изображение в В-режиме и в режиме ультразвуковой ангиографии (MTS — метастазы)
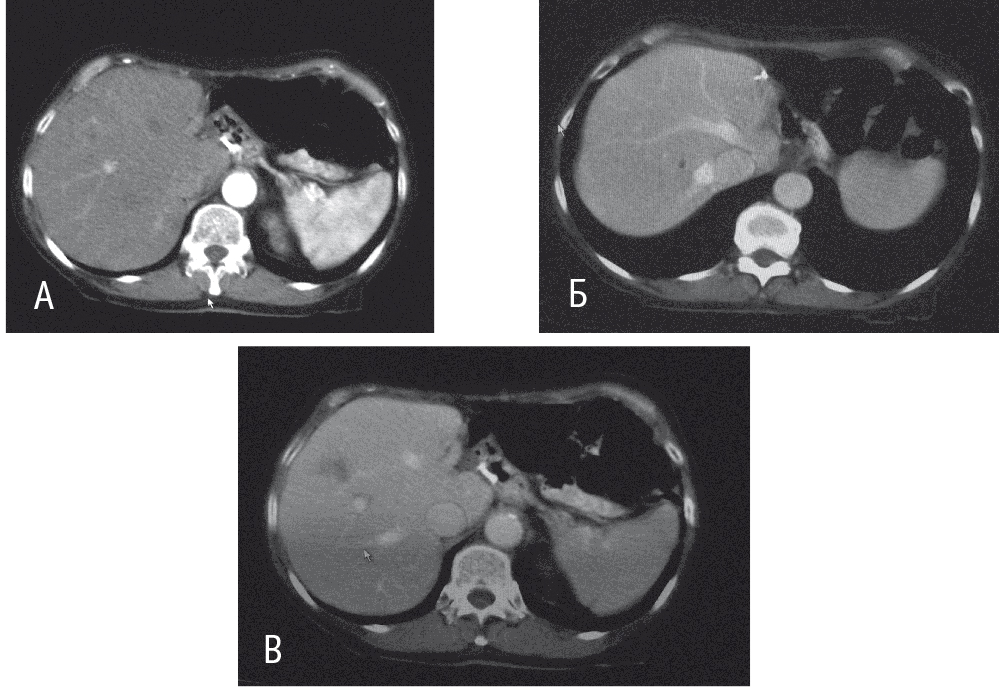
При проведении КТ изображение оценивали в нативную, а также, после введения контрастного вещества, в паренхиматозную, артериальную, венозную и отсроченную фазы исследования (рис. 4).
Рис. 4. Изображения метастаза колоректального рака, полученные в ходе компьютерной томографии у больной, ранее перенесшей левую кавальную лобэктомию по поводу метастазов. Фото авторов.
Примечание. А — артериальная фаза; Б — венозная фаза; В — отсроченная фаза исследования
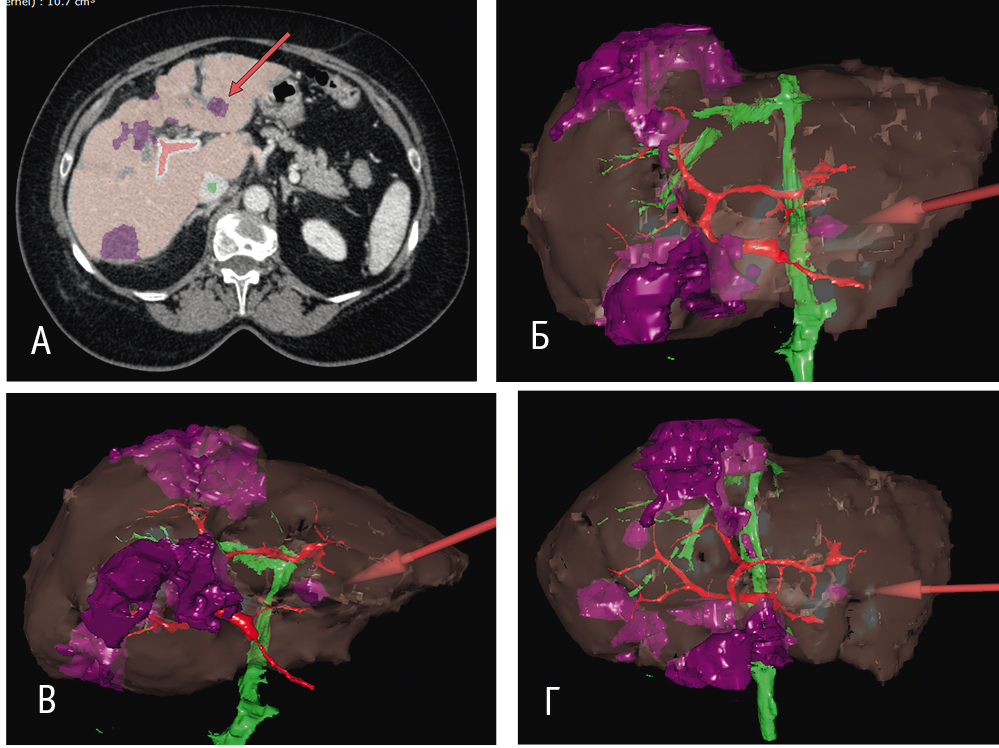
Построение трехмерного КТ-изображения в значительной степени облегчало получение пространственного представления о локализации очагов, прилежании магистральных сосудов и желчных протоков. Использование методики виртуальной хирургии (рис. 5) во многом способствовало выбору оптимального метода вмешательства.
Рис. 5. Построение трехмерного изображения печени при метастазах колоректального рака в ходе компьютерной томографии (КТ). Фото авторов.
Примечание. А — аксиальный срез; Б–Г — трехмерное моделирование КТ-изображения в разных проекциях (стрелками указан очаг для воздействия радиочастотной абляции)
При проведении МРТ получали Т1- и Т2-взвешенные изображения в аксиальной, коронарной и сагиттальных проекциях с использованием импульсных последовательностей FFE, T1- и TSE, STIR (рис. 6, 7), Т2-взвешенные изображения с подавлением сигнала от жировой ткани. При сложности дифференцировки зон РЧА (ранее выполненных) от опухолевой ткани проводили внутривенное болюсное контрастное усиление с использованием импульсной последовательности FFE, взвешенной по времени релаксации Т1. При контрастировании оценивали изображения в артериальную, венозную и отсроченную фазы (рис. 8).
Рис. 6. Магнитно-резонансное изображение метастаза колоректального рака в VI сегмент печени, последовательность с коротким интервалом инверсионной задержки (далее — STIR). Фото авторов
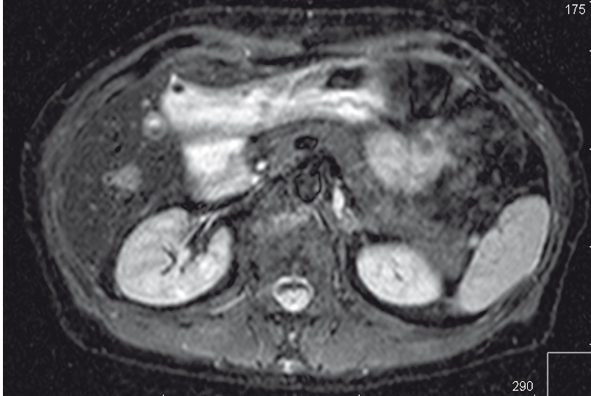
Рис. 7. Магнитно-резонансное изображение множественных метастазов в печень, STIR. Фото авторов
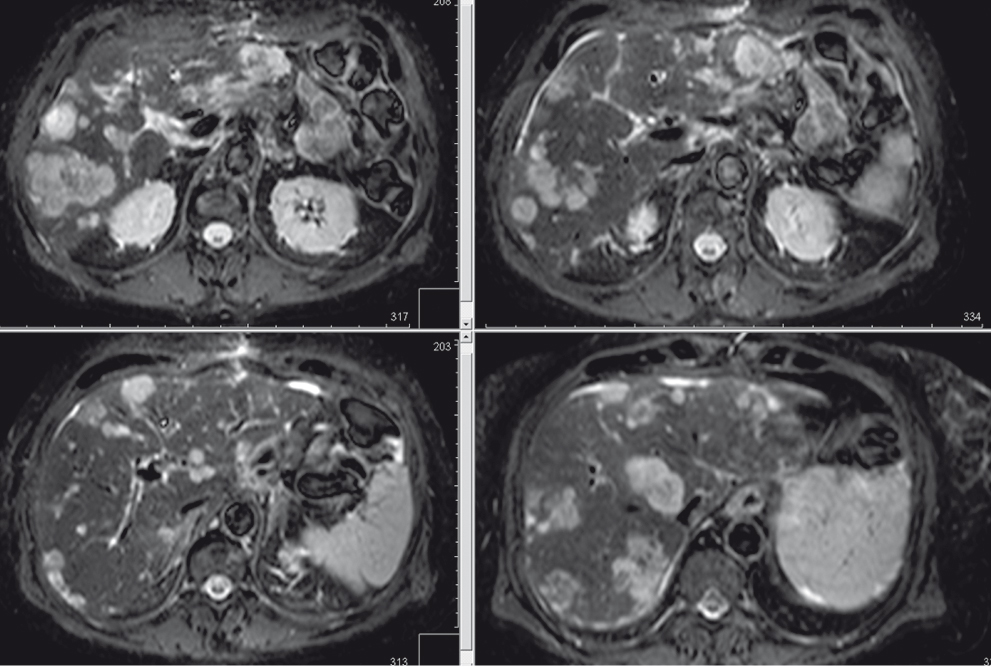
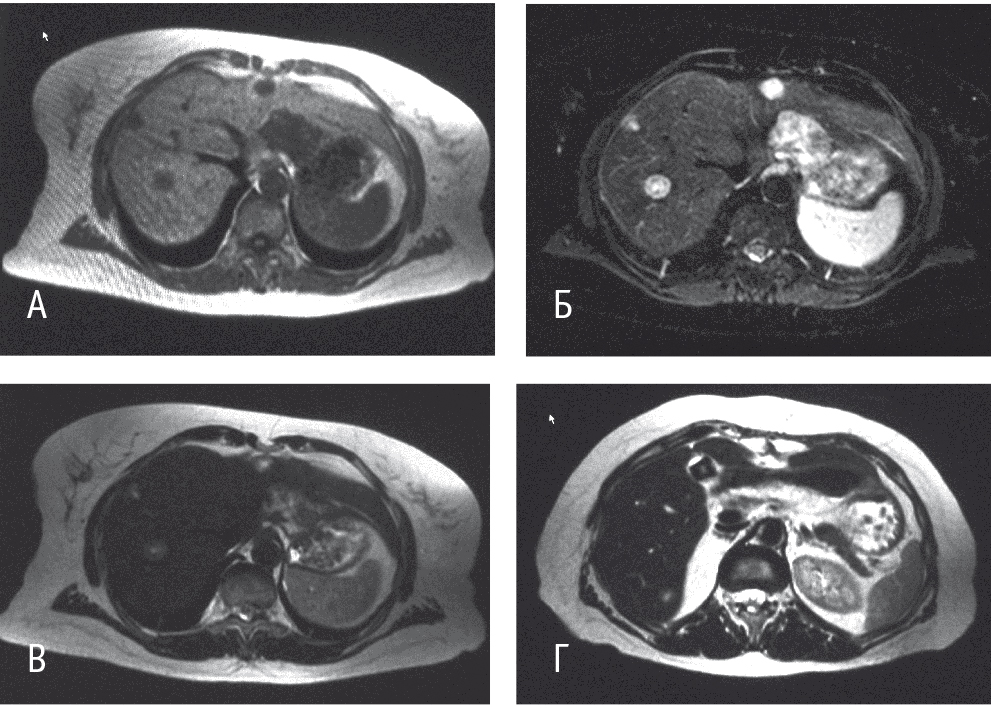
Рис. 8. Магнитно-резонансное изображение метастазов колоректального рака в печень. Фото авторов.
Примечание. А — T1/FFE, взвешенное изображение; Б — STIR; В, Г — Т2/TSE, взвешенные изображения на разных уровнях
Число и размеры метастазов КРР, подвергнутых РЧА, представлены в таблицах 1, 2.
Таблица 1
Число метастазов колоректального рака
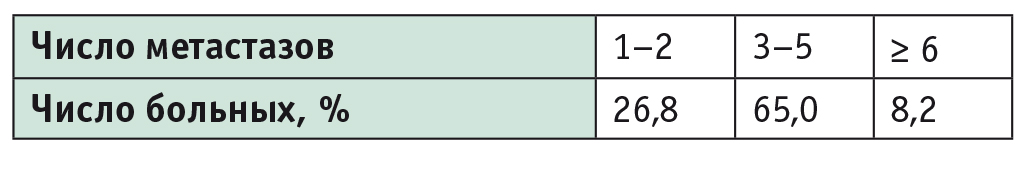
Таблица 2
Размеры метастазов колоректального рака, см

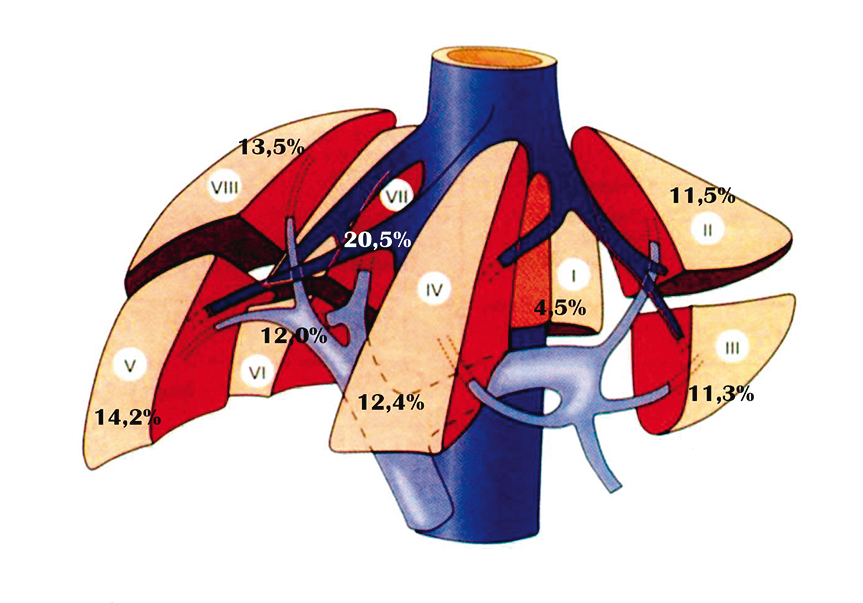
На рисунке 9 отмечена следующая частота поражения сегментов печени: I сегмент — 4,5%; II — 11,5%; III — 11,3%; IV — 12,4%; V — 14,2%; VI — 12,0%; VII — 20,5%; VIII сегмент — 13,5%. Таким образом, по нашим данным, чаще поражается VII сегмент печени, далее несколько чаще, чем другие, — V и VIII сегменты. Частота поражения левой кавальной доли составила 22,8%, а всей левой доли — 39,7%. Частота метастатического поражения VII–VIII сегментов составила 34,0%, а всей правой доли — 60,2%.
Рис. 9. Частота локализации метастазов колоректального рака в различных сегментах печени
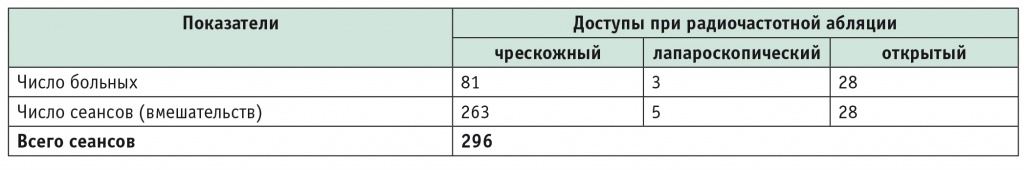
В таблице 3 представлены данные о числе сеансов РЧА в зависимости от вида доступа. Как видно из таблицы 3, РЧА в ходе лапаротомного вмешательства (см. рис. 2) была выполнена у 28 пациентов, причем в 16 (57,1%) наблюдениях одновременно с резекцией печени. Методом чрескожной РЧА (чРЧА) проведено 263 сеанса термодеструкции у 81 больного с метастазами КРР в печень. Среднее число сеансов чРЧА составило 2,6 (1–8).
Таблица 3
Число сеансов радиочастотной абляции в зависимости от вида доступа (n = 112)
Важно отметить, что до РЧА различные виды вмешательств на печени перенесли 78 (69,6%) больных.
Общим показанием к выполнению РЧА является наличие узлового типа поражения паренхимы печени, что можно выявить на дооперационном этапе[3, 26].
Для проведения РЧА больным с очаговыми новообразованиями печени целесообразно определить оптимальный вариант вмешательства с учетом всех данных, полученных в ходе дооперационного обследования.
Несмотря на существующие показания к проведению РЧА, в литературе опубликованы сообщения об успешном термическом воздействии на очаг, прилежащий к венам, протокам и желчному пузырю. M. E. Leе и соавт. (2004) приводит примеры успешной РЧА злокачественных новообразований печени, локализующихся в области вхождения печеночных вен в нижнюю полую вену [24], об успешном проведении РЧА при образованиях, расположенных в непосредственной близости от желчного пузыря и долевых протоков[12, 18]. Авторы выполнили охлаждение протоков путем циркуляции физиологического раствора, вводившегося через установленный в холедохе катетер.
За годы применения РЧА в Институте хирургии им. А. В. Вишневского данную манипуляцию выполняли в трех видах: чрескожно, при открытом оперативном вмешательстве, а также в ходе лапароскопического вмешательства. В соответствии с этим на основании собственного опыта и анализа осложнений мы выделяем следующие показания и противопоказания к проведению РЧА.
Показания к проведению чрескожной радиочастотной абляции
- Предшествующее радикальное хирургическое лечение первичной опухоли.
- Отсутствие внепеченочных проявлений поражения.
- Наличие в печени 5 опухолевых образований и менее.
- Диаметр узлов не более 5 см каждый (допустимо подвергать воздействию узлы исходно большего диаметра, регрессировавшие в объеме под воздействием того или иного предшествующего метода лечения).
- Резидуальная опухоль после ранее проведенной РЧА или оперативного метода лечения.
- Местный рецидив опухоли после ранее выполненной РЧА или резекции печени.
- Метахронные метастазы после ранее проведенной РЧА, резекции печени или иного вида лечения.
- Четкая визуализация патологических очагов при УЗИ и КТ/МРТ (в зависимости от способа навигации).
- Возможность достаточно безопасного доступа к опухолевому узлу (достаточная отдаленность от магистральных печеночных сосудов и желчных протоков).
- Отсутствие прорастания (тесного контакта) диафрагмы, почки, желудка, кишки, желчного пузыря.
- Невозможность выполнения оперативного вмешательства в силу соматического состояния.
- Полная обеспеченность возможности экстренной лапаротомии и адекватности традиционного вмешательства.
- Согласие больного на выполнение данного вида лечения.
Показания к проведению радиочастотной абляции в ходе лапароскопического вмешательства
- Отсутствие выраженного спаечного процесса.
- Отсутствие стандартных противопоказаний для всех лапароскопических вмешательств.
- Расположение очага в зонах, доступных лапароскопии.
- Подкапсульное расположение очагов с возможным прилежанием к органам, которые в ходе вмешательства возможно обезопасить отведением от термического воздействия.
- При билобарном поражении печени наличие единичных небольших (до 5 см) узлов в правой доле, в то время как образование левой доли может быть удалено лапароскопически.
- Возможность обеспечения достаточно полноценного ультразвукового контроля брюшной полости.
- Полная обеспеченность возможности экстренной лапаротомии и адекватности традиционного вмешательства.
- Согласие больного на выполнение данного вида лечения.
Показания к проведению радиочастотной абляции в ходе традиционного вмешательства
- Билобарное поражение, при котором возможно удалить бо́льшую часть пораженной печени и подвергнуть РЧА остающиеся очаги.
- Прилежание к органам брюшной полости и забрюшинного пространства, магистральным сосудам и диафрагме, когда возможно отделение (резекция) этих участков.
- Заранее планируемое сочетанное вмешательство.
- Выраженный спаечный процесс в брюшной полости, особенно после ранее произведенных операций на печени, когда патологический очаг расположен непосредственно по краю резекции.
- Наличие кроме внутрипеченочного еще и экстраорганного, но удалимого опухолевого узла.
- Общее операбельное состояние пациента.
- Согласие больного на выполнение данного вида лечения.
Противопоказания к проведению радиочастотной абляции
- Наличие у пациента искусственного водителя ритма с полиуретановым покрытием электродов.
- Цирроз печени класса С (по Чайлду).
- Некорригируемая коагулопатия.
- Прорастание петли кишки, желчного пузыря, стенки желудка на значительном протяжении.
- Выраженная диссеминация опухолевого процесса.
- Общие противопоказания к хирургическому лечению.
- Отказ пациента от выполнения данного вида лечения.
Литературные данные о результатах применения РЧА представлены в таблице 4.
Таблица 4
Литературные данные о числе пациентов, подвергшихся радиочастотной абляции, видах доступа и результатах лечения
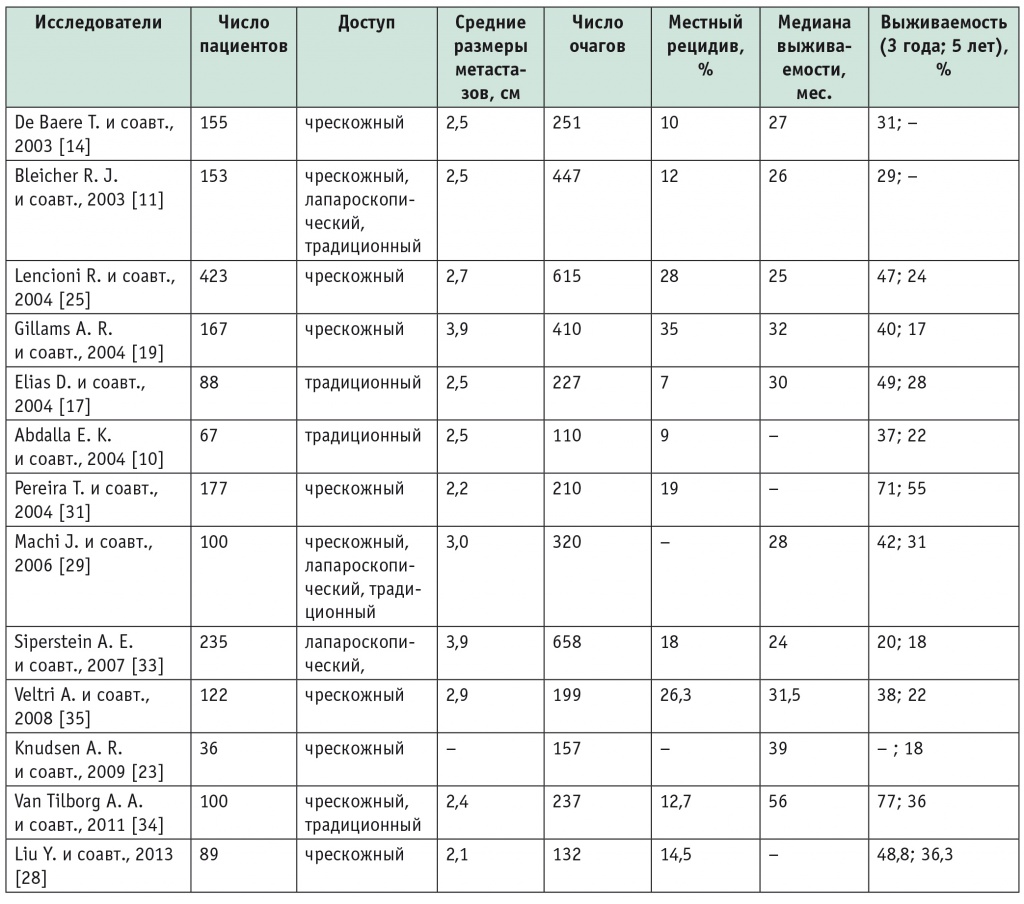
Многие авторы не делают принципиального различия между доступами для непосредственного проведения сеанса термодеструкции. Как видно из таблицы 4, если авторы используют несколько доступов, то даются усредненные результаты. Несмотря на то что больным не выполняли резекционное вмешательство, пятилетняя выживаемость достигала 30–50%.
Зачастую выбор того или иного доступа для проведения РЧА осуществляют не столько из-за анатомических особенностей локализации патологического очага, сколько в силу предпочтения оперирующего хирурга.
ЗАКЛЮЧЕНИЕ
Радиочастотная абляция (РЧА) является методом, раздвинувшим границы хирургического лечения больных с метастазами колоректального рака (КРР), поскольку позволяет выполнять хирургическое лечение пациентам с множественным полисегментарным поражением печени и, в отличие от резекции органа, может применяться многократно при появлении новых очагов или при продолжении роста обработанной опухоли.
РЧА должна рассматриваться как альтернатива существующим хирургическим методам и в некоторых случаях — как компонент комбинированного лечения метастазов КРР.








