Современная концепция нутритивной поддержки хирургических больных предполагает не только полноценное обеспечение энергопластическими материалами, но и использование компонентов, позволяющих адекватно корригировать синдром гиперметаболизма-гиперкатаболизма. Программы нутритивной поддержки особенно важны для онкологических больных: к моменту оперативного вмешательства они уже имеют тяжелую белково-энергетическую недостаточность, а обширная операционная травма, выброс медиаторов воспаления еще более усугубляют имеющиеся нарушения вследствие развития в послеоперационном периоде синдрома гиперметаболизма-гиперкатаболизма и синдрома кишечной недостаточности.
Неспецифические реакции гиперметаболизма-гиперкатаболизма проявляются в комплексном нарушении обмена белков, углеводов, липидов, усиленном расходе углеводно-липидных резервов, распаде тканевых белков, прогрессирующей белково-энергетической недостаточности. Субстратом для интенсивно протекающих процессов, перечисленных выше, служат аминокислоты, мобилизующиеся из скелетной мускулатуры и нефункционирующего кишечника [2, 4, 10, 12, 17, 27]. Смещение обменных процессов в сторону катаболизма приводит к возникновению белково-энергетической недостаточности, резистентной к стандартной нутритивной поддержке естественными пищевыми субстратами. Таким образом, синдрому гиперметаболизма-гиперкатаболизма принадлежит ведущая роль в патогенезе критических состояний и органной дисфункции, которые непосредственно влияют на клинический исход в послеоперационном периоде [5, 8, 24, 25, 27].
Безусловно, одним из главных элементов ведения оперированных пациентов в онкологии является раннее энтеральное питание [22, 32]. Но при наличии органических или функциональных нарушений ЖКТ в периоперационном периоде его осуществление не всегда возможно. В связи с этим встает вопрос об эффективном парентеральном введении всех необходимых субстратов и фармаконутриентов. Полное внутривенное питание в настоящее время позволяет скорригировать гиперметаболическую реакцию организма на стресс, полностью устранить или значительно сократить проявления белково-энергетической недостаточности, обусловленные хирургическим вмешательством [5, 11, 14, 16]. Однако парентеральное питание (ПП) не является физиологичным и исключает реализицию естественных пищеварительно-транспортных процессов.
Назначение полного ПП должно определяться четкими показаниями, основанными на результатах исследования функционального состояния ЖКТ и на объективном доказательстве невозможности энтерального поступления нутриентов либо того, что энтеральное введение последних не покрывает всех энергетических и пластических потребностей. Поддержание белкового обмена на должном уровне с целью снижения гиперкатаболической реакции организма и обеспечения пластических процессов — один из критериев адекватности ПП больных в критических состояниях. Соответственно, компенсация расхода азота и достижение положительного азотистого баланса для поддержания безжировой массы тела — важнейшие задачи ПП [3].
ПП должно быть сбалансированным и по количеству, и по качеству ингредиентов, а также включать азотсодержащие и энергетические вещества, электролиты, витамины, микроэлементы, фармаконутриенты. Весь набор нутриентов, необходимых для реализации полного ПП, можно разделить на две основные группы: пластический материал для синтеза белка (растворы аминокислот) и источники энергии (углеводы, липиды). Вода, электролиты, а также витамины и микроэлементы относятся к разряду незаменимых веществ [5, 11, 18, 20].
Глюкоза является одним из основных источников энергии при ПП, ее недостаточное поступление ведет к усилению глюконеогенеза и, соответственно, к увеличению скорости потерь белка. Это обусловлено тем, что в отсутствие энергетического обеспечения организм использует введенные или эндогенные аминокислоты в качестве источника энергии, а не для пластических целей.
Жировые эмульсии относятся к наиболее эффективным энергетическим субстратам при полном ПП в связи с высокой энергетической ценностью (1 г — 9,3 ккал) и возможностью обеспечения организма незаменимыми жирными кислотами в малом объеме жидкости. Стоит отметить, что между обменом углеводов, аминокислот и липидов существует тесная взаимосвязь [15, 18].
Включение в программу периоперационной нутритивной поддержки антиоксидантов, препаратов, способных влиять на метаболические, воспалительные процессы, в настоящее время считается наиболее перспективным подходом к лечению синдрома гиперметаболизма-гиперкатаболизма и системной воспалительной реакции [2, 19, 22]. Доказано, что активация процессов перекисного окисления липидов (ПОЛ), возникающий дисбаланс между проокислительными механизмами и системами антиоксидантной защиты играют значимую роль в генезе стресс-опосредованных реакций, метаболических нарушений в организме в послеоперационном периоде [1, 7, 29]. Главным природным антиоксидантом, растворимым в липидах и защищающим мембраны и липопротеины от ПОЛ, является витамин E (альфа-токоферол). Образуя комплекс с селеном и полиненасыщенными жирными кислотами (в основном с арахидоновой кислотой), он подавляет липо- и циклооксигеназный пути окисления арахидоновой кислоты (синтез простагландинов и лейкотриенов), активирует эритропоэз, синтез гема, участвует в процессе регуляции степени проницаемости клеточных мембран. Включение витамина Е в комплекс ПП позволяет предотвратить реперфузионное поражение печени при ее ишемии [26].
Основной способ реализации ПП — введение энергетических и пластических источников в сосудистое русло. На практике это выполняется посредством пункции и катетеризации одной из периферических или центральных вен (подключичной, внутренней яремной, бедренной) [25]. Для больных хирургического профиля адекватным сосудистым доступом чаще всего становится центральная вена, даже с учетом того, что длительное нахождение катетера повышает риск развития септических осложнений, а сама процедура катетеризации — риск технических и механических осложнений [14, 21].
Для хирургических пациентов важно адекватное и своевременное поступление энергетических субстратов при минимальной возможности микробной контаминации вводимых растворов через флаконы или магистрали. Разработанная в 1972 г. система ПП «3 в 1» явилась альтернативой флаконной методике ПП. Преимущества такого подхода состоят в том, что при нем используются один контейнер, одна инфузионная система и один инфузионный насос и, кроме того, можно индивидуализировать объем ПП в соответствии с потребностями конкретного больного [3].
Таким образом, адекватное и своевременное обеспечение послеоперационных больных энергетическими субстратами и коррекция синдрома гиперметаболизма-гиперкатаболизма — залог благоприятного клинического исхода. Нутритивная поддержка, способы ее реализации могут оказать позитивное влияние как на результат лечения, так и на качество жизни пациента.
Цель исследования: определить эффективность послеоперационного ПП с использованием системы «3 в 1» СМОФКабивен центральный в коррекции метаболических нарушений у больных кардиальным раком пищевода.
Характеристика препарата СМОФКабивен. СМОФ/SMOF — аббревиатура, включающая первые буквы источников масел, которые входят в его состав: Soya oil — соевое масло; Medium-chain triglycerides — среднецепочечные триглицериды; Olive oil — оливковое масло; Fish oil — рыбий жир. Входя в число зарегистрированных в России трехкамерных контейнеров, линейка СМОФКабивен центральный для ПП включает различающиеся по объему системы «3 в 1». Препарат обеспечивает стабильную скорость введения, снижает риск ошибок, неправильных манипуляций, дополнительной микробной контаминации и значительно уменьшает нагрузку на медицинский персонал больницы [3, 12].
Препарат СМОФКабивен предназначен не только для пациентов с синдромом гиперметаболизма-гиперкатаболизма, но и для больных с тяжелой белково-энергетической недостаточностью, у которых доставка энергосубстратов энтеральным путем затруднена либо невозможна. СМОФКабивен центральный производит иммуномодулирующее действие благодаря включению в его состав таких фармаконутриентов, как омега-3 жирные кислоты, таурин, витамин Е, цинк, а также оказывает положительное влияние за счет гепатопротекторных свойств высоких доз антиоксидантов и способствует снижению воспалительной реакции. СМОФКабивен периферический обладает теми же свойствами, но предназначен преимущественно для дополнительного питания детей с 2 лет и взрослых (табл. 1).
Таблица 1
Характеристика препаратов линейки СМОФКабивен
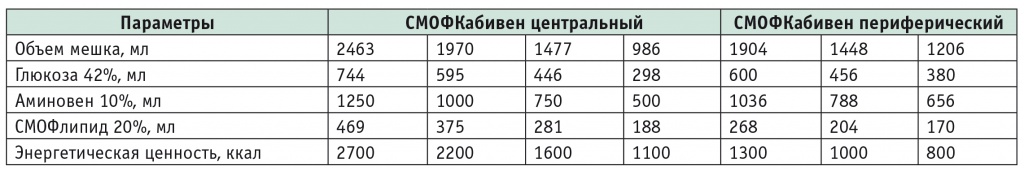
Дозы препарата СМОФКабивен центральный от 13 до 31 мл/кг/сут соответствуют количеству азота 0,10–0,25 г/кг/сут (0,6–1,6 г/кг/сут аминокислот) и общей энергии 14–35 ккал/кг/сут (12–27 ккал/кг/сут небелковой энергии). Максимальная суточная доза составляет 35 мл/кг. СМОФКабивен периферический: дозы от 20 до 40 мл/кг/сут соответствуют количеству азота 0,10–0,20 г/кг/сут (0,6–1,3 г/кг/сут аминокислот) и общей энергии 14–28 ккал/кг/сут (11–22 ккал/кг/сут небелковой энергии) [9].
В состав препарата СМОФКабивен входит жировая эмульсия СМОФлипид, которая по размерам частиц и биологическим свойствам идентична эндогенным хиломикронам. По данным S. Klek и соавт., длительное (в течение 4 суток) применение такого компонентного состава хорошо переносится пациентами и позитивно влияет на биохимический скрининг профиля жирных кислот [23].
К преимуществам жировой эмульсии СМОФлипид можно отнести сохранение положительных качеств отдельно взятых компонентов. Соевое масло богато линолевой кислотой (приблизительно 55–60%), которая входит в число омега-6 жирных кислот; 8% состава соевого масла представлено α-линоленовой кислотой, относящейся у омега-3 жирным кислотам.
Жировая эмульсия, входящая в состав препарата СМОФКабивен центральный, обеспечивает необходимое количество незаменимых жирных кислот. Благодаря способности среднецепочечных жирных кислот быстро окисляться, организм получает быстродоступную энергию, а оливковое масло поставляет энергию в форме мононенасыщенных жирных кислот, которые намного меньше подвержены окислению, чем соответствующее количество полиненасыщенных кислот.
Выявлено влияние омега-9 жирной кислоты (оливкового масла) на иммунологические показатели [31]:
-
слабое воздействие на пролиферацию лимфоцитов или активность NK-клеток, на реактивность нейтрофилов либо его отсутствие;
-
предотвращение высвобождения определенных хемотаксических молекул (например, ICAM-1);
-
незначительное влияние на продукцию эйкозаноидов.
Сделаны выводы, что эмульсия из оливкового масла иммунонейтральна и может применяться у большинства пациентов при различных состояниях (лица, нуждающиеся в длительном ПП; больные хирургического профиля; больные в критических состояниях, в том числе с усиленной или ослабленной воспалительной реакцией) [29, 30]. Рыбий жир характеризуется высоким содержанием эйкозапентаеновой и докозагексаеновой кислот. При добавлении их к жировым эмульсиям происходит выраженное воздействие на клеточные мембраны и воспалительные процессы (уровень B).
В состав препарата СМОФКабивен входит весь спектр заменимых и незаменимых аминокислот, которые заметно влияют на метаболизм белков и процессы анаболизма. Концентрация аминокислот такова, что позволяет покрывать их дефицит в условиях хирургической агрессии. СМОФКабивен содержит таурин — аминокислоту, которая становится незаменимой в условиях стресса. Роль таурина в организме многообразна и включает стабилизацию мембран клеток, осморегуляцию, антиоксидантное действие, стимуляцию гликолиза и глюкогенеза, влияние на обмен кальция. Доказано, что в условиях хирургического вмешательства и патологических процессов концентрация таурина в плазме крови резко снижается. Количество таурина, которое содержит СМОФКабивен, позволяет адекватно и своевременно восполнить этот дефицит [23, 28]. Различная концентрация раствора аминокислот в мешках СМОФКабивена объемами от 986 до 2463 мл дает возможность применять каждый из них в зависимости от индивидуальных потребностей пациента в белке и от пути реализации ПП.
МАТЕРИАЛЫ И МЕТОДЫ
Проспективное контролируемое сравнительное рандомизированное исследование выполнено в отделении реанимации и интенсивной терапии (ОРИТ) Главного военного клинического госпиталя имени академика Н. Н. Бурденко в период с февраля по декабрь 2015 г. В основу работы положены результаты клинического исследования, проведенного
у 43 мужчин с опухолями кардиального отдела пищевода, средний возраст которых составил 67,9 ± 10,5 года.
Критерии включения в исследование:возраст старше 18 лет; предполагаемое обширное плановое оперативное вмешательство (резекция средней и нижней трети пищевода, резекция ножек диафрагмы с пластикой толстокишечным трансплантатом по Герлоку или Накаяма); отсутствие сахарного диабета.
Критерии исключения: возраст старше 80 лет; невозможность выполнения операции (ввиду распространенности ракового процесса и т. п.) или отказ от оперативного вмешательства.
Операцию, выполненную под сочетанной анестезией (ингаляционная анестезия с ИВЛ в сочетании с эпидуральной блокадой на грудном уровне), завершали дренированием плевральной полости и интубацией тонкой кишки двухпросветным интестинальным зондом, который также использовался для проведения кишечного лаважа и энтерального питания. Комплекс базисной интенсивной терапии послеоперационного периода у всех обследованных был одинаков и включал в себя продленную эпидуральную аналгезию, коррекцию гиповолемии и анемии, гемодинамическую и респираторную поддержку, коррекцию водно-электролитного обмена и кислотно-основного состояния, антибактериальную терапию, терапию синдрома кишечной недостаточности, нутритивную поддержку.
В соответствии с задачами работы все больные методом закрытых конвертов были рандомизированы на две группы.
В первую группу (группу сравнения) вошел 21 пациент. В послеоперационный период ПП в этой группе осуществляли с использованием системы «3 в 1» Кабивен центральный: на 2–4-е сутки — в объеме 2053 мл (энергетическая ценность — 1900 ккал/сут), на 5-е сутки — 1540 мл (1400 ккал/сут), на 6-е сутки — 1026 мл (900 ккал/сут). На 7-е сутки ПП прекращали.
У 22 пациентов второй (основной) группы в составе послеоперационной нутритивной поддержки применяли СМОФКабивен центральный: на 2–4-е сутки — в объеме 1970 мл (2200 ккал/сут), на 5-е сутки — 1477 мл (1600 ккал/сут), на 6-е сутки — 986 мл (1100 ккал/сут). На 7-е сутки ПП прекращали.
В обеих группах с первых часов послеоперационного периода через назоинтестинальный зонд проводили кишечный лаваж глюкозо-электролитным раствором (ГЭР). По мере восстановления всасывательной и переваривающей функций тонкой кишки переходили на внутрикишечное введение ГЭР (в 1-е сутки — декомпрессия кишки и кишечный лаваж ГЭР, на 2-е сутки — введение 800 мл ГЭР, на 3-и сутки — внутрикишечная инфузия 1200 мл ГЭР), а с 4–5-х суток давали энтеральное питание стандартной смесью нараставшей нутритивной ценности: от 0,5 ккал/мл (500 мл) на 4–5-е сутки до 1 ккал/мл (2000–2500 мл) на 7-е сутки.
С целью определения степени питательной недостаточности всем пациентам при поступлении в стационар проводили скрининг по шкале Nutritional Risk Screening 2002 (NRS-2002). Это позволило определить наличие или отсутствие питательной недостаточности на начальном этапе исследования.
При поступлении в ОРИТ после оперативного вмешательства больным в 1-е сутки производили интегральную оценку показателей тяжести состояния с использованием шкалы Acute Physiological and Chronic Health Evaluation II (APACHE II), что является важным прогностическим критерием исхода заболевания и эффективности проводимого лечения.
В послеоперационном периоде эффективность нутритивной поддержки оценивали в течение 10 суток. На 1, 3, 5, 7 и 10-е сутки после оперативного вмешательства, помимо общеклинических исследований, применяли специальные методы, позволяющие определить эффективность нутритивной поддержки в коррекции основных показателей гомеостаза: с помощью анализатора Express+ (Bayer, Германия) измеряли содержание общего белка и его фракций, холестерина, триглицеридов, трансферрина, общего билирубина, трансаминаз, электролитов; с использованием фотометрии (Immundiagnostik, Швейцария) оценивали уровень преальбумина; уреазным методом (аппарат Hitachi 902, Roche Diagnostics GmbH, Германия — Япония) — концентрации креатинина и мочевины в суточной моче. Потребности в энергии определяли посредством непрямой калориметрии (прикроватный монитор 6-03 «Тритон», компания «Тритон-ЭлектроникС», Россия).
Инструментальную оценку восстановления функциональной структурности ЖКТ проводили с помощью зондовой энтерографии водорастворимым контрастом на 1, 3 и 5-е сутки послеоперационного периода. Оценивали характер перистальтики, форму, величину, рельеф стенок, структурную целостность кишки, отсутствие или наличие затеков контрастного вещества [13].
Статистическая обработка материала выполнена с использованием методов вариационной статистики (программа SPSS). Определяли значения среднего арифметического (М), стандартного отклонения (SD), стандартной ошибки среднего (SE), медианы, 25-го и 75-го процентилей. Для проверки нормальности распределения применяли критерий Колмогорова — Смирнова. Сравнения в двух независимых группах переменных производили с помощью непараметрического критерия Манна — Уитни или параметрического критерия Стьюдента (для количественных данных); сравнения в двух связанных группах — с помощью критерия Уилкоксона. Различия считали статистически значимыми при p ≤ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ результатов скрининга по шкале NRS-2002 показал, что при поступлении в стационар у больных имелась питательная недостаточность 3-й (69,7%) и 2-й (30,3%) степени. По исходным показателям тяжести состояния существенных различий между группами не было.
При поступлении в ОРИТ интегральная оценка тяжести состояния пациентов по шкале APACHE II составила 14,8 ± 3,9 балла.
Проявлением гиперметаболизма уже в 1-е сутки послеоперационного периода явилось резкое увеличение потребности в донаторах энергии, на 2-е сутки в обеих группах отмечался рост энергопотребности в 2 раза по сравнению со значениями 1-х суток [6]. Истинный расход энергии от 1-х суток к 3-м возрастал в среднем с 1551,4 ± 109,6 ккал/сут до 2990,8 ± 284,7 ккал/сут (p ˂ 0,05). В последующем потребность в энергии снижалась и во второй группе была несколько ниже, чем в первой (рис. 1).
Рис. 1. Изменения в расходе энергии от первых к седьмым суткам послеоперационного периода, ккал/сут.
* P < 0,05 при сравнении с первыми сутками.
Примечание. Здесь и далее: в первой группе в состав нутритивной поддержки входил препарат Кабивен центральный, во второй — СМОФКабивен центральный
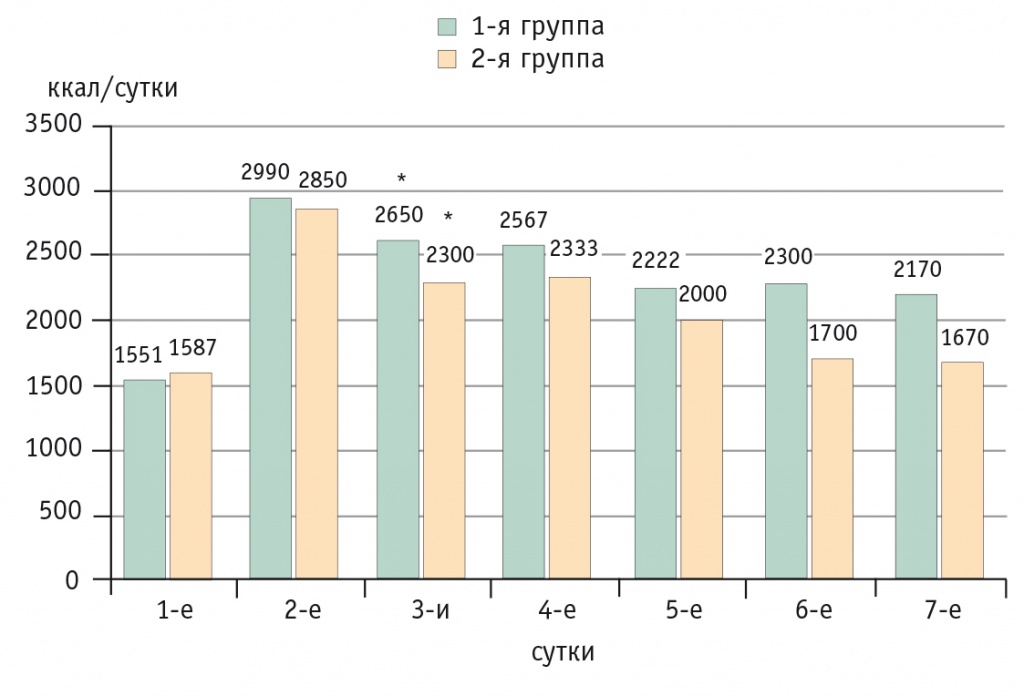
Существенной разницы в обеспечении энергией между группами не выявлено вследствие того, что с 4–5-х суток в программу нутритивной поддержки включали энтеральное питание.
Развившаяся уже на 1-е сутки диспротеинемия соответствовала периоду гиперметаболической реакции (табл. 2). Интенсивность катаболизма с усиленным распадом мышечных белков отражали значительное повышение суточной экскреции азота с мочой (в первой группе 17,2 ± 1,9 г/сут, во второй — 16,9 ± 1,8 г/сут) и выраженный отрицательный баланс азота (в первой группе –25,8 ± 1,3 г/сут, во второй — –26,0 ± 1,4 г/сут). Отрицательный азотистый баланс был обусловлен не только усилением катаболизма белков, но и нарушением их синтеза, что является проявлением стрессовых нарушений.
Таблица 2
Динамика показателей белкового обмена в группах исследования в послеоперационном периоде (M ± SD), г/л
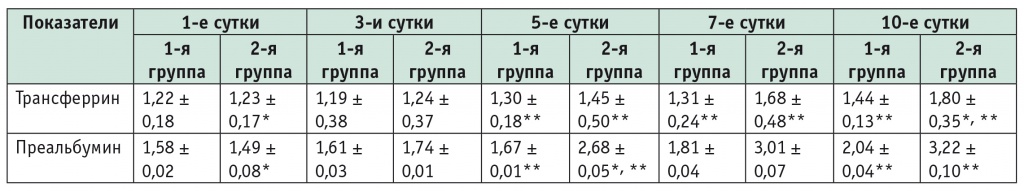
* P < 0,05 при сравнении с первой группой.
** P < 0,05 при сравнении с первыми сутками.
Нарушения липидного обмена также претерпевали изменения, характерные для критического состояния. Активный липолиз и его маркеры определяли в 1-е и 2-е сутки послеоперационного периода в обеих группах. На 3-и сутки во второй группе (при введении СМОФКабивена центрального) уровни триглицеридов в сыворотке крови соответствовали норме: 1,6 ± 0,4 ммоль/л. В первой же группе (при введении Кабивена центрального) отмечали гипертриглицеридемию: 3,8 ± 0,7 ммоль/л. Следует предположить, что она стала следствием снижения активности липопротеинлипазы. На 10-е сутки содержание триглицеридов в обеих группах не выходило за границы нормы.
Расстройства углеводного обмена в виде постагрессивной гипергликемии, связанной с травматичным оперативным вмешательством, наблюдались у всех больных и требовали повышения количества экзогенного инсулина. У пациентов основной группы от 1-х к 5-м суткам уровень глюкозы снизился с 8,9 ± 1,1 ммоль/л до 6,1 ± 1,1 ммоль/л (р < 0,05) (табл. 3).
Таблица 3
Динамика уровня гликемии в группах исследования в послеоперационном периоде (M ± SD), ммоль/л
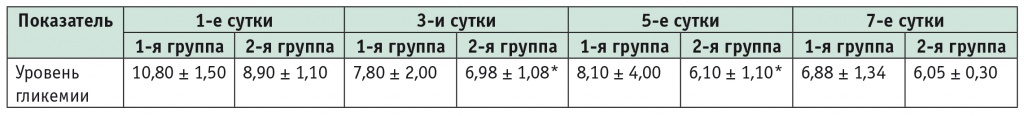
* P < 0,05 при сравнении с первыми сутками.
Одновременно следует отметить, что в первой группе количество инсулина, вводимого за сутки, достигало 121,8 ± 12,7 ЕД, а во второй — 100,4 ± 15,1 ЕД. В группе сравнения гипергликемия и, как следствие, низкая скорость утилизации эндогенной и экзогенной глюкозы, усиленный катаболизм белка стали проявлениями некомпенсированных метаболических нарушений в послеоперационном периоде (см. табл. 3).
На фоне полного парентерального, а затем смешанного парентерально-энтерального питания изменения показателей белкового обмена у больных обеих групп были однонаправлены, однако во второй группе происходили быстрее, чем в первой, притом что сроки и нутритивная ценность энтерального питания в группах исследования были идентичны.
Усиленный распад тканевых белков вследствие тяжелого синдрома гиперметаболизма-гиперкатаболизма удалось компенсировать только к 10-м суткам наблюдения в первой группе и к 7-м суткам — во второй. За счет адекватного содержания спектра аминокислот СМОФКабивен позволяет перекрывать дефицит последних при стрессе. В частности, это касается таурина (0,5–1,2 г), который в условиях хирургической агрессии становится незаменимым.
Уровень общего белка в сыворотке крови во второй группе (61,1 ± 3,9 г/л) превышал таковой в первой (55,8 ± 4,7 г/л) на 10-е сутки послеоперационного периода, и эти значения статистически значимо (p ˂ 0,05) отличались от показателей 1-х суток (рис. 2А). Такая же динамика наблюдалась к 10-м суткам и в уровнях сывороточного альбумина: 26,1 ± 4,1 г/л и 30,4 ± 2,9 г/л в первой и второй группах соответственно, в обоих случаях различия с 1-ми сутками статистически значимы (p ˂ 0,05) (рис. 2Б).
Рис. 2. Динамика показателей общего белка (А) и альбумина (Б) сыворотки крови в послеоперационном периоде, г/л.
* P < 0,05 при сравнении с первыми сутками
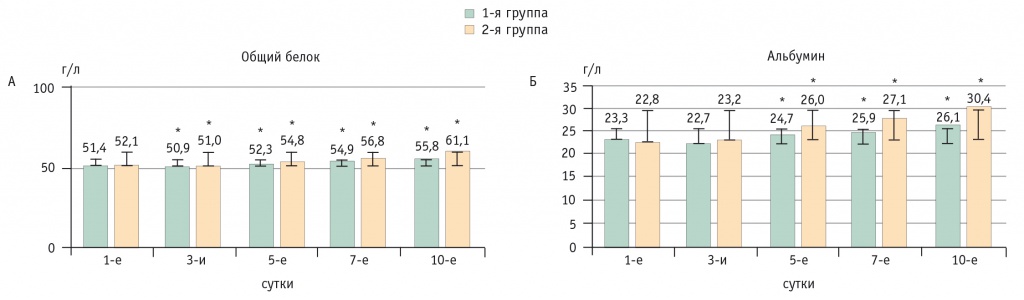
Определенный интерес представляет то, что уже к 5-м суткам уровень трансферрина в сыворотке крови во второй группе превышал таковой в первой группе, а при попарном сравнении с применением критерия Манна — Уитни выявлено, что во второй группе концентрация трансферрина на 10-е сутки была статистически значимо выше, чем в первой (p ˂ 0,05) (см. табл. 2). Полученные результаты во второй группе можно связать с компенсацией белкового обмена на фоне коррекции синдрома кишечной недостаточности и гиперметаболизма-гиперкатаболизма. Это подтверждается не только более высокими показателями сывороточного преальбумина во второй группе, повышением в динамике уровней белка, альбумина и трансферрина в сыворотке крови (см. табл. 2 и рис. 2А, Б), но и нормализацией азотистого баланса.
Выделение азота с мочой у больных второй группы уменьшилось до 7,0 ± 0,4 г/сут. Положительный баланс азота по сравнению с 1-ми сутками к 7–8-м суткам составил +0,61 ± 0,09 г/сут (р < 0,05). В первой группе также наблюдались положительные изменения, но на 7-е сутки азотистый баланс все еще оставался отрицательным (–1,7 ± 0,15 г/сут, р ≤ 0,05).
Следует заметить, что во второй группе (при введении СМОФКабивена центрального) имела место более ранняя коррекция нарушений углеводного обмена: уровень гликемии в сыворотке крови снизился до 6,1 ± 1,1 ммоль/л на 5-е сутки (различия с показателем 1-х суток статистически значимы: p ˂ 0,05) (см. табл. 3). Полученные данные свидетельствуют о том, что применение СМОФКабивена, содержащего 250 г глюкозы, не усиливает стрессиндуцированную гипергликемию. Отсутствие отрицательного влияния на углеводный обмен имеет большое практическое значение для проведения ПП в условиях послеоперационной гипергликемии и инсулинорезистентности у больных с обширными оперативными вмешательствами на желудке и пищеводе.
По данным литературы, первостепенную роль в расстройстве метаболизма в ответ на хирургическую травму играют цитокины. Одним из корреляторов выживаемости и летальности при критических состояниях является ИЛ-6 — ключевой медиатор острофазного ответа и фазы EBB [3, 11, 20, 30]. В 1-е сутки послеоперационного периода в сыворотке крови больных обеих групп было определено повышение уровня ИЛ-6 в ответ на обширную хирургическую травму, но уже на 3-и сутки анализ содержания ИЛ-6 как показателя провоспалительной цитокиновой системы выявил существенные различия в исследуемых группах: в 1-е сутки в первой группе — 184,6 ± 23,2 пг/мл, во второй — 54,1 ± 12,9 пг/мл (р ≤ 0,05); на 3-и сутки в первой группе — 176,5 ± 22,2 пг/мл, во второй — 55,3 ± 12,5 пг/мл (р ≤ 0,05). На 5-е сутки уровень ИЛ-6 во второй группе составил 63,7 ± 12,3 пг/мл, а в группе сравнения — 153,3 ± 50,9 пг/мл (р = 0,025 для отличия от 1-х суток).
Изменение концентрации ИЛ-6 в данном исследовании рассматривалось как косвенный признак динамики метаболического ответа: к 5-му дню наблюдения его уровень в группах исследования уменьшился почти в 3 раза (табл. 4).
Таблица 4
Общая динамика уровня интерлейкина 6 в группах исследования, пг/мл
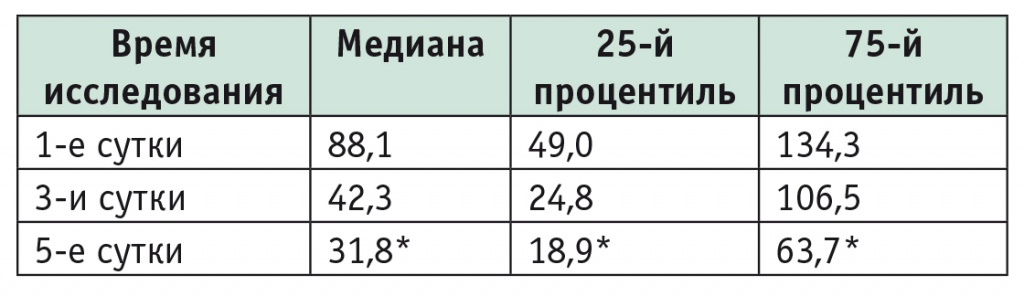
* P = 0,025 при сравнении с 1-ми сутками.
ЗАКЛЮЧЕНИЕ
В условиях идентичности программы энтерального питания высокое содержание антиоксидантов и уникальная комбинация жировой эмульсии в препарате СМОФКабивен центральный способствуют коррекции метаболических нарушений в более ранние сроки после оперативного вмешательства. Результаты оценки применения СМОФКабивена центрального для парентерального питания у пациентов с кардиальным раком пищевода свидетельствуют об адекватной коррекции постагрессивного дефицита азота, нормализации обмена белков, жиров и углеводов, а также о своевременной коррекции синдрома гиперметаболизма-гиперкатаболизма.








