Проблема диагностики и лечения рака желудка (РЖ) весьма актуальна во всем мире [8]. В связи с этим ведется активный поиск новых путей диагностики предраковых изменений и профилактики онкологической патологии [2, 12].
Фундаментальным аспектом патогенеза рака признано изменение иммунного статуса [1, 11]. Предположительно опухоль способна индуцировать иммуносупрессию, что может приводить к неэффективности противоопухолевой иммунотерапии [7]. Поскольку хронический гастрит является предраковым заболеванием, большой интерес представляет сравнительное изучение иммунного статуса у пациентов с гастритом и РЖ [3, 13].
Цель работы: изучить особенности клеточного звена иммунитета у больных атрофическим гастритом тела желудка и РЖ.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы 250 человек в возрасте от 25 до 65 лет, которые были рандомизированы на четыре группы. Первая группа включала 90 практически здоровых участников исследования (46 мужчин и 44 женщины, средний возраст — 46,8 ± 2,2 года), вторая группа — 85 пациентов с атрофическим гастритом тела желудка умеренной степени выраженности (42 мужчины и 43 женщины, средний возраст — 47,2 ± 4,4 года), в третью группу вошли 25 пациентов с выраженным атрофическим гастритом тела желудка (14 мужчин и 11 женщин, средний возраст — 45,1 ± 3,1 года), четвертую группу составили 50 больных РЖ (33 мужчины и 17 женщин, средний возраст — 50,3 ± 3,3 года).
Исследование проводили с разрешения этического комитета ФГБНУ «НИИ медицинских проблем Севера» (НИИ МПС). Согласно Хельсинкской декларации Всемирной медицинской ассоциации, регламентирующей проведение научных исследований, каждый участник подписывал форму информированного согласия на обследование.
Всем пациентам проведены лабораторная (в частности, серологическая) диагностика атрофического гастрита тела желудка и определение показателей иммунного статуса в крови. Кровь забирали утром натощак из локтевой вены в пробирки Vacutainer с разделительным гелем и двойным активатором свертывания (кремнеземом) и в такие же пробирки с раствором гепарина натрия (5 ЕД/мл).
Лабораторную диагностику атрофического гастрита осуществляли с помощью определения уровней пепсиногенов в сыворотке крови. Лабораторные анализы проводили в клинико-диагностической лаборатории ФГБНУ НИИ МПС. С помощью ИФА в сыворотке крови определяли концентрации пепсиногена I, пепсиногена II и содержание антител к Helicobacter pylori на ИФА-анализаторе «СтатФакс-3000», используя тест-систему «Гастропанель» («Биохит», Финляндия). Диагноз выраженного атрофического гастрита слизистой оболочки тела желудка устанавливали при уровне пепсиногена I ниже 25 мкг/л и отношении пепсиноген I/пепсиноген II меньше 3. При концентрации пепсиногена I 25-50 мкг/л в сочетании с отношением пепсиноген I/пепсиноген II больше 3 диагностировали атрофию слизистой оболочки тела желудка слабой и средней выраженности. Здоровыми считали пациентов с отсутствием жалоб со стороны верхних отделов ЖКТ и гастроэнтерологического анамнеза, уровнем пепсиногена I в сыворотке крови выше 50 мкг/л и соотношением пепсиноген I/пепсиноген II больше 3. За положительный результат определения H. pylori принимали титр антител к H. pylori 30 EIU и более, за отрицательный — менее 30 EIU.
Для верификации лабораторно установленного диагноза выраженного атрофического гастрита пациентам выполняли фиброэзофагогастродуоденоскопию и морфологическое исследование слизистой оболочки большой и малой кривизны тела желудка с оценкой результатов по модифицированной Сиднейской классификации [6]. Диагноз РЖ устанавливали в Красноярском краевом онкологическом диспансере на основании комплексного инструментального и морфологического обследования.
Состояние клеточного звена иммунитета оценивали методом непрямой иммунофлюоресценции с помощью моноклональных антител («Сорбент», Москва) в плазме крови [4], исследование проводили в лаборатории клинической патофизиологии ФГБНУ НИИ МПС.
Для статистической обработки данных применяли пакет прикладных программ Statistica 7.0 (StatSoft, США). Анализ соответствия вида распределения признака закону нормального распределения проводили с использованием критерия Шапиро — Уилка. При описании выборки вычисляли медиану (Me) и интерквартильный размах процентилей (С25-С75). Статистическую значимость различий между показателями независимых выборок оценивали по критерию Манна — Уитни (p < 0,05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Частота инфекции H. pylori в обследованных группах существенно не различалась и в группе контроля составила 77,8%, у пациентов с атрофическим гастритом тела желудка умеренной выраженности — 82,3% (р = 0,45 в сравнении с контрольной группой), у пациентов с выраженным атрофическим гастритом тела желудка — 88,0% (р = 0,26) и у больных РЖ — 86% (р = 0,24).
В сравнении с участниками контрольной группы у больных РЖ было статистически значимо (р < 0,001) увеличено абсолютное количество лейкоцитов (11,64 × 109/л) и лимфоцитов (5,0 × 109/л), что, с нашей точки зрения, могло являться следствием компенсаторной реакции, направленной на активизацию иммунных процессов.
По сравнению со здоровыми участниками исследованияу больных РЖ была резко снижена доля CD3+-клеток (зрелых Т-лимфоцитов) и CD4+-клеток (Тh), что служит проявлением выраженного вторичного иммунодефицита. Важно, что аналогичную закономерность наблюдали и при сопоставлении больных выраженным атрофическим гастритом тела желудка с контрольной группой (табл. 1). Это в определенной степени объясняет, почему у пациентов с гастритом возможен прогресс заболевания, приводящий к возникновению новообразований. Интересно, что абсолютное количество CD3+- и CD4+-клеток у больных РЖ не настолько катастрофически низко, как их относительное содержание (см. табл. 1). Как указано выше, лейкоцитоз и лимфоцитоз у больных РЖ позволяют в некоторой степени компенсировать резкие изменения в соотношении фракций лимфоцитов.
Таблица 1
Содержание CD3+- и CD4+-клеток в плазме крови больных атрофическим гастритом и раком желудка
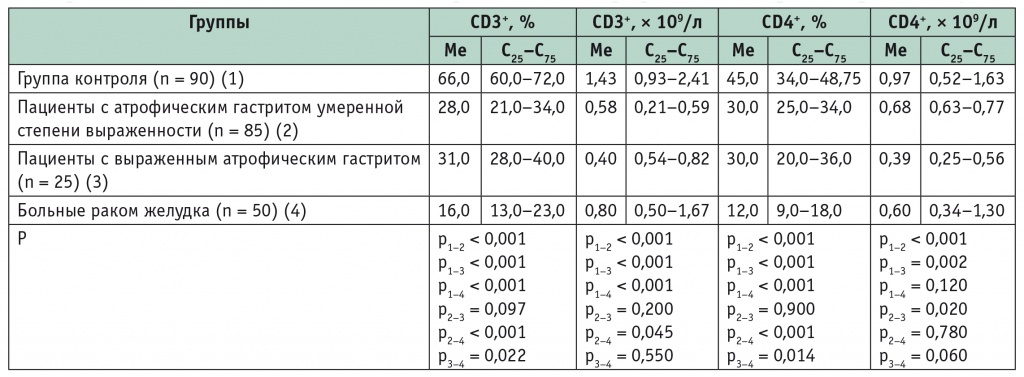
Примечание. Здесь и в таблице 2 статистическая значимость различий показателей вычислена при помощи критерия Манна — Уитни.
Аналогичные закономерности обнаружены при исследовании CD8+- (Т-киллеров) и CD16+-клеток (NK). У больных РЖ относительное содержание CD8+- и CD16+-клеток было резко снижено по сравнению со здоровыми людьми. Однако вследствие общего лейкоцитоза и лимфоцитоза абсолютное содержание CD8+- и CD16+-клеток сравнительно велико (табл. 2). Примечательно, что у больных выраженным атрофическим гастритом тела желудка абсолютное количество CD8+- и CD16+-клеток было статистически значимо ниже, чем в контрольной группе (см. табл. 2).
Таблица 2
Содержание CD8+- и CD16+-клеток в плазме крови больных атрофическим гастритом и раком желудка
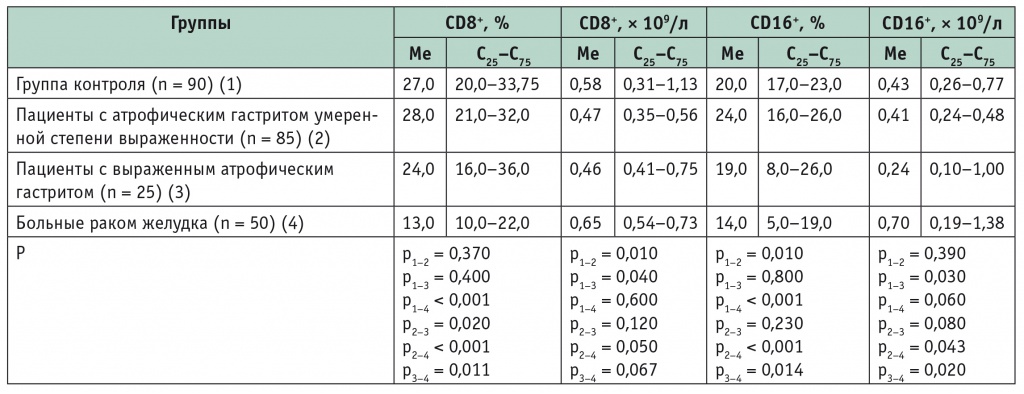
При исследовании показателей иммунного статуса важен иммунорегуляторный коэффициент, определяемый по соотношению клеток CD4+/CD8+ (Тh/Т-киллеры). В контрольной группе он составил 1,67; у пациентов с выраженным атрофическим гастритом тела желудка — 1,09 (р1-2 = 0,02), а у больных РЖ — 0,9 (р1-3 < 0,001). Привлекает внимание существенное снижение этого показателя у пациентов с атрофическим гастритом по сравнению со здоровыми участниками.
В настоящее время ведущей концепцией патогенеза рака желудка признана парадигма P. Correa: инфекция H. pylori вызывает развитие атрофического гастрита, который, в свою очередь, определяет возникновение и прогрессирование метаплазии, дисплазии и в конечном счете рака [5]. Сравнительно недавно показана возможность рекрутирования костномозговых стволовых клеток с их последующим встраиванием в дефекты эпителия желудка [10]. Учитывая повышенную мутагенность стволовых клеток, при определенных обстоятельствах у некоторых пациентов значительно повышается вероятность клонального развития кишечной метаплазии и дисплазии в эпителии желудка [9]. Совершенно очевидно, что иммунная дисрегуляция имеет важное значение в процессе онкогенеза. По нашему мнению, обнаруженные закономерности полезны для развития научных исследований и совершенствования диагностического процесса.
ЗАКЛЮЧЕНИЕ
У пациентов с выраженным атрофическим гастритом тела желудка и раком желудка зарегистрированы однонаправленные изменения иммунного статуса, проявляющиеся в развитии вторичного иммунодефицита и выраженном снижении иммунорегуляторного индекса (CD4+/CD8+).








