ВВЕДЕНИЕ
К одной из основных проблем глобального здравоохранения относятся хронические болезни печени (ХБП), в исходе которых ежегодно во всем мире умирают около 2 млн человек [1]. Фибротические изменения органов, являющиеся результатом прогрессирования хронических воспалительных заболеваний различной этиологии, приводят к 45% смертей от всех причин во всем мире [2].
Безусловно, фиброз печени (ФП) напрямую коррелирует с функцией органа, определяя качество жизни пациентов и прогноз болезни, и представляет собой основной фактор риска гепатоцеллюлярной карциномы [3, 4]. Кроме того, портальная гипертензия вследствие ФП является основной причиной клинических осложнений, включая кровотечения из варикозно-расширенных вен пищевода, желудка и прямой кишки, печеночную энцефалопатию, асцит, спонтанный бактериальный перитонит и др. [3].
Конечная стадия ФП — цирроз печени (ЦП), декомпенсация которого может приводить к летальному исходу. Согласно международным данным, ЦП в настоящее время является 11-й по частоте причиной смерти в мире [1] и 4-й в Центральной Европе [5, 6].
ФП характеризуется прогрессирующим накоплением экстрацеллюлярного матрикса (ЭЦМ), который нарушает физиологическую архитектонику органа [7]. При воздействии на печень различных триггеров (вирусов, токсинов, аутоантител, промежуточных продуктов обмена веществ) происходят повреждение гепатоцитов и инфильтрация ткани иммунными клетками, активирующими трансдифференцировку печеночных звездчатых клеток (ПЗК) в коллаген-продуцирующие миофибробласты [8, 9]. При кратковременном повреждении этот процесс уравновешивается посредством антифибротических механизмов, что приводит к инактивации или апоптозу миофибробластов и рассасыванию рубца. Напротив, при ХБП дисбаланс профиброгенных и антифиброгенных факторов вызывает стойкую активацию ПЗК, что приводит к избыточной продукции ЭЦМ [8, 9].
На молекулярном уровне сложная система цитокин-индуцированных сигнальных путей организует профиброгенные клеточные взаимодействия. Результаты современных исследований доказывают, что трансформирующий фактор роста β (TGF-β), тромбоцитарный фактор роста (PDGF), активацию каспазы 1 NLRP3-инфламмасомой, а также регуляцию канонической сигнализации WNT/β-катенин можно считать ключевыми сигнальными путями, связанными с активацией ПЗК и прогрессированием ФП [10-12].
ЭЦМ представлен различными компонентами, среди которых основными являются коллагены типов I (К-I), III и IV, а также гиалуроновая кислота (ГК) [13-15]. В последние годы определение их концентраций в сыворотке крови рассматривают в качестве потенциальной методики неинвазивной градации различных стадий ФП [16, 17], которая позволила бы отказаться от проведения биопсии печени, до настоящего времени прочно сохраняющей статус «золотого стандарта» диагностики выраженности структурных поражений органа [18]. Однако результаты соответствующих исследований весьма противоречивы и неоднозначны [19], а в педиатрии данный вопрос рассмотрен лишь в небольшом количестве публикаций [20, 21].
Целью нашего исследования стала оценка возможности прогнозирования развития ФП и ЦП у детей с помощью определения концентраций К-I и ГК в сыворотке крови.
МАТЕРИАЛЫ И МЕТОДЫ
Проспективное одноцентровое исследование было проведено на базе гастроэнтерологического отделения с гепатологической группой ФГАУ «НМИЦ здоровья детей» Минздрава России (заведующий отделением — д. м. н. А.Н. Сурков) в период с 2018 по 2020 г. и включало 80 детей в возрасте от 5 до 17 лет (36 мальчиков и 44 девочки) с ХБП аутоиммунной этиологии. Размер выборки предварительно не рассчитывался, что связано с относительно редкой встречаемостью патологии. Медиана возраста составила 14 [10; 17] лет.
Критерии включения: возраст от 5 до 17 лет; наличие ХБП, подтвержденной на основании клинико-лабораторного, инструментального и патоморфологического обследования; подписанная пациентом либо родителем несовершеннолетнего пациента форма информированного согласия на проведение инвазивного вмешательства.
Критерии невключения: отказ от подписания информированного согласия; неспособность ребенка коммуницировать с исследователем; любые неврологические и психические заболевания; наличие выраженной коагулопатии; тяжелое соматическое состояние; противопоказания для инвазивного вмешательства.
Всем пациентам под лапароскопическим контролем проводили краевую резекцию фрагмента ткани печени, после чего полученный гистологический материал обрабатывали по стандартной методике с заливкой в парафиновые блоки, а затем получали серийные ультратонкие срезы с помощью микротома. Дифференцировку морфологических структур выполняли путем окраски микропрепаратов гематоксилином и эозином, а компоненты соединительной ткани идентифицировали пикрофуксином по методу Ван Гизона. Посредством световой микроскопии один патолог слепым методом осуществлял гистологическое исследование биоптатов с градацией выраженности ФП по шкале METAVIR, а именно: стадия F0 — фиброз отсутствует; стадия F1 — незначительный портальный фиброз без септ; стадия F2 — умеренный портальный фиброз с отдельными септами; стадия F3 — значительный портальный фиброз, много септ, но без цирроза; стадия F4 — цирроз.
В день выполнения биопсии печени у всех пациентов производили взятие венозной крови натощак в количестве 3–5 мл из локтевой или подкожной вены запястья с помощью системы однократного применения BD Vacutainer Safety-Lok (Becton, Dickinson and Company, США). Биологические образцы собирали в одноразовые стерильные вакуумные пробирки BD Vacutainer SST II Advance с активатором свертывания и разделительным гелем для сыворотки (Becton, Dickinson and Company, США). Затем выполняли центрифугирование образцов в течение 20 мин при 1000 g, после чего аликвотировали в микроцентрифужные пробирки типа Эппендорф объемом 1,5 мл и замораживали при температуре –70°С. Повторные циклы замораживания/оттаивания не допускались.
Сывороточные концентрации К-I и ГК определяли методом ИФА на медицинском микропланшетном ридере Sunrise (Tecan, Австрия) с использованием специальных наборов реагентов: Collagen Type I (Cloud-Clone Corp.) и Hyaluronic Acid (Corgenix Inc.).
Статистическую обработку полученных данных проводили при помощи пакета прикладной программы IBM SPSS Statistics 21 (StatSoft Inc., США). Для анализа вида распределений применяли критерий Колмогорова — Смирнова с поправкой Лиллиефорса. Дисперсии распределений признаков оценивали с помощью F-критерия в процедуре дисперсионного анализа ANOVA. Поскольку распределение уровней исследованных показателей не было нормальным, а групповые дисперсии не были равны, различия между группами определяли с помощью непараметрического теста Краскела — Уоллиса, а при обнаружении статистически значимых различий проводили парные сравнения с применением непараметрического теста Манна — Уитни. Статистически значимыми считали различия при р < 0,05.
Результаты исследований представлены в виде абсолютных значений, долей, а также медианы параметра и интерквартильного отрезка (25-й и 75-й перцентили). Для отнесения пациентов к группам низкого и высокого риска развития значительного ФП и ЦП построение прогностических моделей осуществляли с помощью дискриминантного анализа, а прогнозирование развития значительного ФП и ЦП — с помощью бинарной логистической регрессии.
Одобрение исследования получено на совместном заседании ученого совета и локального этического комитета ФГАУ «НМИЦ здоровья детей» Минздрава России (протокол № 7 от 12.11.2018 г.).
РЕЗУЛЬТАТЫ
Среди обследованных преобладали дети с аутоиммунным гепатитом (АИГ) — 31 (38,8%); несколько меньше было больных с АИГ в сочетании с первичным склерозирующим холангитом (ПСХ) — 18 (22,5%); с ПСХ — 14 (17,5%), с АИГ в сочетании с аутоиммунной холангиопатией — 9 (11,3%); наименьшее количество больных страдали первичным билиарным холангитом (ПБХ) и аутоиммунным холангитом — по 3 (3,7%) ребенка соответственно; АИГ в сочетании с ПБХ — 2 (2,5%) ребенка.
По данным морфологического исследования гепатобиоптатов, незначительный ФП (стадия F1) выявлен у 9 (11,3%), умеренный ФП (стадия F2) — у 17 (21,3%), значительный ФП — у 27 (33,7%), ЦП — также у 27 (33,8%) пациентов.
Согласно критерию Краскела — Уоллиса, отмечались статистически значимые различия сывороточных концентраций К-I и ГК при разных стадиях ФП (р = 0,032 и р < 0,001 соответственно), что явилось основанием для продолжения статистического анализа с применением критерия Манна — Уитни для попарных сравнений. Полученные результаты приведены в таблице.
Таблица
Сывороточное содержание коллагена I типа и гиалуроновой кислоты у детей с разными стадиями фиброза печени (ФП) (n = 80)
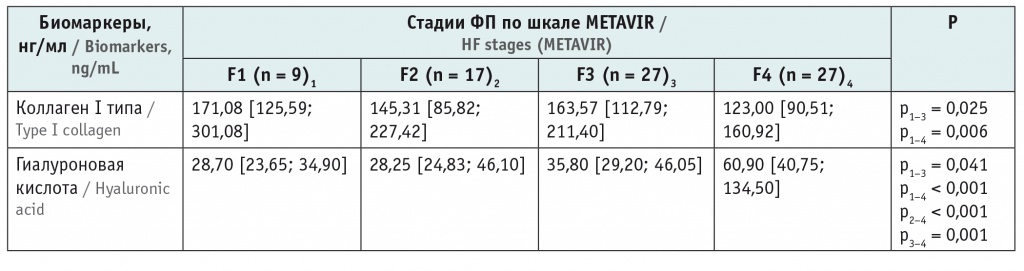
Как видно из таблицы, концентрация К-I в сыворотке крови статистически значимо ниже при значительном ФП и ЦП, чем при незначительном ФП, а сывороточное содержание ГК, напротив, выше при значительном ФП и ЦП, чем при незначительном ФП, а также выше при ЦП, чем при умеренном и значительном ФП.
Следующим этапом исследования стало выявление зависимости формирования фибротических изменений печени от содержания прямых биомаркеров в сыворотке крови.
Так, с помощью метода дискриминантного анализа нами разработаны и описаны две прогностические модели: № 1 для градации пациентов с низким и высоким риском развития ЦП (F4); № 2 — с низким и высоким риском развития значительного ФП–ЦП (F3–F4) в соответствии с концентрациями К-I и ГК в сыворотке крови.
Уравнение для модели № 1:
YЦП = 0,612 – 0,008 × XК-I + 0,009 × ХГК ,
где YЦП — дискриминантная функция, характеризующая вероятность наличия ЦП, XК-I — концентрация К-I (нг/мл), ХГК — концентрация ГК (нг/мл). Константа дискриминации равна 0,263.
Принадлежность пациентов к группе высокого или низкого риска развития ЦП определялась исходя из рассчитанных значений прогностической дискриминантной функции: при значении функции более 0,263 пациент относился к группе высокого риска ЦП, при значении функции менее 0,263 — к группе низкого риска. Чувствительность модели составила 60,9%, специфичность — 87,2%.
Уравнение для модели № 2:
YЦП = –0,685 + 0,009 × ХГК ,
где YЦП — дискриминантная функция, характеризующая вероятность наличия значительного ФП или ЦП, ХГК — концентрация ГК (нг/мл). Константа дискриминации равна –0,147.
Принадлежность пациентов к группе высокого или низкого риска развития значительного ФП или ЦП определялась исходя из рассчитанных значений прогностической дискриминантной функции: при значении функции более –0,147 пациент относился к группе высокого риска значительного ФП или ЦП, при значении функции менее –0,147 — к группе низкого риска. Чувствительность этой модели оказалась низкой — 30,8%, а специфичность, напротив, высокой — 96,0%.
Далее с помощью метода бинарной логистической регрессии нами были разработаны и описаны еще две прогностические модели: № 1 — для определения вероятности развития ЦП (F4); № 2 — для прогнозирования выраженного ФП–ЦП (F3–F4) в зависимости от концентраций К-I и ГК в сыворотке крови.
Уравнение для модели № 1:
p = 1/(1 + 2,718–z) × 100%
Z = –0,154 – 0,017 × ХК-I + 0,031 × ХГК ,
где p — вероятность наличия ЦП, XК-I — концентрация К-I (нг/мл), XГК — концентрация ГК (нг/мл).
Как показывают значения регрессионных коэффициентов, факторы К-I и ГК имеют связь с вероятностью развития ЦП. Уменьшение концентрации К-I на 1 нг/мл увеличивает шансы формирования ЦП в 0,983 раза, а повышение уровня ГК на 1 нг/мл — в 1,032 раза. Полученная регрессионная модель является статистически значимой (p < 0,001). По значению коэффициента детерминации Найджелкерка, модель учитывает 52,1% факторов, определяющих вероятность развития ЦП. Чувствительность ее составила 54,5%, специфичность — 91,1%, диагностическая эффективность — 79,1%.
Уравнение для модели № 2:
p = 1/(1 + 2,718–z) × 100%
Z = –1,091 + 0,035 × ХГК ,
где p — вероятность наличия значительного ФП–ЦП, XГК —концентрация ГК (нг/мл).
В соответствии со значениями регрессионных коэффициентов, ГК имеет прямую связь с вероятностью развития значительного ФП или ЦП. Увеличение концентрации ГК на 1 нг/мл повышает шансы их формирования в 1,036 раза. Полученная регрессионная модель является статистически значимой (p < 0,001). По значению коэффициента детерминации Найджелкерка, модель учитывает 24,4% факторов, определяющих вероятность развития значительного ФП или ЦП. Чувствительность ее составила 83,3%, специфичность — 60%, диагностическая эффективность — 74,6%.
ОБСУЖДЕНИЕ
Выявлены статистически значимые различия в сывороточном содержании К-I и ГК при разных стадиях ФП у детей и разработаны четыре прогностические модели, три из которых обладали удовлетворительной чувствительностью и специфичностью для прогнозирования значительного ФП и ЦП в зависимости от концентраций указанных биомаркеров.
Ранее в различных исследованиях сообщалось о многих неинвазивных показателях, применяемых для прогнозирования ФП: количество тромбоцитов, соотношение АСТ/АЛТ (aspartate aminotransferase/alanine aminotransferase ratio — AAR), индекс отношения AСT/количество тромбоцитов (AST/platelet ratio index — APRI), индекс отношения AAR/количество тромбоцитов (AARPRI), тест FIB-4 (fibrosis index based on the 4 factors), основанный на подсчете возраста, активности АСТ, АЛТ и количества тромбоцитов [22].
Так, например, для ФП, вызванного гепатитом B (стадии F2–F4 по сравнению с F0–F1), APRI и FIB-4 показали умеренную чувствительность и точность с площадью под ROC-кривыми 0,81 и 0,81 соответственно [23, 24]. APRI и FIB-4 не подходят для оценки регресса ФП после противовирусной терапии [25]. FIB-4 и индекс Лока оказались полезными для оценки ЦП, связанного с гепатитом С (стадия F4 по сравнению с F0–F3): площадь под ROC-кривыми составила 0,833 и 0,847 соответственно [26]. Индекс APRI показал умеренную диагностическую точность для оценки ЦП (площадь под ROC-кривой — 0,832) [27]
ЗАКЛЮЧЕНИЕ
Можно заключить, что прямые биомаркеры фиброзирования имеют определенную диагностическую значимость в градации стадий фиброза печени, однако с учетом специфичности аутоиммунного поражения печени необходимы дальнейшие исследования с участием больших групп пациентов с хроническими болезнями печени различной этиологии. Использование неинвазивных биомаркеров и их сочетаний может помочь в принятии клинических решений, уменьшить количество госпитализаций и устранить необходимость значительного количества процедур инвазивной биопсии.
Поступила: 26.02.2021
Принята к публикации: 19.03.2021








