ВВЕДЕНИЕ
Муковисцидоз (МВ) — одно из наиболее часто встречающихся и изученных моногенных наследственных заболеваний, обусловленное мутациями в гене CFTR (трансмембранного регулятора проводимости МВ) [1]. Дегидратация секрета в легких, вызванная генетическим дефектом, приводит к обструкции дыхательных путей, присоединению бактериальной инфекции и развитию хронического воспалительного процесса. Прогрессирующее поражение бронхолегочной системы при МВ остается основной причиной смерти [2]. Ранняя диагностика и терапия, направленная на предотвращение колонизации и хронического инфицирования респираторного тракта патогенными микроорганизмами, является одним из условий благоприятного прогноза заболевания [3, 5].
Неферментирующие грамотрицательные бактерии (НГОБ), обладающие природной устойчивостью ко многим антибактериальным препаратам, выраженной резистентностью к дезинфицирующим средствам и широко распространенные в различных медицинских организациях, включая больничные стационары, занимают важное место среди возбудителей хронической легочной инфекции у больных МВ [6]. К НГОБ, вызывающим инфекции у человека, принадлежат несколько видов возбудителей, включая Pseudomonas aeruginosa, Burkholderia cepacia complex, Stenotrophomonas maltophilia, Acinetobacter spp., Chryseobacterium spp.
При инфекциях нижних дыхательных путей у больных МВ наибольшее значение имеют P. aeruginosa и B. cepacia сomplex, определяющие во многих случаях неблагоприятный прогноз заболевания.
К факторам, затрудняющим уничтожение микроорганизмов в респираторном тракте больных МВ на фоне антибактериальной терапии (АБТ), относятся наличие у бактерий мукоидных фенотипов, их антибиотикорезистентность, возможность формировать биофильм, затрудняющий проникновение антибактериальных препаратов. Хронизация процесса чаще всего характеризуется трансформацией плоских колоний P. aeruginosa в мукоидные, нарушающие нормальные фагоцитарные функции, а также содействующие образованию биопленок [7, 9].
Согласно данным национальных регистров и Европейского регистра за 2017 год, распространенность P. aeruginosa среди детей, больных МВ, вариабельна: от 6,75% (n = 286) вo Франции до 21,6 % (n = 46) в Израиле и 25,76% (n = 612) в России. По сведениям Регистра США за 2018 год, общая частота взрослых и детей с МВ, инфицированных синегнойной палочкой, — 40% (n = 12 310 пациентов из 30 775 больных в США) [10, 11].
Разделение колонизации P. aeruginosa при МВ на интермиттирующую (высев P. аeruginosa хотя бы 1 раз при нормальном уровне преципитирующих антител) и хроническую инфекцию (повторяющийся высев P. aeruginosa в течение 6 и более месяцев подряд или менее полугода, но при наличии преципитирующих антител против P. aeruginosa) лежит в основе определения тактики АБТ при cинегнойной инфекции.
При первичной колонизации P. aeruginosa возможность санации мокроты больных МВ значительно выше. Выделяемые при этом штаммы обычно имеют немукоидный фенотип, а количество мокроты невелико. В исследовании по применению ингаляций колистина в комбинации с приемом ципрофлоксацина при первых высевах P. aeruginosa выявлены значительно более частая санация мокроты и снижение частоты развития хронической синегнойной инфекции, чем у больных МВ, не получавших лечение [12].
В рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании показано, что ингаляции тобрамицина при первом высеве P. aeruginosa эффективны для предупреждения хронической синегнойной инфекции [12].
В последующих многолетних исследованиях продемонстрировано, что активная АБТ позволяет предупредить или отсрочить формирование хронической инфекции, вызванной P. aeruginosa, более чем у 80% больных МВ [3, 13-15].
Если эрадикация P. aeruginosa после курса АБТ не произошла и у больного развилась хроническая синегнойная инфекция, назначение ингаляционной противосинегнойной терапии позволяет уменьшить риск обострений бронхолегочного процесса, степень выраженности респираторных проявлений и улучшить показатели ФВД.
Ранее считалось, что санация бронхиального секрета от мукоидных форм P. aeruginosa при хронической синегнойной инфекции практически невозможна. Это обусловлено рядом факторов, прежде всего невозможностью достижения бактерицидных концентраций в условиях биофильма, содержащего вязкий алгинат. На фоне АБТ при хронической инфекции P. aeruginosa возможно лишь уменьшение степени обсемененности возбудителем бронхиального секрета. Однако в некоторых публикациях это положение опровергается [16, 17].
При хронической синегнойной инфекции вне обострения бронхолегочного процесса рекомендуется ингаляционная АБТ c использованием ингаляционных аминогликозидов и/или полимиксинов (уровень доказательности А) [18-21].
При ингаляционном пути доставки антибактериальный препарат попадает непосредственно в просвет бронхов. При этом в бронхиальном секрете создаются высокие концентрации лекарственного средства непосредственно в очаге инфекции (от 100 до 200 мкг/мл) при низком его уровне в сыворотке крови, что дает дополнительные возможности для преодоления антибиотикорезистентности, часто наблюдаемой при МВ. При аэрозольном введении концентрации действующих веществ многократно превышают те, которых можно достичь при парентеральном способе введения. В связи с этим традиционные значения чувствительности P. аeruginosa к тобрамицину, которые установлены для парентерального и/или перорального введения, не подходят для оценки чувствительности P. aeruginosa при ингаляционном применении препарата [22, 23].
При получении высоких концентраций тобрамицина (Тмах/минимальная подавляющая концентрация (MПК) = 8–12) в бронхиальном секрете возможно воздействие на формально устойчивые к АБТ штаммы P. aeruginosa. В 2005 году Испанским советом по стандартизации чувствительности и резистентности к антибиотикам (Mesa Espanola de Normalizacion de la Sensibilidad y Resistencia a los Antimicrobianos) были рекомендованы более высокие точки отсечения для ингаляционных форм тобрамицина при определении чувствительности P. aeruginosa: для чувствительных штаммов МПК < 64 мг/л; для устойчивых штаммов МПК > 128 мг/л. В то же время для парентерального введения приняты следующие значения МПК: для чувствительных штаммов ≤ 4 мг/л; для устойчивых штаммов > 4 мг/л [24].
Применение критериев, установленных для определения чувствительности к ингаляционной форме, поможет более точно интерпретировать показатели чувствительности P. aeruginosa при ингаляционном пути введения тобрамицина [24].
Цель исследования: определить in vitro активность тобрамицина в отношении штаммов P. aeruginosa, выделенных у детей с МВ, ретроспективно изучить динамику эффективности ингаляционного тобрамицина при лечении обострения бронхолегочного процесса у детей с МВ за 9 лет (2009–2018).
МАТЕРИАЛЫ И МЕТОДЫ
Проанализированы результаты бактериологического исследования бронхиального секрета и применения схемы АБТ детей с диагнозом МВ, наблюдавшихся в педиатрическом отделении Российской детской клинической больницы ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации с 2009 по 2018 г. В исследование включены 173 ребенка в возрасте от 3 до 17 лет, медиана возраста в общей группе составила 11 [8, 15] лет (Me [Q1; Q3]). Медиана ИМТ в исследуемой когорте — 16 [14, 17] кг/м2. Тяжесть течения МВ оценивалась по параметру ОФВ1 в процентах от должного (табл. 1).
Таблица 1
Характеристика обследованных детей
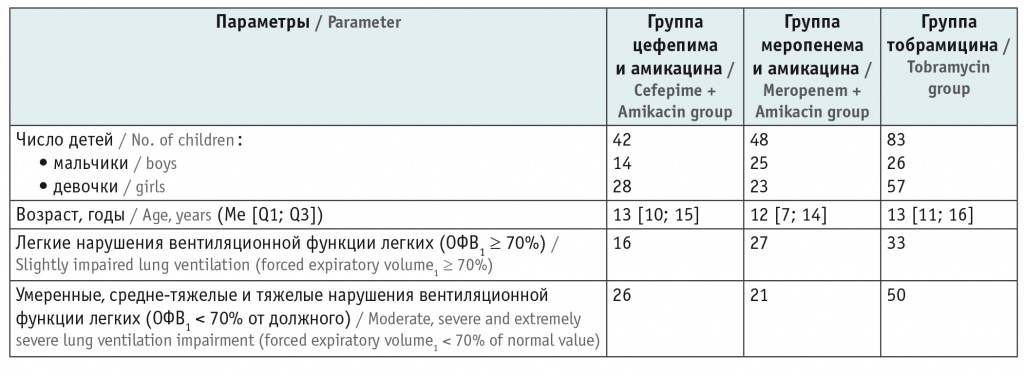
У всех детей, включенных в исследование, отмечался хронический высев P. aeruginosa из респираторного тракта (плоские и мукоидные штаммы как в монокультуре, так и в ассоциации с другими патогенами дыхательных путей) (табл. 2). Все дети госпитализировались с симптомами обострения бронхолегочного процесса.
Таблица 2
Структура микробиологического пейзажа респираторного тракта обследованных детей
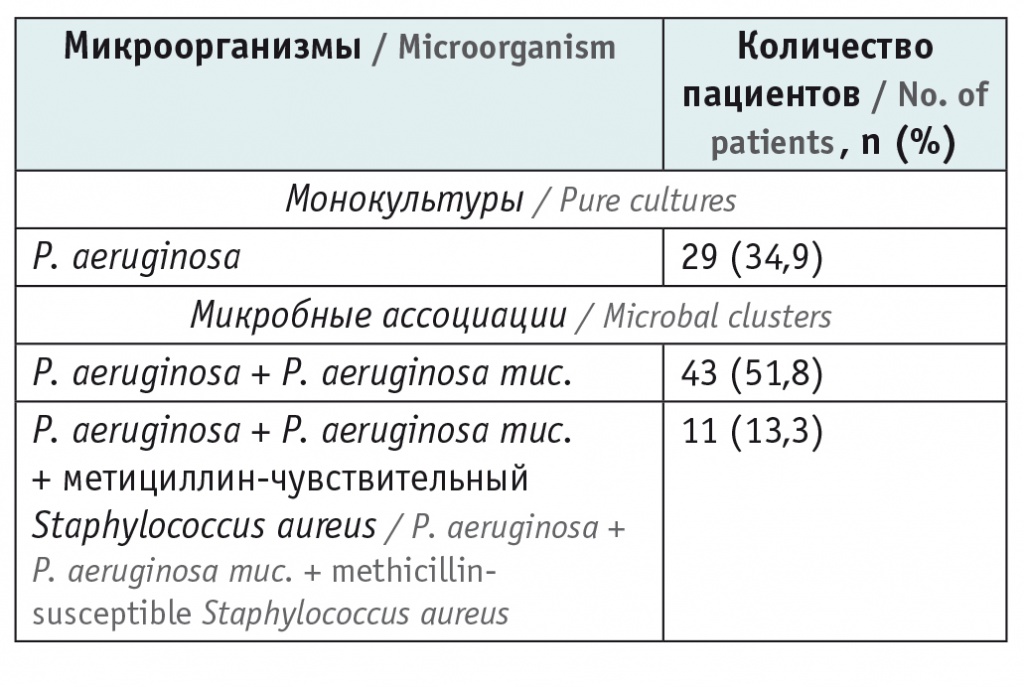
Участников разделили на группы сравнения, исходя из различных схем 14-дневной комбинированной антипсевдомонадной терапии: 42 ребенка получали цефепим 150 мг/кг + амикацин 20 мг/кг в/в капельно; 48 участников — меропенем 100 мг/кг + амикацин 20 мг/кг в/в капельно; 83 пациента — цефтазидим 200 мг/кг в/в капельно + тобрамицин (Брамитоб) 300 мг 2 раза в сутки ингаляции + ципрофлоксацин per os 30–40 мг/кг.
Идентификацию микроорганизмов проводили культуральным методом с применением рутинных методик. МПК тобрамицина определяли с использованием градиентного метода (high range) E-test (BioMerieux, Франция), а также методом последовательных разведений как в варианте пограничных концентраций, так и в варианте серийных разведений на микробиологическом анализаторе BD Phoenix (США).
Мы провели исследование, в котором сымитировали данные, полученные при клинических испытаниях ингаляционных тобрамицинов [24], когда была достигнута концентрация препарата в мокроте от 800 мкг/г мокроты при использовании тобрамицина в дозе 300 мг/5 мл до 1289 мкг/г мокроты при дозе 300 мг/4 мл.
В питательную среду для культивирования P. aeruginosa был добавлен тобрамицин в концентрациях 16–32 мкг/г, 800 мкг/г и более 1200 мкг/г. На данные среды проводился посев штаммов P. aeruginosa, которые при рутинном бактериологическом исследовании демонстрировали устойчивость in vitro с МПК > 16 мкг/мл. Оценка результата проводилась по способности указанных штаммов осуществлять рост на питательной среде с возрастающей концентрацией тобрамицина [25].
Чувствительность к антибактериальным препаратам оценивали в соответствии с методическими указаниями МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» (2004), с 2015 г. — согласно клиническим рекомендациям «Определение чувствительности микроорганизмов к антимикробным препаратам» (2018).
При анализе количественных признаков выполнялась проверка характера их распределения с помощью критерия Колмогорова — Смирнова. При отличии распределения количественного признака от нормального он характеризовался при помощи медианы, первого и третьего квартилей (Me [Q1; Q3]). Так как производилось сравнение связанных совокупностей (анализ «до — после») количественных переменных, измеренных по порядковой шкале, а распределение признаков было отлично от нормального, то применялся двухфакторный долевой дисперсионный анализ при апроксимации на нормальность. При попарном сравнении полученных результатов для трех выборок в случае p < 0,05 использовался критерий Тьюки.
Статистическая обработка результатов выполнена с помощью пакета прикладных программ SPSS v.22. Пороговый уровень значимости при проверке статистических гипотез принимался равным 0,05.
РЕЗУЛЬТАТЫ
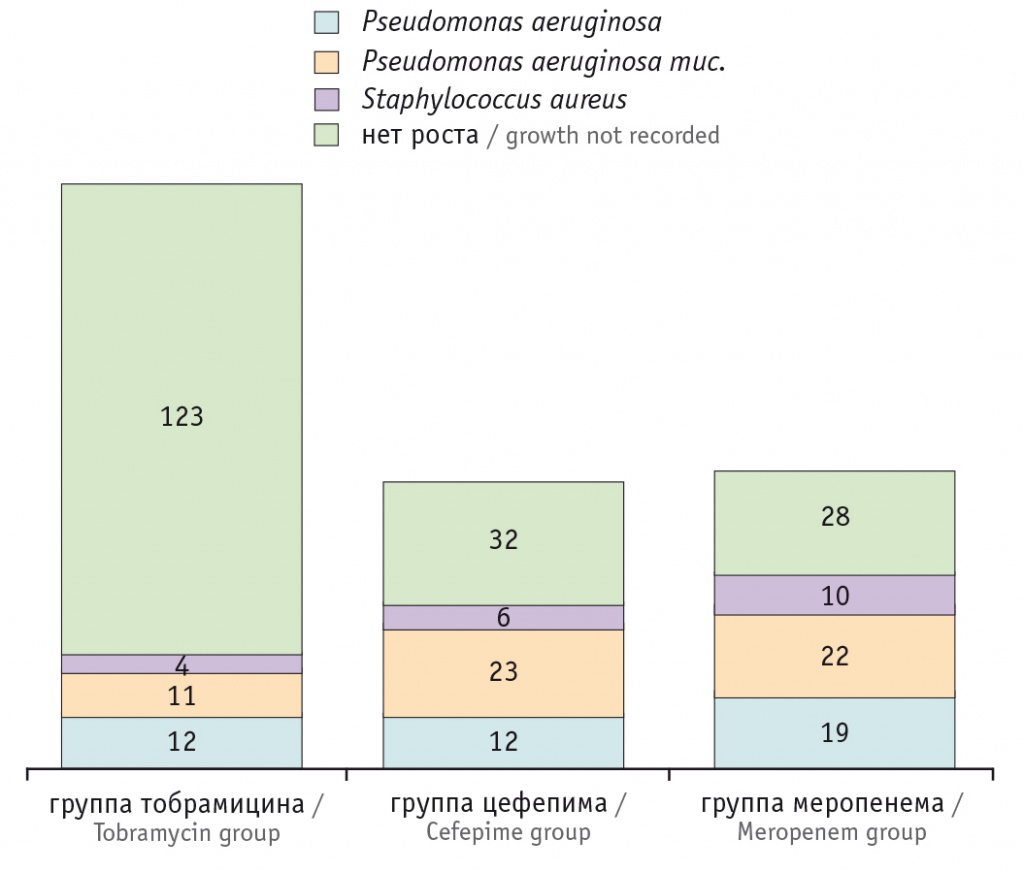
Полученные нами результаты демонстрируют бо́льшую эффективность комбинации ингаляционного тобрамицина 300 мг (в ампуле, 75 мг/мл) с пероральным фторхинолоном, чем у внутривенных аминогликозидов в комбинации с цефалоспоринами, карбапенемами. На рисунках 1 и 2 показано, что после двухнедельного курса терапии 83 детей путем ингаляций тобрамицина в сочетании с пероральным приемом ципрофлоксацина и в/в введением цефтазидима из 150 штаммов патогенной флоры 123 (82%) штамма P. aeruginosa и Staphylococcus aureus были элиминированы (p < 0,001 при сравнении с результатами бактериологического исследования бронхиального секрета перед началом терапии). В группах сравнения эффект был статистически значимо слабее: в группе цефепима и амикацина из 73 патогенных штаммов в контрольных образцах мокроты P. aeruginosa и S. aureus удалось добиться элиминации 32 (43,8%), а в группе меропенема и амикацина из 79 штаммов микробных патогенов только 28 (35,4%) удалось элиминировать.
Рис. 1. Микробный пейзаж респираторного тракта у обследованных детей до лечения (число штаммов)
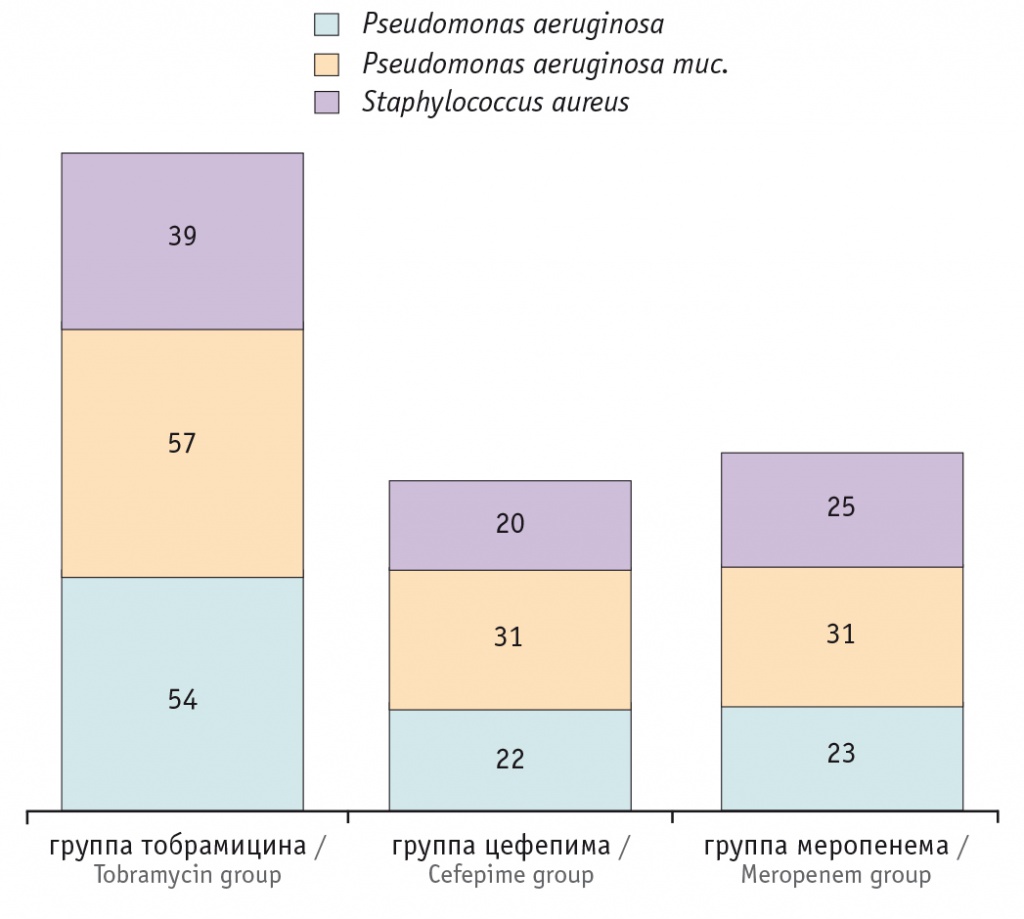
Рис. 2. Микробный пейзаж респираторного тракта у обследованных детей после лечения (число штаммов)
В 2013 г., через 4 года после начала наблюдения, из 83 детей с МВ, вошедших в группу ингаляционного тобрамицина, 33 ребенка были переведены во взрослую сеть по причине достижения совершеннолетия. У 50 оставшихся под наблюдением в педиатрическом отделении Российской детской клинической больницы детей при поступлении в 2013 г. проведена противомикробная терапия по той же антисинегнойной схеме, что и в 2009 г.: цефтазидим 200 мг/кг/сутки в/в капельно, ципрофлоксацин 30-40 мг/кг/per os и тобрамицин в ингаляциях 300 мг 2 раза в сутки 14 дней. Интересно, что эффект элиминации P. aeruginosa и S. aureus был идентичным: из 61 штамма у 50 детей только 11 (18%) колоний патогенов сохраняли жизнеспособность, а 50 (82%) штаммов оказались элиминированными в образцах контрольной мокроты. Разница между количеством колоний синегнойной палочки и золотистого стафилококка до и после лечения была статистически значимой (p < 0,001).
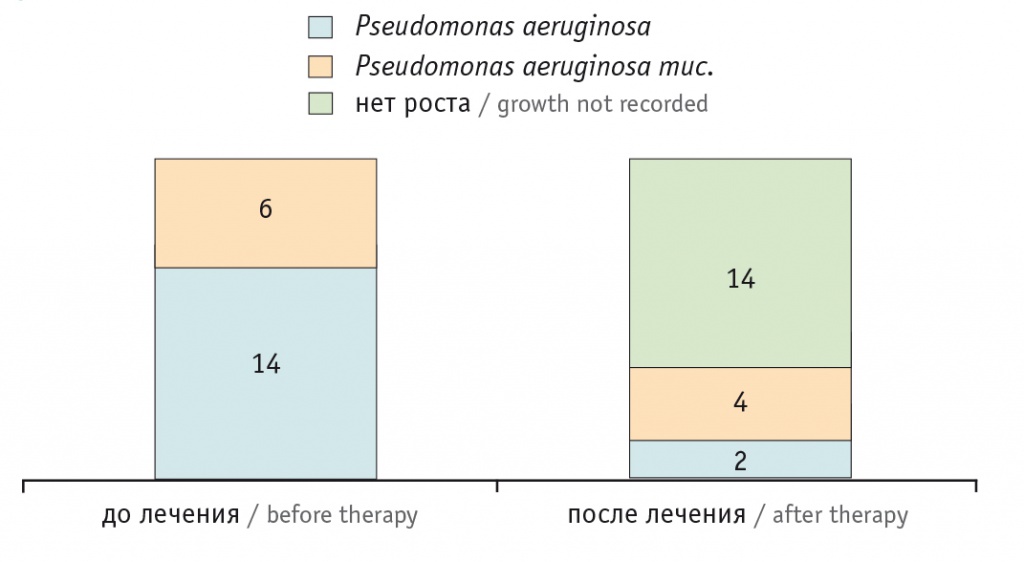
Практически такой же эффект антипсевдомонадной терапии с ингаляционным тобрамицином отмечался и в 2018 г.: из 83 детей в педиатрической сети остались 20 пациентов, которым вновь была назначена вышеописанная схема лечения на 2 недели. У 14 (70%) из 20 детей со штаммами P. aeruginosa наблюдалась санация мокроты в контроле (p < 0,001).
Данные по эффективности схем АБТ с включением тобрамицина в ингаляциях представлены на рисунках 3 и 4.
Рис. 3. Микробиологический пейзаж образцов мокроты 50 детей до и после комплексной антибактериальной терапии с включением тобрамицина в ингаляциях, 2013 год (число штаммов)
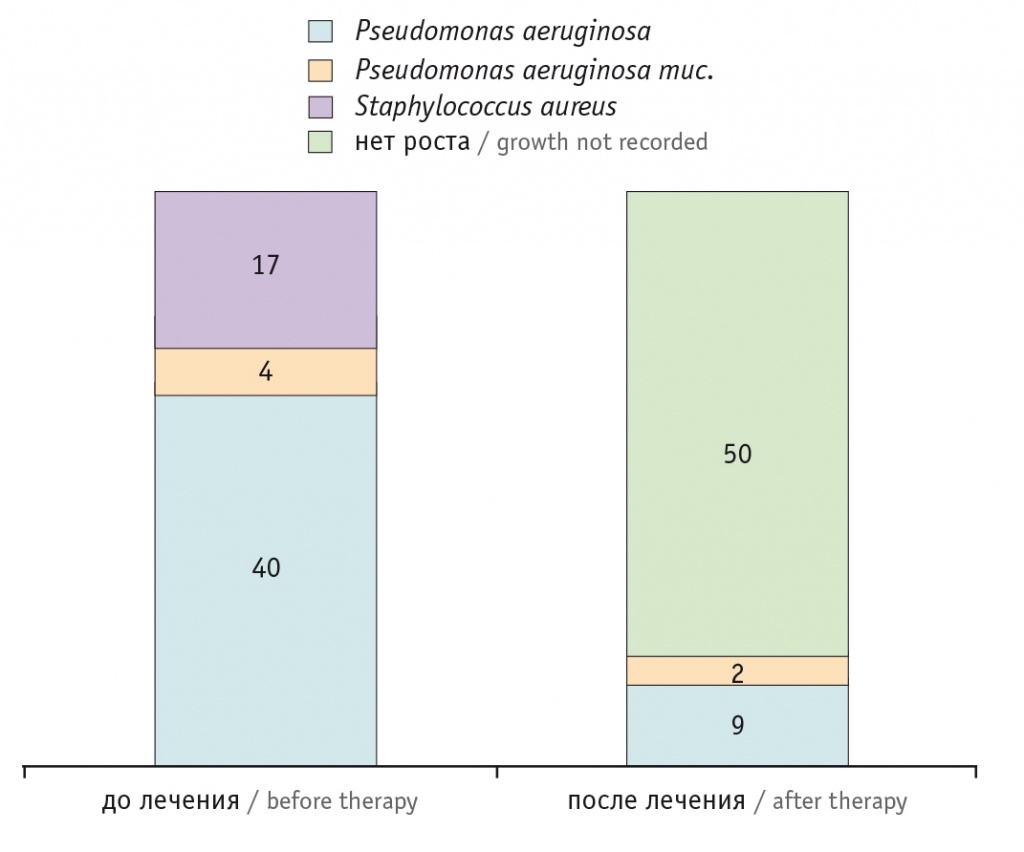
Рис. 4. Микробиологический пейзаж образцов мокроты до и после комплексной антибактериальной терапии с включением тобрамицина в ингаляциях, 2018 год (число штаммов)
При проведении клинических исследований ингаляционных тобрамицинов отмечено, что концентрация антибиотика в бронхиальном секрете достигает от 800 до 1200 мкг/мл, что гораздо выше МПК, определяемой в сыворотке крови больных МВ. Мы провели отдельное исследование, в которое включили 62 больных МВ с резистентностью in vitro (МПК ≥ 16 мг/л) синегнойной палочки к тобрамицину. Больные были разделены на три группы по возрастанию концентрации тобрамицина в питательной среде (32 мкг/г; 800 мкг/г и 1200 мкг/г).
При точке отсечения 32 мкг/г 30 плоских и 15 мукоидных штаммов синегнойной палочки не демонстрировали рост на питательной среде с тобрамицином. При концентрации тобрамицина 800 мкг/г 7 плоских и 4 мукоидных штамма также не дали роста. При МПК > 1200 мкг/г только 4 плоских и 2 мукоидных штамма P. aeruginosa дали рост на среде с тобрамицином, что позволило отнести их к истинно резистентным к ингаляционному тобрамицину. Штаммы, сохраняющие чувствительность при МПК 32 мг/л и до 800 мг/л, клинически «отвечают» на терапию ингаляционными аминогликозидами, в частности тобрамицином, не высеваются после завершения курса комбинированной АБТ с включением тобрамицина.
Полученный нами результат свидетельствует о том, что резистентность P. aeruginosa к тобрамицину in vitro не может являться основанием для отказа от его использования при борьбе с хронической синегнойной инфекцией или для прекращения такой терапии при наличии выраженного клинического эффекта от лечения.
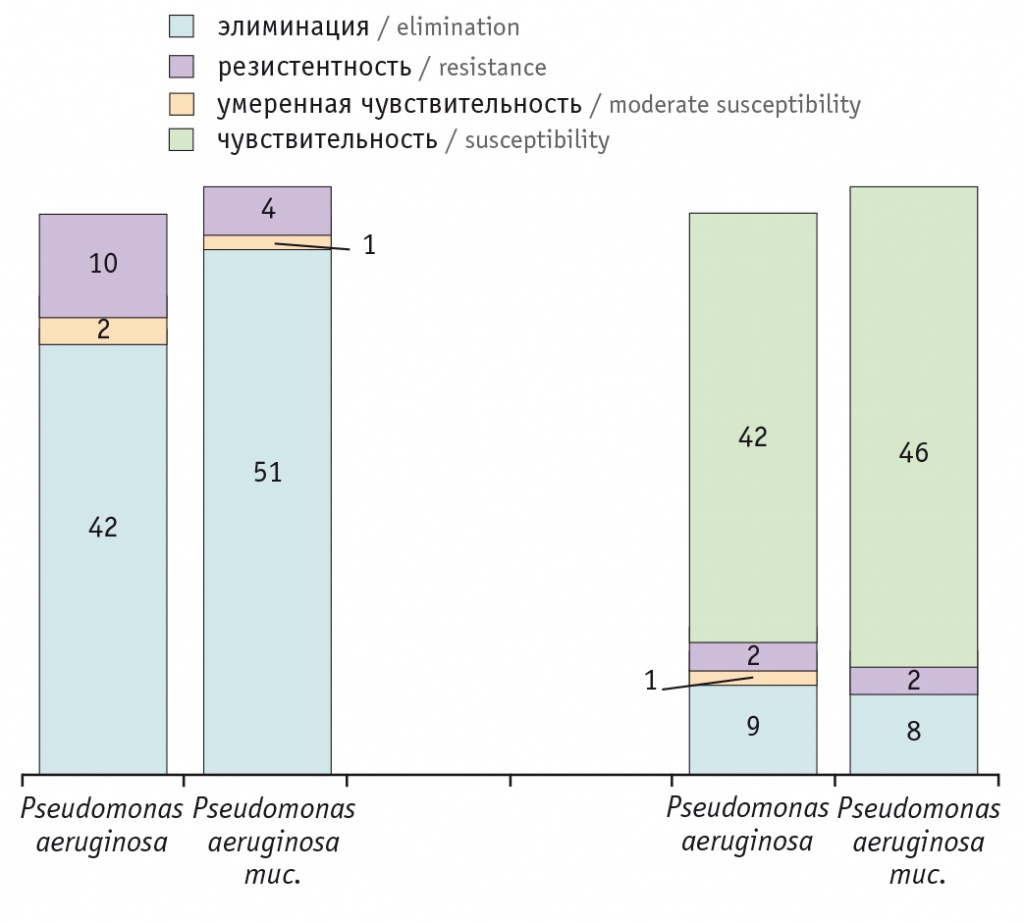
На рисунке 5 приведены данные по чувствительности 110 штаммов P. aeruginosa к ингаляционному тобрамицину и минимальному проценту резистентности патогена. После 2-недельного курса антипсевдомонадной терапии с включением тобрамицина в ингаляциях 2 из 10 резистентных плоских штаммов и 2 из 4 мукоидных сохранили резистентность in vitro и in vivo, при этом 42 плоских и 46 мукоидных штаммов оказались чувствительными и не высевались при контрольном исследовании бронхиального секрета по окончании курса антимикробной терапии.
Рис. 5. Чувствительность Pseudomonas aeruginosa (n = 110) к ингаляционному тобрамицину в 2009 году до и после лечения (курс терапии — 14 дней)
ОБСУЖДЕНИЕ
В статье представлен опыт 9-летнего успешного применения ингаляционного аминогликозида тобрамицина в схемах комбинированной противомикробной терапии (в сочетании с внутривенными и пероральными формами лекарственных средств, направленных на борьбу с инфекцией респираторного тракта, ассоциированной с P. aeruginosa). Продемонстрировано отсутствие роста синегнойной палочки в подавляющем числе случаев в контрольных образцах мокроты после 14-дневной терапии, проведенной у детей с хронической P. aeruginosa-инфекцией дыхательных путей в 2009, 2013 и 2018 г.
Критерии «чувствительный», «умеренно чувствительный», «резистентный», основанные на сывороточной концентрации антимикробных препаратов, при борьбе с хронической синегнойной инфекцией теряют свою значимость, так как концентрация антибактериального препарата в бронхиальном секрете при ингаляционном пути введения многократно превышает ту, которой можно достичь при парентеральном введении. Это значит, что показанием для применения ингаляционного тобрамицина является не только наличие in vitro-чувствительных штаммов P. aeruginosa. Следует признать ошибочной практику отмены ингаляционного антибиотика или отказ от его назначения при получении результата МПК > 16 мг/л. Эффективность антимикробной терапии следует оценивать клинически — по динамике обратного развития симптомов обострения бронхолегочного процесса — и бактериологически — по окончании курса лечения.
Оценку чувствительности микроорганизмов, выделенных у пациентов с МВ, к антибактериальным препаратам и интерпретацию результатов нужно проводить в соответствии с актуальной версией рекомендаций по определению чувствительности микроорганизмов к антимикробным препаратам [27]. У устойчивых к тобрамицину штаммов P. aeruginosa рекомендуется вычислять значение МПК. Полученные показатели МПК необходимо интерпретировать, применяя более высокие точки отсечения для ингаляционного тобрамицина при определении клинической чувствительности/устойчивости P. aeruginosa. Штаммы с МПК ≤ 64 мг/л следует относить к чувствительным для ингаляционного применения, с МПК ≥ 128 мг/л — к устойчивым.
ЗАКЛЮЧЕНИЕ
Ингаляционный тобрамицин, несмотря на более чем 20-летний мировой опыт применения у пациентов с муковисцидозом, сохраняет клиническую эффективность и активность в отношении изолятов Pseudomonas aeruginosa в схемах первичной эрадикации и лечения хронической синегнойной инфекции легких.
Поступила: 15.02.2021
Принята к публикации: 19.03.2021








