Под воздействием неблагоприятных факторов возможно изменение состава и функциональной активности кишечной микробиоты, которые проявляются уменьшением видового разнообразия, увеличением доли условно-патогенных микроорганизмов, нарушением функциональных свойств микробиоты [1].
На сегодняшний день считается, что кишечный дисбиоз может развиваться на фоне таких заболеваний ЖКТ, как хронический панкреатит, постхолецистэктомический синдром, дисахаридазная недостаточность, целиакия, болезнь оперированного желудка, дивертикулярная болезнь, хронические гепатиты, циррозы печени и др. [1]. Таким образом, нарушение микробиоценоза кишечника является следствием органической или функциональной патологии ЖКТ [2].
При ряде заболеваний роль нарушений состава и функциональной активности кишечной микробиоты не вызывает сомнений, например при антибиотикоассоциированной диарее, некротизирующем энтероколите, Clostridium difficile-ассоциированной болезни. На сегодняшний день считается, что в патогенезе ожирения, СД 2 типа, неалкогольной жировой болезни печени (НАЖБП), рака толстой кишки и многих других болезней нарушения микробиома играют далеко не последнюю роль. При таких заболеваниях, как синдром раздраженной кишки, функциональная диспепсия, воспалительные заболевания кишечника (ВЗК), причинно-следственная связь остается не вполне понятной.
Цель данного обзора — рассмотреть изменения микробиома кишечника при различных патологиях.
ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ
Среди всех заболеваний наиболее отчетливо связана с нарушением состава микробиома кишечника C. difficile-ассоциированная болезнь.
C. difficile — грамположительный спорообразующий анаэроб, входящий в состав микробиоты человека, способный при определенных условиях продуцировать токсины. Важно, что запуск активного размножения C. difficile, продукция токсинов и развитие симптомов провоцируются нарушением колонизационной резистентности слизистой оболочки толстой кишки, вызванной приемом антибиотиков широкого спектра действия.
На сегодняшний день известно, что у 5–35% пациентов, получающих антибиотики, развивается диарея, причиной которой в 10–25% случаев является инфекция C. difficile [3].
Каким образом нормальная микробиота осуществляет сдерживание размножения C. difficile и продукцию токсинов, пока остается загадкой. Один из предполагаемых механизмов — биоконверсия представителями нормальной микробиоты первичных желчных кислот во вторичные. Первичные желчные кислоты служат своеобразным инкубатором для спор C. difficile, тогда как вторичные ингибируют вегетативный рост C. difficile [4]. Введение антибиотиков нарушает равновесие микробных сообществ кишечника, уменьшает их разнообразие, снижая активность образования вторичных желчных кислот.
Существует и другая точка зрения, согласно которой бактерии вида C. difficile способны продуцировать токсины только после достижения определенной биомассы, что практически невозможно в условиях широкого микробного разнообразия у здорового человека. Применение антибиотиков, угнетающих рост и размножение большинства микроорганизмов, приводит к резкому увеличению числа бактерий C. difficile, активизации синтеза токсинов и развитию заболевания.
Понимание патогенеза C. difficile-ассоциированной болезни привело к разработке принципиально нового метода лечения, направленного на повышение микробного разнообразия в кишке, — трансплантации фекальной микробиоты (ТФМ). Данный метод включает введение в кишечник через клизму, колоноскоп, назогастральный зонд суспензии микробиоты от здорового донора. Таким образом, ТФМ позволяет переносить в кишечник пациента целое микробное сообщество.
Исследования, посвященные ТФМ, демонстрируют более высокую эффективность данного метода в лечении C. difficile-ассоциированной болезни и ее рецидивов по сравнению с таковой у терапии ванкомицином [5]. Кроме клинического улучшения и прекращения продукции токсинов, в кишечнике пациентов после ТФМ наблюдалось повышение доли бактерий Bacteroidetes, Clostridium cluster (Firmicutes), а также снижение количества Proteobacteria.
ЗАБОЛЕВАНИЯ ПЕЧЕНИ
Считается, что в патогенезе аутоиммунных заболеваний печени важную роль играет нарушение состава микробиоты кишечника (рис.). Воспаление в стенке кишечника, возникающее при дисбиозе, ведет к повышению кишечной проницаемости, проникновению бактериальных антигенов и продуктов метаболизма бактерий через систему воротной вены в билиарный тракт и ткани печени, где они распознаются антиген-презентирующими клетками (клетками Купфера, макрофагами), запускают каскад синтеза провоспалительных цитокинов, вызывая активное иммунное воспаление [6, 7].
Рис. Патогенез заболеваний печени при дисбиозе толстой кишки
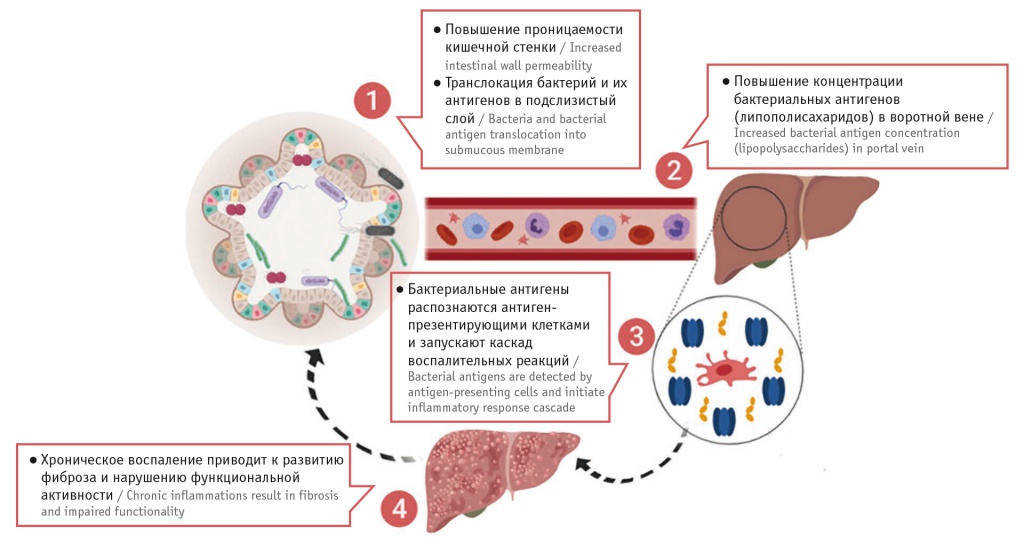
Кроме активации иммунных процессов с вовлечением клеток Купфера, описано прямое повреждающее действие метаболитов кишечной микробиоты. В процессе жизнедеятельности кишечной микробиоты продуцируются этанол, аммиак, ацетальдегид и другие токсичные вещества, которые, попадая в печень через систему воротной вены, оказывают неблагоприятное влияние на жизнедеятельность печеночных клеток и клеток желчных протоков [8, 9].
Известно, что изменения в составе микробиоты — это важное звено патогенеза НАЖБП, алкогольной болезни печени, первичного склерозирующего холангита, осложнений цирроза печени. Являются ли изменения микробиома кишечника первичным звеном в патогенезе заболеваний печени или они развиваются как следствие нарушений функций печени (например, снижения продукции желчных кислот), по сей день остается неясным [7].
С помощью секвенирования 16S рибосомальной РНК показано, что у пациентов, страдающих циррозом печени, значительно нарушен микробный состав толстой кишки: снижено микробное разнообразие, увеличена доля бактерий, относящихся к Proteobacteria и Fusobacteria, а также наблюдается избыточный бактериальный рост в тонкой кишке [10-12].
Следует отметить, что в микробиоме пациентов с НАЖБП обнаружено повышение количества этанол-продуцирующих бактерий (Bacteroidetes, Proteobacteria, Enterobacteriaceae, Escherichia) по сравнению с таковым в микробиоме здоровых волонтеров. Рост концентрации этанола в кишечнике приводит к угнетению синтеза белков плотных контактов, повышению проницаемости кишечной стенки, что, в свою очередь, запускает каскад событий, способствующих активации воспаления и развитию фиброза печени [13]. Кроме того, известно, что у больных НАЖБП чаще, чем в общей популяции, встречается синдром избыточного бактериального роста (СИБР) [14].
Некоторые исследования показывают, что метаболический синдром может индуцировать изменение состава микробиоты. При пересадке здоровым мышам микробиоты от мышей с метаболическим синдромом у мышей-реципиентов наблюдалось повышение уровней глюкозы и инсулина в крови, а также развитие жирового гепатоза [15].
Известно, что заболевания печени нередко ассоциированы со снижением общего видового разнообразия микробиты толстой кишки, увеличением доли бактерий Enterobacteriaceae и уменьшением доли Bifidobacterium, а также возникновением СИБР в тонкой кишке. Считается, что развитие СИБР у данных пациентов может быть связано со снижением продукции желчных кислот и нарушением моторики кишечника [16, 17].
ОЖИРЕНИЕ И САХАРНЫЙ ДИАБЕТ 2 ТИПА
Клинические и экспериментальные исследования на животных показали, что изменение разнообразия кишечной микробиоты, а также дисбаланс между потенциально опасными и полезными бактериями кишечника могут быть ассоциированы с развитием ожирения, инсулинорезистентности и СД 2 типа [1].
Роль микробиоты в данном случае обусловлена ее влиянием на метаболизм энергетических субстратов, короткоцепочечных жирных кислот (КЦЖК), желчных кислот, а также развитием воспаления низкой степени в тканях, возникающего вследствие повышения проницаемости кишечного барьера при дисбиозе [18-22].
Влияние микробиоты кишки на метаболизм энергии и чрезмерное развитие жировой ткани продемонстрировано в экспериментах на мышах-гнотобиотах. Масса тела животных увеличивалась вдвое в ответ на введение микробиоты мышей, выращенных в обычных условиях [23, 24]. У мышей с генетически обусловленным ожирением баланс кишечной микрофлоры изменен в сторону значительного повышения доли бактерий типа Firmicutes и снижения доли Bacteroidetes. Следует отметить, что ТФМ от тучных мышей к мышам с нормальной массой тела вызывает ожирение у прежде здоровых животных [1, 25].
Все больше исследований свидетельствуют о снижении микробного разнообразия, нарушении проницаемости кишечного барьера, транслокации бактериальных антигенов и токсинов в кровеносное русло и в ткани с последующим развитием воспалительных реакций у пациентов с СД и ожирением [26].
Выявлены даже отдельные представители микробиома, которые могут быть ответственны за развитие СД 2 типа. Так, H.K. Pedersen и соавт. показали, что присутствие в составе микробиома толстой кишки бактерий Prevotella copri и Bacteroides vulgatus ассоциировано с развитием инсулинорезистентности [27].
МИКРОБИОТА И ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ КИШЕЧНИКА
Считается, что одним из факторов патогенеза ВЗК является потеря толерантности иммунной системы макроорганизма к комменсальной флоре, обитающей в кишечнике у генетически предрасположенных к ВЗК индивидуумов. Связь дисбиоза и ВЗК подтверждается тем, что у пациентов с ВЗК обнаруживается повышение уровней антимикробных антител. Например, у 29–69% пациентов с болезнью Крона выявляются IgA и IgG к Saccharomyces cerevisiae, у 24–55% — антитела к транспортному белку OmpC Escherichia coli, к флагеллину Cbir1 [28]. Кроме того, согласно данным проекта по полногеномному поиску ассоциаций (genome wide association study), обнаружено более 200 генов, предрасполагающих к развитию ВЗК, большая часть которых так или иначе участвует во взаимодействии между макроорганизмом и микроорганизмами, обитающими в кишечнике [29].
Связь между развитием ВЗК и нарушением состава микробиоты толстой кишки подтверждается также высокой частотой ассоциации ВЗК с антибиотикотерапией в раннем детском возрасте [30].
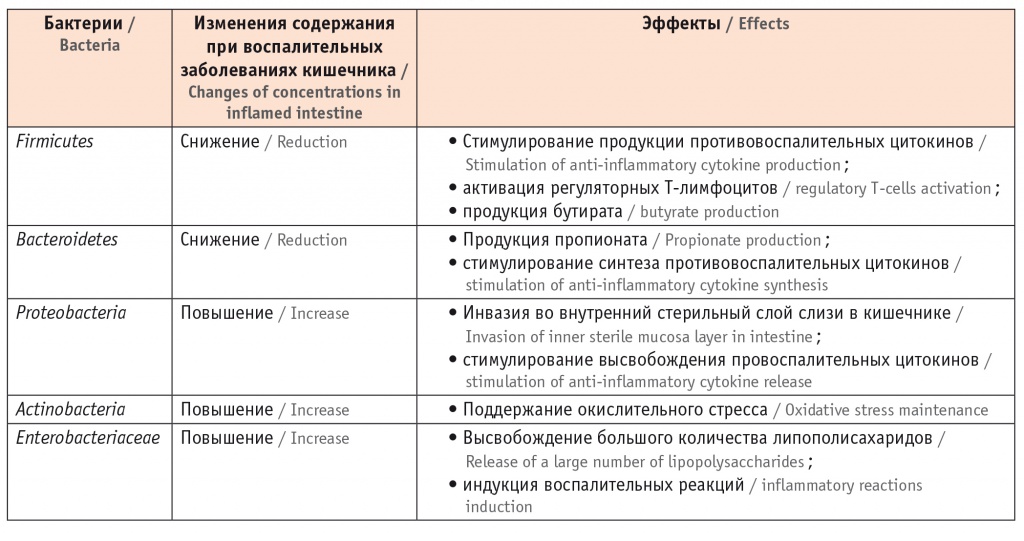
В целом ряде исследований показано, что у пациентов с ВЗК наблюдается обеднение видового разнообразия микробиоты кишечника, выражающееся в снижении числа представителей типов Firmicutes и Bacteroidetes наряду с преобладанием Proteobacteria, Actinobacteria и Enterobacteriaceae [31].
Известно, что Firmicutes и Bacteroidetes стимулируют продукцию противовоспалительных цитокинов (ИЛ-10) и работу регуляторных Т-лимфоцитов, синтезируют КЦЖК (бутират и пропионат) [32]. В частности, контакт полисахарида клеточной стенки Bacteroides fragilis с антиген-презентирующими клетками стимулирует активацию регуляторных Т-лимфоцитов и продукцию ИЛ-10 [33].
Снижение количества Firmicutes и Bacteroidetes у больных с ВЗК приводит к дисбалансу в работе иммунной системы и недостатку питательных веществ (КЦЖК) для колоноцитов.
У пациентов при болезни Крона с поражением тонкой кишки обнаружено увеличение количества Proteobacteria, в частности энтероадгезивной инвазивной E. сoli [34] и Fusobacterium nucleatum, во внутреннем слое слизи стенки кишечника, который в норме стерилен. Проникая в глубокие слои слизистой оболочки кишечника, данные бактерии запускают высвобождение провоспалительных цитокинов [35].
Частой находкой при ВЗК является увеличение доли сульфат-восстанавливающих бактерий, таких как Desulfovibrio. Эта группа бактерий продуцирует большое количество сероводорода, который токсичен для эпителиоцитов кишечника [36, 37].
Таким образом, в патогенезе ВЗК можно выделить несколько механизмов, которые связывают развитие данного заболевания с дисбиозом (табл.) [38]:
-
снижение количества бутират- и пропионат-продуцирующих бактерий в микробиоме кишечника (например, Firmicutes);
-
увеличение количества бактерий с провоспалительными свойствами (Enterobacteriaceae);
-
уменьшение доли водород- и метан-продуцирующих бактерий и увеличение доли сульфат-восстанавливающих бактерий;
-
рост числа бактерий, например Proteobacteria, несущих в составе клеточной стенки липополисахариды, обладающие выраженной антигенной активностью;
-
активация реакций окислительного стресса.
Таблица
Обобщенные данные об основных изменениях в микробиоме кишечника при воспалительных заболеваниях кишечника
В последнее время все шире обсуждается возможная роль вирусов в развитии ВЗК. Так, у мышей с аберрантным геном Atg16l1 (ген, отвечающий за аутофагию, один из генов, ассоциированных с развитием ВЗК) после заражения норовирусом развивался колит [39].
В микробиоме кишечника у пациентов с ВЗК наблюдается уменьшение количества грибов с противовоспалительными свойствами (Saccharomyces cerevisiae) наряду с увеличением числа условно-патогенных грибов, таких как Candida albicans [40, 41].
МИКРОБИОТА И РАК ТОЛСТОЙ КИШКИ
Результаты многих экспериментальных и клинических работ прямо или косвенно свидетельствуют об участии кишечной микробиоты в патогенезе колоректального рака (КРР).
Так, в экспериментах на мышах-гнотобиотах обнаружено, что они значительно реже болеют КРР, а применение антибиотиков у мышей, элиминирующих до 99,9% бактерий микробиома, снижает продукцию проканцерогенных цитокинов [42, 43]. J.P. Zackular и соавт. показали, что микробиота, пересаженная здоровым мышам от мышей, страдающих КРР, приводила к развитию воспаления и опухолей [44].
Несмотря на довольно разрозненные данные об изменениях микробиоты у больных раком толстой кишки, большинство исследователей сообщают о снижении микробного разнообразия, особенно за счет бутират-синтезирующих бактерий, а также о повышении доли потенциально патогенных бактерий Pseudomonas, Helicobacter и Acinetobacter [45].
В ряде исследований показано, что КРР ассоциирован с колонизацией толстой кишки бактериями определенных видов (F. nucleatum, энтеротоксигенным штаммом B. fragilis, E. coli, Streptococcus gallolyticus subsp. gallolyticus и Enterococcus faecalis). Считается, что в основе связи микробиоты толстой кишки и развития КРР лежит выработка ими метаболитов путем ферментации ингредиентов пищи. Эти метаболиты могут связывать специфические рецепторы на поверхности клеток кишечника и впоследствии влиять на трансдукцию внутриклеточного сигнала [46-48].
Действие метаболитов микробиоты может быть как проканцерогенным, так и антиканцерогенным. Например, КЦЖК (ацетат, бутират и пропионат) обеспечивают нормальную трофику и функционирование колоноцитов, снижают синтез провоспалительных цитокинов, препятствуя развитию КРР. Особо выраженной противоопухолевой активностью обладает бутират, продуцируемый преимущественно бактериями семейств Lachnospiraceae и Ruminococcaceae.
Доказано, что употребление в пищу большого количества растительных волокон значительно снижает риск КРР за счет продукции КЦЖК, в частности бутирата [49, 50]. В исследованиях in vitro, проводимых на культурах опухолевых клеток, бутират давал выраженный противоопухолевый эффект, индуцируя апоптоз клеток, ингибируя их пролиферацию, обусловливая эпигенетическую регуляцию экспрессии генов, снижая активность воспалительных процессов путем влияния на секрецию цитокинов [50].
С другой стороны, при микробном метаболизме красного мяса, животных жиров и рафинированных углеводов образуются вещества, такие как жирные кислоты с разветвленной цепью, фенилуксусная кислота, производные фенола и крезола, обладающие выраженным провоспалительным потенциалом. Таким образом, наблюдается связь между рационом человека, составом микробиоты и развитием КРР [51, 52].
Являются ли обнаруженные изменения причиной или следствием развития злокачественных новообразований, до сих пор не ясно. Так, показано, что экспансия бактерий вида F. nucleatum прогрессивно возрастает по мере злокачественного перерождения аденоматозных полипов [53].
В исследовании A.D. Kostic и соавт. [47] выявлена способность F. nucleatum индуцировать экспрессию провоспалительных генов, ответственных за синтез простагландина S2, ИЛ-6 и ИЛ-8, ФНО-α и других. Воспалительные медиаторы, влияя на активацию транскрипционного ядерного фактора (NF-κB), способствуют канцерогенезу в толстои кишке [46].
Аналогичные процессы описаны для бактерий Bacteroides massiliensis, Bacteroides ovatus, B. vulgatus, E. coli. Считается, что данные виды бактерий могут способствовать индукции воспаления и канцерогенеза в толстой кишке [54, 55].
Многие исследования демонстрируют связь факторов вирулентности бактерий с их канцерогенным потенциалом. Энтеротоксигенные штаммы B. fragilis (ETBF) продуцируют токсин фрагилизин (B. fragilis toxin, BFT), активирующий NF-κB, что приводит к усилению клеточной пролиферации [56-58]. Роль энтеротоксигенных штаммов B. fragilis в развитии рака толстой кишки обнаружена в исследовании S. Wu и соавт.: у мышей, кишечник которых колонизирован B. fragilis, значительно чаще выявляли КРР и аденоматозные полипы, чем у мышей группы контроля [59].
ЗАКЛЮЧЕНИЕ
На сегодняшний день расшифрованы отдельные механизмы, благодаря которым микробиота кишки, возможно, участвует в патогенезе колоректального рака, воспалительных заболеваний кишечника, СД 2 типа и болезней печени. Однако требуются дополнительные данные, которые бы позволили использовать имеющиеся факты в клинической практике.
Поступила: 10.10.2020
Принята к публикации: 20.01.2021








