ВВЕДЕНИЕ
На сегодняшний день эндометриоидные кисты яичников (ЭКЯ) — одно из основных показаний к выполнению оперативного вмешательства на придатках матки [1]. ЭКЯ являются фактором угнетения овариального резерва (ОР) как на дооперационном этапе (за счет непосредственного негативного влияния на морфофункциональное состояние гонады), так и в послеоперационном периоде (за счет непреднамеренного удаления здоровой ткани яичника вместе со стенкой образования) [2].
В настоящее время все больше внимания уделяется изучению опосредованных изменений в эндометрии на фоне скомпрометированной овариальной ткани, приводящей к формированию эндометриопатии, снижающей вероятность благополучного наступления беременности [3]. У последовательности изменений эндометрия в течение менструального цикла имеются ультразвуковые маркеры. Полученные знания позволят прогнозировать вероятность наступления беременности в естественном цикле. Морфологическая трансформация в эндометрии, определяющая его имплантационные свойства, по мнению ряда авторов, сопряжена с васкуляризацией преимущественно самого эндометрия, обусловленной формированием спиральных артерий и увеличением кровотока в базальных артериях субэндометриальной зоны [4, 5].
Возможности неинвазивной оценки морфологических свойств эндометрия по-прежнему ограничиваются использованием УЗИ. В последнее десятилетие в клиническую практику внедрена методика оценки эндометриального кровотока на основании данных объемного энергетического доплера [6]. Двухмерная эхография с применением режима энергетического доплера с последующей трехмерной реконструкцией в программе VOCAL1 позволяет взглянуть на ультразвуковые маркеры рецептивности эндометрия с новых позиций.
Ранее нами была показана определенная значимость 2D-эхографического профиля эндометрия в оценке структуры, толщины и гемодинамики (индекса резистентности, пульсационного индекса, отношения максимальной систолической скорости кровотока к максимальной диастолической скорости) у пациенток, перенесших органосохраняющие операции по поводу ЭКЯ [7]. В рамках данного исследования изучение морфофункционального состояния эндометрия получило продолжение с использованием 3D-эхографии.
Цель исследования: оценка имплантационных свойств эндометрия у пациенток, перенесших органосохраняющие операции по поводу ЭКЯ, по данным 3D-эхографии.
МАТЕРИАЛЫ И МЕТОДЫ
В протокол проспективного сравнительного клинического исследования были включены 172 пациентки репродуктивного возраста (по критериям STRAW+10 [8]), перенесшие органосохраняющие операции в связи с ЭКЯ в Городской клинической больнице № 31 Департамента здравоохранения города Москвы (главный врач — к. м. н. Ефремова Н.М.), на клинической базе кафедры акушерства и гинекологии педиатрического факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова Минздрава России (заведующий кафедрой — академик РАН, д. м. н., профессор Курцер М.А.). Всем пациенткам была предоставлена письменная и устная информация о методах обследования, и все дали согласие на участие в исследовании. Протокол исследования получил одобрение этического комитета РНИМУ им. Н.И. Пирогова.
Критерии включения в исследование:
-
возраст от 18 до 40 лет;
-
регулярный менструальный цикл;
-
ЭКЯ размерами 3,0–5,0 см в анамнезе;
-
бесплодие в анамнезе;
-
ИМТ 18,5–24,9 кг/м2;
-
отсутствие тяжелой экстрагенитальной патологии.
Из протокола исследования исключались пациентки, ранее перенесшие операции на матке и придатках, c сопутствующей гинекологической патологией и мужским фактором бесплодия в семейной паре.
Основным биохимическим индикатором морфофункционального состояния яичников являлся сывороточный уровень антимюллерова гормона (АМГ, нг/мл). Согласно стандартным критериям, на неизмененный ОР указывают значения АМГ в пределах 1,2–2,5 нг/мл, при показателях АМГ от 0,5 до 1,1 нг/мл ОР трактуется как низкий [9]. Соответственно по уровню АМГ, определенному через 6 месяцев после операции, пациенток ранжировали на две группы: I группу сформировали 114 женщин с низким ОР (АМГ < 1,2 нг/мл), II группу — 58 женщин с неизмененным ОР (АМГ ≥ 1,2 нг/мл).
Возраст пациенток варьировал от 18 до 40 лет. В I группе (с низким ОР) большинство участниц (n = 70; 61,4%) были старшего репродуктивного возраста, средний возраст женщин составил 35,8 ± 1,6 года. С учетом того что возраст является физиологическим фактором, негативно влияющим на показатели ОР, для анализа полученных данных в I группе были выделены две подгруппы: 44 женщины моложе 35 лет вошли в подгруппу IА, 70 женщин старшего репродуктивного возраста (35 лет и старше) — в подгруппу IБ. Во II группе (с неизмененным ОР) все 58 женщин, перенесших кистэктомию, были моложе 35 лет, средний возраст участниц был статистически значимо ниже, чем в I группе (28,6 ± 1,8 года, p ≤ 0,05).
Для уменьшения вероятности негативного влияния транзиторного асептического воспаления в ткани оперированного яичника УЗИ выполняли через 6 и 12 месяцев после кистэктомии [10]. Следовали стандартному протоколу УЗИ с последующей 3D-визуализацией на 6–8-й день от даты овуляции, в среднюю стадию фазы секреции, в предполагаемое «окно имплантации». Исследование выполняли на аппарате экспертного класса (Voluson 730 Expert, GE Kretz, Австрия) с использованием объемного трансвагинального датчика (3,3–10,0 МГц). Последующая офлайн-обработка массива данных объемного сканирования предполагала анализ объема эндометрия, определенного в ручном режиме в программном обеспечении VOCAL при ротации через сагиттальный срез с шагом ротации 9°; всего было получено 20 последовательных изображений, на которых в ручном режиме очерчивали эндометрий на миоэндометриальном соединении от внутреннего зева до дна матки [11].
Количественные параметры подсчитывались автоматически и были представлены в виде гистограммы. Гистограммы 3D-энергетического доплера отражали количественные объемные индексы кровотока как в самом эндометрии, так и в субэндометриальной зоне, определяемой как «оболочка» вокруг эндометрия толщиной 5 мм (с установкой shell по наружному контуру эндометрия толщиной 5 мм). Использовались 3D-индексы кровотока: индекс васкуляризации (VI), соответствующий насыщенности исследуемой зоны сосудами, индекс потока (FI), отражающий интенсивность кровотока в эндометрии и субэндометриальной зоне, и индекс перфузии (VFI) как отношение средневзвешенного числа цветных вокселов к общему числу вокселов в трехмерной эхограмме.
Статистический анализ полученных данных осуществлен в программе Microsoft Excel 2016. Для представления данных применяли методы описательной статистики. Количественные показатели сравниваемых групп представлены в виде среднего значения и стандартного отклонения (M ± SD). Статистическую значимость различий двух групп оценивали по критерию Стьюдента (t), при малой численности выборки применяли непараметрический критерий Манна — Уитни. Критическое значение уровня значимости принимали равным 0,05.
РЕЗУЛЬТАТЫ
При оценке менструальной функции выявлено укорочение менструального цикла до 23–25 дней у 37,5% и 20,2% обследованных I и II групп соответственно.
Первичное и вторичное бесплодие чаще встречалось в первой группе (12,5% и 20,1% соответственно), чем во второй (7,1% и 10,6%); в целом у пациенток с низким ОР бесплодие отмечалось в 1,8 раза чаще, чем у женщин с неизмененным ОР. Продолжительность бесплодия варьировала в диапазоне от 1 года до 7 лет.
При сравнении антропометрических данных статистически значимых различий групп по величине ИМТ не обнаружено: в первой группе ИМТ составил в среднем 20,5 ± 1,7 кг/м2, во второй — 21,3 ± 1,2 кг/м2 (p > 0,05). Экстрагенитальная патология в сравниваемых группах диагностировалась с одинаковой частотой.
Известно, что в число критериев оценки морфофункционального профиля эндометрия входят толщина (М-эхо) и ультразвуковая морфология эндометрия [12, 13].
Эхографическое исследование, выполненное во вторую фазу менструального цикла через 6 месяцев после операции по общепринятой методике в 2D-режиме, показало, что в I группе толщина эндометрия у большинства (n = 69; 60,5%) женщин варьировала от 7,6 до 8,8 мм. Средний показатель М-эхо в I группе в целом составил 7,2 ± 0,7 мм, в подгруппе IА — 7,4 ± 1,6 мм, в подгруппе IБ — 6,1 ± 1,2 мм.
Неудовлетворительная ультразвуковая картина эндометрия определялась у 24 (21,05%) пациенток I группы и характеризовалась тонким эндометрием, величиной М-эхо не более 6,0 мм (в среднем 4,7 ± 0,8 мм), неровностью и прерывистостью срединной линии соприкосновения эндометрия передней и задней стенок матки, неоднородной эхогенностью, наличием единичных гиперэхогенных включений в субэндометриальном пространстве.
У 8 из этих 24 женщин регистрировался экстремально тонкий эндометрий, толщина которого не превышала 5,0 мм (3,5 ± 0,1 мм), что принято расценивать как критический показатель для успешной имплантации [14]. На эхограммах этих пациенток лоцировались признаки органической патологии эндометрия: определялись неровность наружного контура функционального слоя, наличие эхонегативных кистозных включений до 2 мм на фоне экстремально тонкого эндометрия. Отмечались неоднородность и асимметрия передней и задней стенок матки. Визуализированную ультразвуковую картину следует расценивать как эндометриопатию.
По анамнестическим данным, выявленным в ходе индивидуального анализа, у 11 из 24 женщин с неудовлетворительной ультразвуковой картиной ранее выполнялись внутриматочные вмешательства по поводу неразвивающейся беременности малого срока. Все эти пациентки относились к старшей возрастной группе.
Сопоставление результатов проведенного эхографического исследования с ультразвуковыми протоколами до кистэктомии показало, что изменения в эндометрии, наблюдавшиеся у пациенток I группы, не были связаны с выполнением операции и течением послеоперационного периода.
Эхографический профиль эндометрия у 58 женщин II группы характеризовался однородностью структуры, низкой эхогенностью, наличием четкой однородной гиперэхогенной границы на линии соприкосновения передней и задней стенок матки; величина М-эхо варьировала от 8,9 до 11,1 мм и в среднем составила 8,8 ± 1,2 мм. Эхографические признаки секреторного эндометрия при неизмененном ОР соответствовали общепринятым популяционным значениям.
Объем эндометрия у пациенток сравниваемых групп рассчитывался с использованием 3D-эхографии. Сопоставление полученных данных выявило его уменьшение в подгруппе IБ (1,93 ± 1,09 см3) в 1,3 раза при сопоставлении с подгруппой IА и в 1,5 раза в сравнении со II группой (2,58 ± 1,72 см3 и 2,96 ± 2,11 см3 соответственно), однако полученные различия не обладали статистической значимостью (в обоих случаях p > 0,05).
Отсутствие динамики изменения объема эндометрия в среднюю секреторную фазу менструального цикла у пациенток подгруппы IБ определялось сономорфологическими признаками экстремально тонкого эндометрия. При использовании энергетической доплерографии представилось возможным визуализировать сосуды наименьшего диаметра с низкими скоростями кровотока. Значения трехмерной гистограммы, полученные через 6 месяцев после перенесенного оперативного вмешательства по поводу ЭКЯ, указаны в таблице 1.
Таблица 1
Показатели объемных индексов кровотока через 6 месяцев после кистэктомии, полученные с применением энергетического доплера
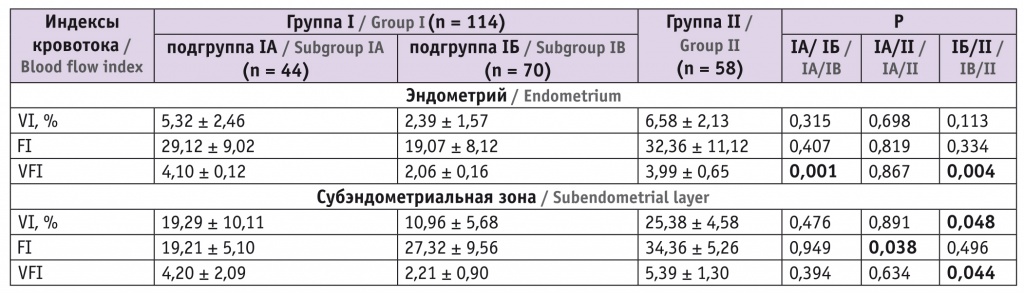
Примечание. В таблицах 1, 2: VI — индекс васкуляризации; FI — индекс потока; VFI — индекс перфузии.
Объем эндометрия и морфологические маркеры неблагоприятного состояния слизистой матки соответствовали нарушениям васкуляризации на уровне спиральных артерий и базальных артерий в проекции субэндометриальной зоны.
В подгруппе IБ зарегистрированы наименьшие значения индексов объемного кровотока, при этом отчетливая эхографическая визуализация спиральных артерий отмечалась в 10% наблюдений. В субэндометриальной зоне у 8 (11,4%) пациенток данной подгруппы с экстремально тонким эндометрием наименьшее значение индекса васкуляризации (VI) составило 4,12%, а в целом по подгруппе показатель VI варьировал от 4,12% до 12,33% и в среднем составил 10,96 ± 5,68%, что статистически значимо меньше, чем у обследованных II группы (р ≤ 0,05).
В подгруппе IА активная визуализация эндометриальной и субэндометриальной перфузии зарегистрирована у 17 (38,6%) женщин. Отмечалось равномерное распределение окрашенных эхо-сигналов, в субэндометриальной зоне численные значения индекса васкуляризации (VI) варьировали от 10,21% до 21,59%, в субэндометриальной зоне и эндометрии средние показатели VI были выше, чем в подгруппе IБ, в 1,8 и 2,2 раза соответственно.
У пациенток с низким ОР 35–40 лет (подгруппа IБ) сохранялось снижение показателей объемной гемодинамики в сравнении с таковыми у женщин с низким ОР моложе 35 лет (подгруппа IA) и с сохраненным ОР (группа II). Индекс потока (FI) в подгруппе IБ также демонстрировал отчетливое снижение в эндометрии, что наряду со снижением перфузии свидетельствовало об уменьшении интенсивности кровенаполнения в изучаемой области.
При исходно неизмененной ультразвуковой картине эндометрия, т. е. в группе II, у большинства (n = 45, 77,6%) обследованных сохранялась четко визуализировавшаяся эндометриальная и субэндометриальная перфузия. Индекс васкуляризации (VI) в субэндометриальной зоне составил в среднем 25,38 ± 4,58%, что не имело статистически значимых отличий от аналогичного показателя в подгруппе IA (p > 0,05). В обеих зонах исследования все изученные индексы у пациенток II группы при построении гистограмм были в 1,7–2,1 раза выше, чем у пациенток со сниженным ОР.
Ультразвуковой анализ предикторов состояния эндометрия через 1 год после кистэктомии выполнялся у 154 пациенток. Из дальнейшего наблюдения были исключены 18 женщин: 15 пациенток в связи с наступлением самопроизвольной беременности и 3 пациентки, которые самостоятельно обратились в отделение ЭКО.
Через 12 месяцев объем эндометрия у обследованных женщин II группы не имел статистически значимой разницы с результатами предыдущего исследования, средний показатель составил 2,41 ± 2,80 см3. У пациенток подгруппы IA отмечено улучшение морфофункционального состояния эндометрия в виде увеличения его объема в 1,2 раза (до 3,01 ± 2,4 см3). В подгруппе IБ объем железистого слоя матки оставался сниженным (1,89 ± 1,72 см3).
В группе I наблюдалось улучшение качественных эхографических и количественных характеристик эндометриальной и субэндометриальной перфузии. Гемодинамические показатели представлены в таблице 2.
Таблица 2
Показатели объемных индексов кровотока через 12 месяцев после кистэктомии, полученные с применением энергетического доплера
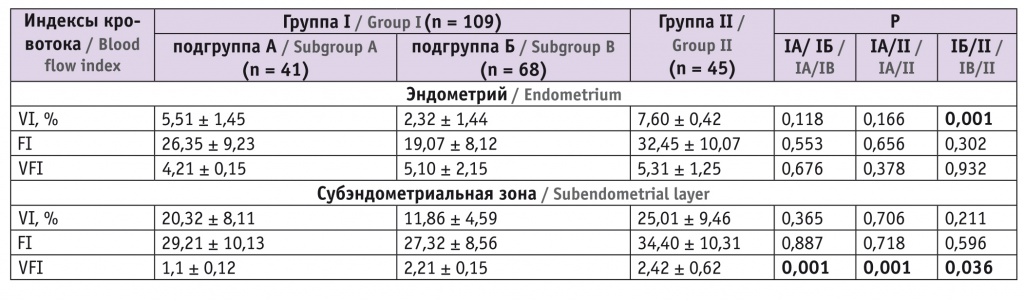
Количественная оценка и сопоставление результатов, полученных в эндометрии и субэндометриальной зоне, позволяют констатировать, что к году после перенесенного оперативного вмешательства по поводу ЭКЯ в обеих группах исследования преимущественно увеличилась степень васкуляризации эндометрия.
ОБСУЖДЕНИЕ
Вынужденное непреднамеренное повреждение яичника при оперативном лечении ЭКЯ и ранее диагностированном бесплодии, описанное нами ранее [7], обусловливает морфофункциональные изменения не только в самом яичнике, но и, опосредованно, в эндометрии, что следует рассматривать как один из факторов ассоциированного с эндометриозом бесплодия. По полученным нами данным, наибольшей прогностической значимостью в отношении изменения имплантационных свойств эндометрия в послеоперационном периоде обладает определение индекса васкуляризации (VI).
Исходя из того, что минимальный эффективный период для репарации свойств яичников составляет полгода, количественную оценку показателей кровотока целесообразно проводить через 6 месяцев после операции. В представленном исследовании через 6 месяцев после кистэктомии параметры кровотока у пациенток с низким ОР статистически значимо отличались от таковых у молодых женщин с сохраненным ОР. Индивидуальный анализ выявил уменьшение объема эндометрия и объемных показателей кровотока у пациенток старшего репродуктивного возраста с низким ОР.
Через год после операции по поводу ЭКЯ у пациенток моложе 35 лет с исходно низким ОР состояние эндометрия приблизилось к таковому у женщин с неизмененным ОР, а у пациенток старшего репродуктивного возраста при сниженном ОР сохранялись сниженный объем эндометрия и нарушения в гемодинамике.
ЗАКЛЮЧЕНИЕ
Вовлеченность эндометрия в патогенетические механизмы бесплодия при эндометриозе яичников проявляется в ухудшении показателей кровотока в слизистой матки.
В рамках проведенной работы показано, что использование УЗИ в режиме 3D с функцией энергетической доплерографии при бесплодии является дополнительным, наиболее объективным методом оценки объема эндометрия и объемного кровотока на уровне базальных и парабазальных артерий. Трехмерная визуализация — новый метод, требующий дополнительных изысканий и разработки критериев оценки несостоятельности эндометрия. Комплексный анализ предикторов нарушения рецептивности эндометрия — объема эндометрия и объемного кровотока в базальном и парабазальном эндометриальном слое — с использованием энергетической доплерографии повышает эффективность оценки имплантационных свойств эндометрия.
Поступила: 05.07.2020
Принята к публикации: 21.08.2020
_________________
1 VOCAL (англ. Virtual Organ Computer-aided AnaLysis) — специализированная программа для количественной оценки трехмерных данных, полученных в режиме статического 3D-сканирования. — Прим. авт.








