Согласно отчету Федеральной службы государственной статистики (2011), каждая пятая женщина боится принимать препараты на основе половых гормонов в связи с возможным развитием осложнений, в первую очередь связанных с сердечно-сосудистой системой[1]. Чаще пользуются данными препаратами в виде гормональной контрацепции молодые женщины. Женщины среднего и пожилого возраста относятся к ним более настороженно. В то же время при наступлении менопаузы происходит глобальная перестройка в организме женщины, приводящая к инициации многих патологических процессов. Помимо вазомоторных симптомов, проявляющихся сразу и значительно снижающих качество жизни пациенток, постепенно и малозаметно развиваются более опасные для жизни осложнения, такие как остеопороз, саркопения, метаболический синдром, сахарный диабет (СД) атеросклероз различной локализации (коронарные, церебральные и периферические артерии). Осложнения данных заболеваний могут стать причиной преждевременной смерти. При этом начинают прогрессировать патологические состояния и со стороны головного мозга: нарушения сна, тревожность, депрессия, мигрень, деменция и др.[2].
По данным исследования GBD (Глобальное бремя болезней), основными причинами смерти в экономически развитых странах являются сердечно-сосудистые заболевания, онкологические болезни, хроническая обструктивная болезнь легких (ХОБЛ), СД[2]. При этом приоритетность смертельных заболеваний у женщин различается в зависимости от их возраста, что связано с длительностью временно́го периода после наступления менопаузы.
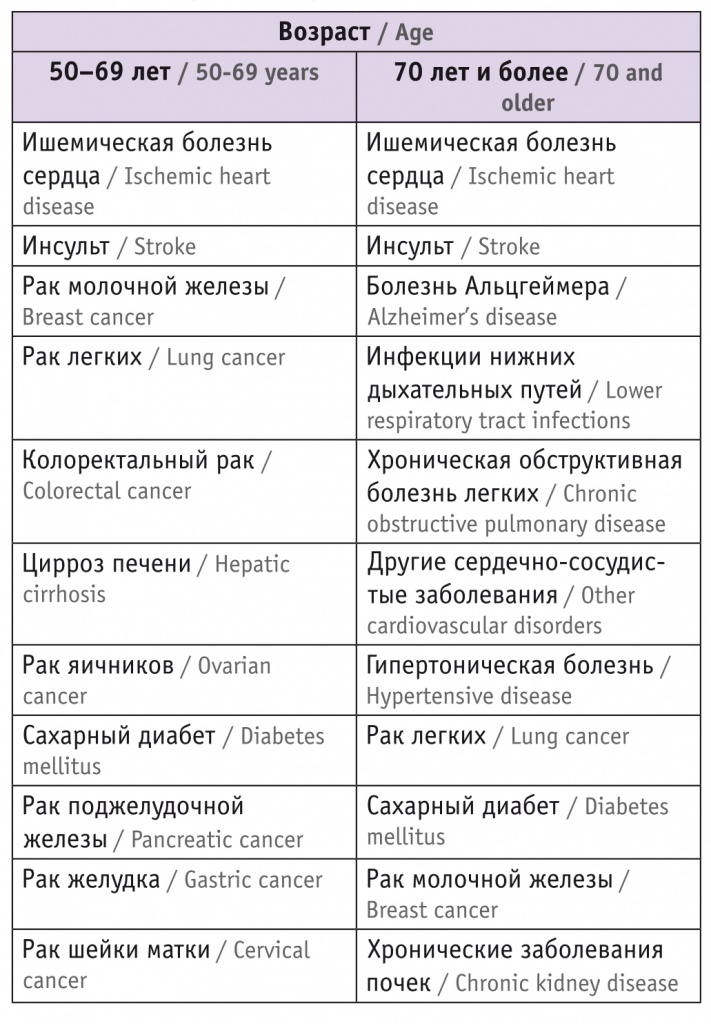
Как видно из представленных в таблице 1 данных, в группах женщин 50–69 и ≥ 70 лет лидируют ишемическая болезнь сердца (ИБС) и инсульт, что связано с крайне негативным влиянием менопаузы на развитие атеросклероза. На ее фоне происходит целый комплекс патологических изменений непрямого и прямого действия на артерии: нарушается липидный обмен, развиваются инсулинорезистентность, артериальная гипертензия и висцеральное ожирение, активируется ренин-ангиотензинная система, снижается уровень NO-синтазы, усиливается оксидантный стресс, повышается ригидность артерий, формируется эндотелиальная дисфункция и т. д. [3].
Таблица 1
Ведущие причины смерти женщин в постменопаузе[2]
Не следует забывать и о таком факторе, как снижение физической активности, которое тоже способствует развитию ожирения. Если набор веса в среднем возрасте — это просто проявление старения, не связанное с менопаузальными гормональными изменениями, то снижение уровня эстрогенов в менопаузальном периоде может способствовать накоплению абдоминальной жировой ткани[4–7]. Показано, что у женщин без метаболических нарушений и с нормальным ИМТ (< 25 кг/м2), но с окружностью талии более 80 см повышен риск развития рака молочной железы (РМЖ): ОР = 1,38; 95%-й ДИ: 1,09–1,75. По всей видимости, повышенный риск РМЖ и других онкологических болезней связан с хроническим воспалением, возникающим на фоне ожирения[8]. Увеличение веса приводит также ко многим психологическим проблемам. В частности, снижается самооценка, возникают сексуальная дисфункция, депрессия и в целом психологический дистресс[4].
Назначение же менопаузальной гормональной терапии (МГТ) положительно влияет на гомеостаз глюкозы и липидов за счет воздействия на β-клетки поджелудочной железы, скелетные мышцы, печень и жировую ткань. Это приводит к уменьшению абдоминального жира, улучшению метаболизма глюкозы и чувствительности к инсулину, снижению заболеваемости СД 2 типа[9–11]. В одном из метаанализов, включавшем 107 исследований, показано, что у женщин, изначально не имеющих СД, МГТ уменьшает заболеваемость на 30%, а у женщин с диабетом МГТ снижает уровень глюкозы крови натощак на 11,5%, а индекс инсулинорезистентности — на 36%. При этом пероральная терапия оказывала более выраженное положительное влияние на показатели углеводного обмена[12].
Еще в одном исследовании представлены результаты наблюдения за женщинами, которые в течение 2 лет во время менопаузы принимали эстрадиол/дидрогестерон 1/10 в циклическом режиме перорально. Получено статистически значимое снижение уровня глюкозы крови натощак (с 5,13 ± 0,07 до 4,87 ± 0,06 ммоль/л, p < 0,05) и инсулина (с 4,14 ± 0,13 до 2,88 ± 0,11 МЕ/л, p < 0,01), на основании чего авторы вынесли заключение, что МГТ при таком сочетании препаратов может предотвращать развитие инсулинорезистентности и СД 2 типа[13].
В 2018 г. были опубликованы рекомендации Европейского общества по мено- и андропаузе (англ. European Menopause and Andropause Society — EMAS) «Менопауза и сахарный диабет», в которых обобщены полученные результаты и, в частности, говорится[14]:
- МГТ оказывает положительное действие на гликемический профиль у женщин как без СД, так и с диагностированным СД 2 типа;
- своевременно начатая МГТ может отсрочить развитие СД 2 типа;
- предпочтительна пероральная МГТ, так как она обладает наиболее выраженным эффектом в отношении углеводного обмена (за исключением случаев абсолютных противопоказаний);
- при наличии высокого риска тромбозов можно попробовать использовать трансдермальные формы МГТ;
- из доступных и исследованных гестагенов в составе пероральной МГТ предпочтительны метаболически нейтральные, не снижающие положительного влияния эстрогенов на углеводный обмен (такие как прогестерон и дидрогестерон).
На прошедшем в мае 2019 г. в Берлине Европейском конгрессе по мено- и андропаузе также подробно обсуждались вопросы эффективности и безопасности различных видов МГТ. Было показано, что при пероральном приеме эстрогены всасываются в кишечнике и портальной циркуляцией доставляются в гепатоциты, чем достигается супрафизиологическая концентрация в печени перед разбавлением внутри системной циркуляции[15–17]. Это позволяет положительно влиять на метаболизм липидов в гепатоцитах в виде повышения синтеза ЛПВП и элиминации из кровотока ЛПНП, а также на углеводный обмен в виде повышения чувствительности к инсулину. При трансдермальной терапии эстрогенами таких супрафизиологических дозировок в печени, сохраняющих терапевтическую дозу, достичь невозможно, поэтому трансдермальная терапия не может оказывать благоприятного действия на липидный и углеводный обмен. При этом следует отметить тот факт, что на примере МГТ с дидрогестероном показано статистически значимое повышение концентрации антиатерогенных ЛПВП в плазме крови[18, 19].
Вслед за рекомендациями по менопаузе и сахарному диабету EMAS в 2020 г. опубликованы новые рекомендации по менопаузе и дислипидемиям, в которых отмечено[20]:
- системные эстрогены при пероральном приеме в составе МГТ индуцируют значительное дозозависимое снижение уровней общего холестерина, ЛПНП и липопротеина (а), а также увеличение концентрации ЛПВП;
- предпочтительными гестагенами в составе комбинированной МГТ являются метаболически нейтральные гестагены: дидрогестерон или прогестерон;
- пациенткам с выраженной триглицеридемией могут рекомендоваться трансдермальные формы эстрогенов в сочетании с метаболически нейтральными гестагенами (дидрогестерон или прогестерон);
- МГТ должна применяться совместно с основным видом терапии дислипидемий, с коррекцией питания и физических нагрузок.
Учитывая вышеизложенное, применение пероральных эстрогенов и дидрогестерона может рассматриваться как терапия выбора у женщин с дислипидемией без выраженной триглицеридемии. Данные рекомендации еще раз подтвердили благоприятное влияние системной пероральной МГТ на метаболические нарушения.
Выявлено, что во время менопаузы повышаются уровни провоспалительных цитокинов, таких как IL-1β, IL-6 и ФНО-α, и снижается концентрация противовоспалительного IFN-γ. МГТ частично устраняет влияние старения на иммунитет за счет увеличения количества В- и Т-клеток и снижения уровней провоспалительных цитокинов ФНО-α и IL-6. Кроме этого, МГТ улучшает баланс цитокинов Th1/Th2. Все это позволяет лучше бороться с различными инфекционными и онкологическими процессами[21].
В одном из последних отечественных исследований обнаружено, что стандартная, низко- и ультранизкодозированная пероральная МГТ с дидрогестероном оказывает положительное влияние на уровни провоспалительных цитокинов и иммуноглобулинов, которые характерны для коморбидных пациентов с СД 2 типа, ХОБЛ и климактерическим синдромом, и помогает достигать индивидуальных целевых показателей гликемии[22].
Как отмечено выше, ИБС является основной причиной смерти женщин в постменопаузе. Поэтому именно на ИБС проводились многочисленные исследования влияния МГТ на развитие атеросклероза. В целом современные данные свидетельствуют об эффективности МГТ в отношении профилактики коронарных событий. При этом положительный эффект может зависеть от возраста женщины, времени начала терапии и длительности менопаузы, типа и дозы гормонов, в особенности гестагена.
Так, были проанализированы данные финского национального регистра за 2002–2009 гг., включавшего 91 130 женщин в постменопаузе; продолжительность наблюдения составила 378 602 пациенто-года, а длительность применения МГТ — от 1 года до 9 лет. Женщины были разделены на две группы в зависимости от возраста начала применения МГТ — до и после 60 лет[23]. Смертность у женщин, начавших принимать МГТ в более молодом возрасте (до 60 лет), была в 2,5 раза ниже, чем у женщин, начало лечения которых пришлось на более поздний срок (после 60 лет).
Это может быть связано с защитными эффектами МГТ в более молодом возрасте, когда еще нет сформированной атеросклеротической бляшки. В таком случае эстрогены усиливают вазодилатацию за счет увеличения концентраций NO и PGI2, уменьшается воспаление эндотелия в связи со снижением уровней CAMs, MCP-1 и ФНО-α, снижается пролиферация гладкомышечных клеток, уменьшается активация тромбоцитов и перекисного окисления ЛПНП, в меньшей степени откладывающихся в сосудистой стенке. Назначение же МГТ при уже сформированной атеросклеротической бляшке, имеющей покрышку, чревато вредными эффектами, ведущими к ее нестабильности. Это обусловлено сниженной экспрессией и функцией эстрогеновых рецепторов, уменьшением эстрогенопосредованной вазодилатации на фоне повышения воспалительного процесса, уровня ММР и неоваскуляризации[24]. Именно поэтому крайне важно инициировать терапию в пределах окна терапевтических возможностей.
Отдельно следует остановиться на деменции, которая может носить сосудистый характер (быть следствием атеросклероза церебральных и прецеребральных артерий) и иметь дегенеративную природу, проявляющуюся болезнью Альцгеймера — третьей по частоте причиной смерти у женщин старше 70 лет (см. табл. 1). Показано, что наряду с классическими симптомами одним из признаков репродуктивного старения выступают нарушения когнитивных способностей: внимания, восприятия, памяти, речи, интеллекта — возможностей познавать мир и взаимодействовать с ним[25]. При этом установлено, что переломный момент в снижении когнитивных способностей приходится на период перименопаузы[26]. В одном из исследований выявлена статистически значимая взаимосвязь между возрастом на момент ранней овариэктомии и возникновением деменции (ОР = 1,46; 95%-й ДИ: 1,13–1,90; р = 0,005), а также паркинсонизма (ОР = 1,68; 95%-й ДИ: 1,06–2,67; р = 0,003). С другой стороны, среди женщин, перенесших овариэктомию до 45 лет, но получавших заместительную терапию эстрогенами до 50 лет (т. е. до того возраста, когда в среднем наступает менопауза), повышения риска развития когнитивных нарушений и деменции не отмечалось[27].
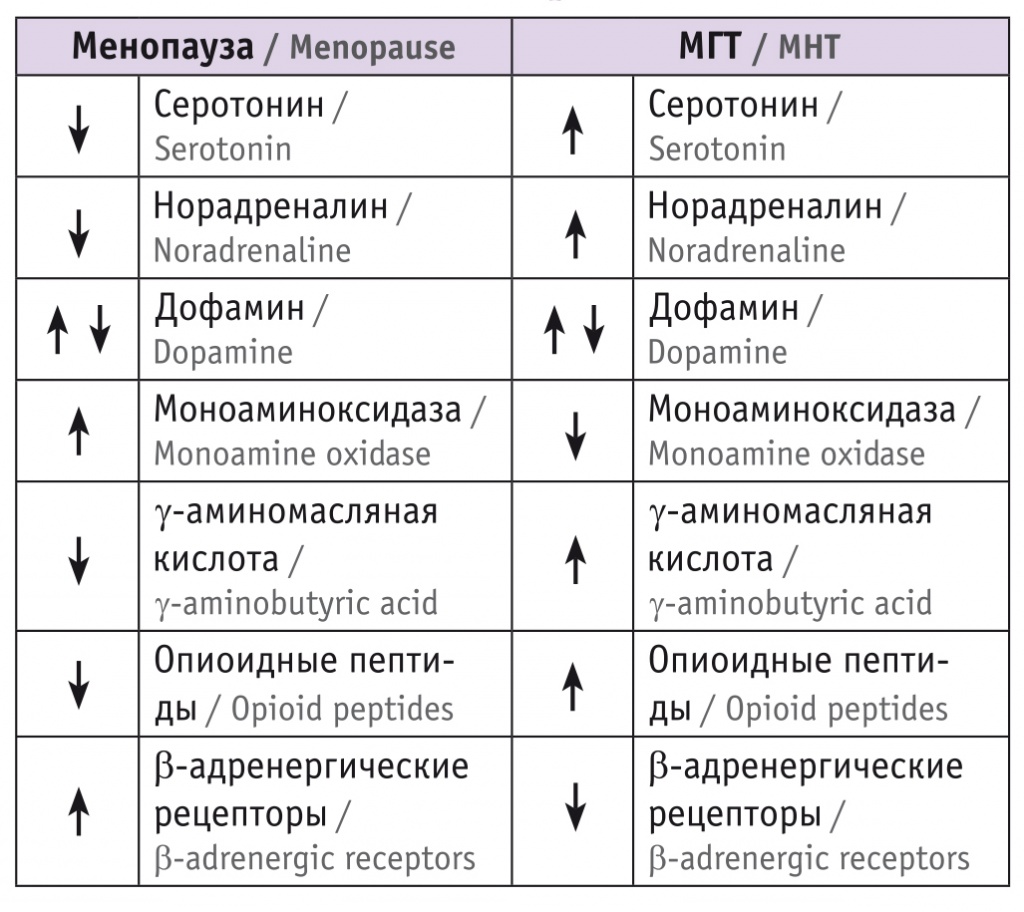
При наступлении менопаузы в головном мозге женщины происходит целый комплекс патологической разбалансировки нейромедиаторов (табл. 2), ведущий к формированию депрессивного состояния[28]. Назначение пероральных эстрогенов способно восстановить их нормальные уровни и уменьшить проявления депрессии.
Таблица 2
Динамика нейромедиаторов головного мозга на фоне менопаузы и менопаузальной гормональной терапии (МГТ)
Неоднократно проводились исследования, направленные на выяснение причины развития когнитивных нарушений у женщин после менопаузы. Так, в шведском проспективном популяционном исследовании, которое длилось 20 лет и включало 6103 женщины в возрасте 57,5 ± 5,9 года, изучалась связь атеросклероза с различными подтипами деменции и соответствующими заболеваниями. Авторы сделали вывод, что развившаяся у 462 человек деменция была связана с более высоким индексом интима-медиа сонной артерии, т. е. во многом была связана с атеросклерозом[29].
Еще в одном исследовании показано, что дефицит эстрогенов в перименопаузе приводит к снижению когнитивных функций ЦНС и является преморбидным фоном для формирования тревожно-депрессивных расстройств, в то время как эстрогены обладают антидепрессивным эффектом. Своевременно начатая МГТ, воздействуя в том числе на стволовые клетки гиппокампа, профилактирует развитие нейродегенеративных заболеваний и, по данным метаанализа, снижает риск развития болезни Альцгеймера[30].
Таким образом, в целом эстрогены оказывают целый комплекс благоприятных воздействий на головной мозг: улучшают обмен нейромедиаторов, повышают интеграцию нейронов, имеют нейротрофическое и нейропротективное свойства, способствуют повышению утилизации глюкозы клетками головного мозга, обладают антигипоксантными эффектами, увеличивают мозговой кровоток[31]. Кроме этого, эстрогены уменьшают патологические отложения амилоида — ключевого звена патогенеза болезни Альцгеймера — и подавляют активность клеток микроглии[32].
Тот факт, что около двух третей случаев болезни Альцгеймера развивается именно у женщин в постменопаузе, указывает на гендерный характер этого распространенного заболевания в отсутствие должного уровня эстрогенов. Для подтверждения этой гипотезы было проведено несколько исследований. В одном из них — проспективном когортном исследовании когнитивных функций и старения (США), длившемся 12 лет и включавшем 2114 белых женщин старше 65 лет, оценивалось влияние эстрогенов на когнитивный статус. Авторы пришли к заключению, что как более продолжительный репродуктивный период, так и применение МГТ ассоциируется с профилактикой когнитивных нарушений. При этом более раннее назначение МГТ (в пределах 5 лет после последней менструации) ассоциировано с улучшением когнитивной функции по сравнению с более поздним началом[29].
В другой работе — финском проспективном когорном исследовании, продолжавшемся 20 лет, с 1989 по 2009 г., изучалась связь между МГТ и болезнью Альцгеймера. По полученным данным, применение эстрогена в постменопаузе не имеет ассоциации с риском развития болезни Альцгеймера и, напротив, длительное применение МГТ статистически значимо ассоциируется со снижением этого риска[33].
Можно сделать следующий общий вывод: ранний период после менопаузы связан со снижением когнитивной функции, что подчеркивает потенциальную важность эстрогенов; начало МГТ вскоре после менопаузы и продолжение ее в долгосрочной перспективе снижают риск развития болезни Альцгеймера и других когнитивных нарушений.
Наряду с однозначной эффективностью МГТ в плане профилактики атеросклероза, СД, сосудистой и дегенеративной деменции, повышения иммунитета, снижения хронического воспаления и т. д., существует другая сторона медали — возможность венозных тромбоэмболических осложнений (ВТЭО), которая обусловливает страх женщин и врачей перед этой терапией. Однако риск таких осложнений при применении МГТ во многом зависит от вида эстрогена и его концентрации: как правило, синтетический эстроген значительно опаснее, чем натуральный, а увеличение дозировки эстрогена ассоциируется с повышением риска развития ВТЭО[34]. Это во многом связано с вазодилатирующими свойствами эстрогенов, обеспечивающими замедление тока крови в венах, а также с повышением содержания в крови некоторых факторов свертывания[35]. Следует отметить, что после года МГТ риск возникновения ВТЭО значительно снижается, поскольку за это время обычно реализуются скрытые тромбофилические состояния[34].
В отношении возможного развития венозного тромбоза большое значение имеют и гестагены. В одном из последних исследований, проведенных в Великобритании, осуществлялся анализ баз данных QResearch и Clinical Practice Research Datalink в 1997–2017 гг. методом «случай — контроль». Исследованием было охвачено значительное количество женщин (n = 80 396)[36]. Результаты проведенной работы показали, что:
- МГТ эстрадиолом в сочетании с дидрогестероном характеризуется минимальным, не имеющим статистической значимости повышением риска ВТЭО, в отличие от другой комбинированной МГТ;
- ни циклическая, ни непрерывная схема приема эстрадиола с дидрогестероном не сопряжена со статистически значимым повышением риска ВТЭО;
- использование МГТ с различными дозировками эстрадиола связано с низким риском ВТЭО при условии использования дидрогестерона;
- при МГТ с дидрогестероном у пациенток в возрасте 65–79 лет шанс развития ВТЭО меньше, чем при терапии с другими гестагенами;
- наиболее предпочтительной комбинацией МГТ у пациенток с избыточной массой тела является сочетание эстрадиола с дидрогестероном;
- комбинированная терапия с медроксипрогестероном ассоциирована с более высоким риском ВТЭО.
Статистически значимое повышение риска ВТЭО в описываемом исследовании отмечено при МГТ со всеми гестагенами, кроме дидрогестерона, в том числе с дроспиреноном и норгестрелом. Однако в связи с малым количеством участниц исследования, принимавших норгестрел/левоноргестрел или дроспиренон, авторы анализировали эти препараты как один тип, что потенциально может искажать результаты[36]. Можно предположить, что отсутствие в базах данных информации о применении названных гестагенов (менее 1%) говорит о достаточно редком их использовании в когорте женщин Великобритании.
ЗАКЛЮЧЕНИЕ
Менопаузальная гормональная терапия (МГТ) не только устраняет различные климактерические проявления, но и обладает мощнейшими профилактическими свойствами в отношении развития атеросклероза, сахарного диабета, абдоминального ожирения, сосудистой и дегенеративной деменции. Пероральная форма МГТ в 4–5 раз эффективнее, чем трансдермальные, однако для лечения необходимо использовать терапевтическое окно, составляющее не более 5–10 лет после наступления менопаузы. Для снижения риска развития венозных тромбоэмболических осложнений предпочтительно использовать натуральный эстроген в минимально возможной дозировке, а из гестагенов самым безопасным и нейтральным является дидрогестерон.
Поступила: 28.04.2020
Принята к публикации: 03.06.2020








