Многочисленные исследования последних лет указывают на значительную распространенность хронического эндометрита (ХЭ) в популяции женщин репродуктивного возраста. Частота его выявления варьирует от 2,5% до 85%. Именно ХЭ при крайней скудности клинической симптоматики приводит к тяжелым последствиям — невынашиванию беременности (НБ), неразвивающейся беременности, бесплодию, неудачам имплантации в программах ВРТ, акушерским осложнениям[6, 8–10, 13, 15]. Отсутствие тенденции к снижению распространенности ХЭ многие исследователи объясняют неизменно высокой частотой прерывания беременности путем кюретажа, необоснованными повторными хирургическими вмешательствами в полости матки и неполноценной реабилитацией травмированного эндометрия. В стране с «абортным менталитетом» особую актуальность приобретают реабилитация женщин, перенесших хирургический аборт или потерю желанной беременности, и их прегравидарная подготовка к каждой последующей беременности[1, 2, 4, 5, 12].
В настоящее время доказано, что вмешательства в полость матки могут провоцировать деструктивное воздействие иммунокомпетентных клеток на ткани эндометрия и развитие хронического аутоиммунного процесса. Существует понятие рецептивности эндометрия, ее определяют как комплекс структурно-функциональных характеристик эндометрия с четкими временны́ми и пространственными константами, характеризующими его способность к имплантации и возможность вынашивания беременности[6, 9].
Однако все еще отсутствует единая концепция патогенеза ХЭ, раскрывающая механизм его формирования и взаимосвязи различных изменений в эндометрии, что препятствует стандартизации терапии и усугубляет имеющееся репродуктивное нездоровье женщин фертильного возраста на популяционном уровне[3, 7, 11, 17, 18, 20, 21].
Анализ литературы последних лет показал, что авторы не акцентируют внимание на необходимости сохранения и восстановления репродуктивного здоровья пациенток после потери беременности и неудачных попыток ВРТ, которые предопределяют рост распространенности ХЭ. Совершенствование комплекса диагностических и лечебных мероприятий возможно на основе расширения существующих представлений о механизмах развития изучаемого заболевания[14, 16, 19].
Цель исследования: выявить патогенетические особенности ХЭ у женщин с трубным бесплодием (ТБ) или НБ в анамнезе.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено в период 2012– 2014 гг. на клинических базах кафедры акушерства и гинекологии Института последипломного образования ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В. Ф. Войно-Ясенецкого» Минздрава России (зав. кафедрой — д. м. н., профессор А. Т. Егорова), Медицинского центра гинекологической эндокринологии и репродукции «Три сердца» (директор — С. А. Сыромятникова), патологоанатомического отделения Дорожной клинической больницы г. Красноярска (зав. отделением — д. м. н., профессор А. К. Кириченко). В исследовании на этапе прегравидарной подготовки приняли участие 385 женщин в возрасте 19–42 лет, планировавших беременность. Методом дискриминантного анализа когорта исследованных была разделена на три группы: 155 женщин с бесплодием; 140 женщин с НБ в анамнезе; 90 женщин без нарушений репродуктивного здоровья, которые составили группу контроля.
Критерием включения в исследование было морфологическое и иммуногистохимическое подтверждение ХЭ.
Критерии исключения: тяжелые экстрагенитальные заболевания, являющиеся противопоказаниями для наступления и пролонгирования беременности; генетические и приобретенные значимые тромбофилии; аномалии развития матки; миома матки и эндометриоз; туберкулез и острые инфекционные заболевания.
В группе пациенток с бесплодием из исследования были исключены 55 женщин, из группы НБ — 40, частота выявления ХЭ в данных группах составила 64,5% и 71,4% соответственно (p < 0,05).
Далее сформировали группы исследования: первая группа — 100 женщин, готовившихся к ЭКО, с ТБ и ХЭ; вторая группа — 100 женщин с НБ в анамнезе и ХЭ.
В группе контроля из 90 пациенток из исследования исключили 7: у 2 (2,2%) были выявлены аномалии развития матки, у 5 (5,6%) отмечали эхографические признаки ХЭ.
Группу контроля в итоге составили 83 женщины, не имевшие тяжелых экстрагенитальных заболеваний и заболеваний репродуктивной системы.
У всех участниц было получено информированное согласие на проведение комплексного обследования и лечения.
В изучаемой когорте пациенток применен комплексный подход к диагностике ХЭ и заболеваний полости матки, включавший неинвазивное эхографическое исследование в сочетании с доплерометрической оценкой маточной гемодинамики, гистероскопию, морфологическое и иммуногистохимическое исследование образцов эндометрия, взятых на 7–11-й день менструального цикла путем вакуум-аспирации из полости матки, а также аспиратов эндометрия, полученных в ходе гистероскопии. При эхографии и гистероскопии были выделены три макротипа ХЭ: гиперпластическя, гипопластическая формы и ХЭ без гипер- и гипоплазии[9, 11].
Иммуногистохимическое окрашивание производили с использованием панели моноклональных антител, представленных в таблице 1, согласно протоколу с применением двухшаговой полимерной системы визуализации EnVision + Dual Link System-HRP (Dako Cytomation, Дания). Уровень экспрессии выражали полуколичественно («слабая», «умеренная», «выраженная») в соответствующем морфологическом элементе.
Таблица 1
Панель моноклональных специфических антител, использованных в исследовании
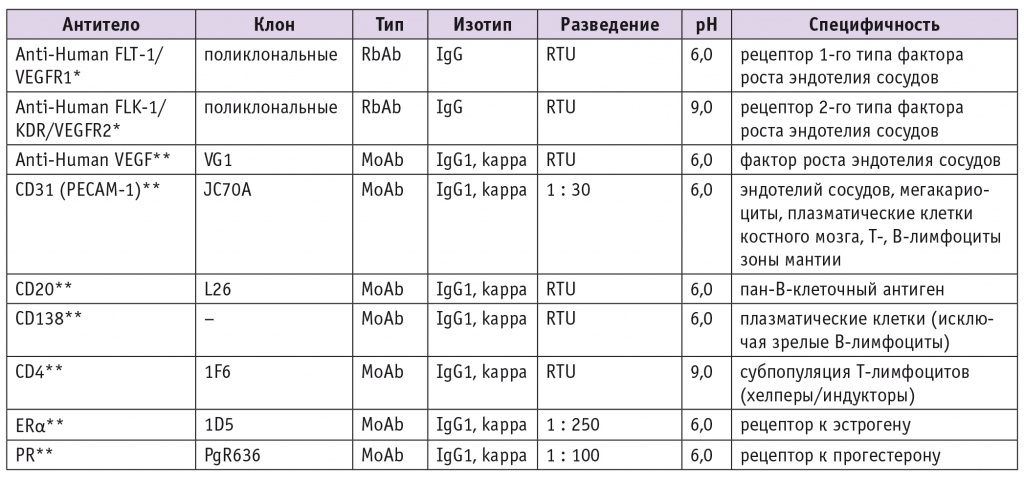
* Производитель — Spring Bioscience (США).
** Производитель — DAKO Cytomation (Дания).
Примечание. MoAb — мышиные моноклональные антитела, RbAb — кроличьи поликлональные антитела, RTU — раствор, готовый к использованию.
После прегравидарной подготовки в течение трех менструальных циклов были спланированы фертильные циклы.
Подготовка включала:
- удаление патологических образований эндометрия при гистероскопии под оптическим контролем; антибактериальное лечение по показаниям;
- назначение ЦОГ-2-селективных НПВП;
- коррекцию метаболических и иммунологических нарушений полимерным иммуномодулятором, действующим на фагоцитарное и гуморальное звенья иммунитета, с антиоксидантной активностью (свечи азоксимера бромида 12 мг интравагинально ежедневно в течение 10 дней);
- реабилитационную терапию антисептиками с учетом обсемененности генитального тракта патогенными инфектами;
- восстановление и сохранение нормальной микрофлоры влагалища (эубиотики Lactobacillus casei rhamnosus Doderleini в составе препаратов для перорального применения по 1 капсуле 1 раз сутки 7–14 дней или для влагалищного использования по 1 таблетке 7 дней);
- гормональную терапию (17β-эстрадиол 1–2–4 мг, дидрогестерон 20–40 мг),
- физиотерапию, магнитотерапию (ПОЛИМАГ, Россия).
Пациенткам первой группы проведены программа ЭКО и перенос эмбрионов с индукцией суперовуляции по короткому протоколу с применением рекомбинантного фолликулостимулирующего гормона (фоллитропина альфа) и антагониста ГнРГ цетрореликса. Эффективность прегравидарных оздоровительных мероприятий определяли по результатам программ ВРТ и естественных фертильных циклов.
Статистическую обработку полученных результатов проводили с помощью пакета стандартных программ Statistica for Windows 5.5. Использовали дескриптивную статистику, анализ связей и различий. Для оценки достоверности различий количественных признаков с распределением, близким к нормальному (по критерию Колмогорова — Смирнова), применяли критерии t Стьюдента и F Фишера, при анализе более двух групп — поправку Бонферрони для множественного сравнения, для ненормально распределенных величин — критерий U Манна — Уитни. Анализ сопряженности изучаемых признаков произведен с помощью критерия Пирсона с поправкой Йетса на численность. Различия считали статистически значимыми при p < 0,05.
Для оценки связей между признаками определяли коэффициент ранговой корреляции Спирмена. Для ряда факторов рассчитывали показатели ОР по Mantel — Haensel способом, принятым при эпидемиологических исследованиях по методу «случай — контроль».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Возраст обследованных женщин колебался от 19 до 42 лет. Средний возраст пациенток с ТБ составил 33,17 ± 0,42 года, с НБ — 31,95 ± 0,45 года (р < 0,05), контрольной группы — 28,30 ± 0,71 года (р < 0,001 для отличия от первой группы, р < 0,01 для отличия от второй). Доля женщин позднего репродуктивного возраста в исследованных группах — 39%, 22% и 4,8% соответственно. Значимые различия по возрасту женщин обследованных групп объясняются тем, что пациентки с ТБ и НБ имели отягощенный репродуктивный анамнез, бесплодие, потери беременности (самопроизвольные выкидыши, неразвивающиеся и внематочные беременности), переносили длительное лечение ВЗОМТ и хирургические вмешательства на органах репродуктивной системы.
В первой группе продолжительность бесплодия колебалась от 2 до 15 лет и в среднем к моменту проведения исследования и программ ВРТ составила 7,15 ± 0,44 года. Доля первичного бесплодия — 26,0%, вторичного — 74,0% (р < 0,001). У 33 (44,6%) пациенток с вторичным ТБ в анамнезе имели место срочные роды, эктопическая беременность была также у 44,6% женщин. Медицинские аборты перенесли 37 (50,0%) участниц с вторичным бесплодием. По поводу неразвивающейся беременности (8,1%) и самопроизвольного выкидыша (9,5%) женщинам с вторичным бесплодием было проведено выскабливание стенок полости матки.
Среди пациенток второй группы первичные потери беременности имели место у 58,0%, вторичное невынашивание — у 42,0%. Срочные роды ранее произошли у 42% женщин, преждевременные — у 14%. Частота неразвивающейся беременности составила 71,0%, превысив таковую в первой группе почти в 9 раз (р < 0,001). Самопроизвольный выкидыш наблюдался более чем в 5 раз чаще, его частота составила 51,0% (p < 0,001). Различий по частоте медицинских абортов не было (p > 0,05). Эктопическая беременность имела место в 5,0% случаев (p < 0,001).
У 18 (21,7%) женщин контрольной группы в анамнезе были первые физиологические роды, у 8 (9,6%) первая беременность была прервана медикаментозным абортом без осложнений, что не привело к развитию заболеваний репродуктивной системы. Среднее число беременностей на одну пациентку в группах составило 1,6 ± 0,020; 2,3 ± 0,020 и 0,3 ± 0,003 соответственно (p < 0,05 для отличий от первой группы, p < 0,001 для отличий от второй группы).
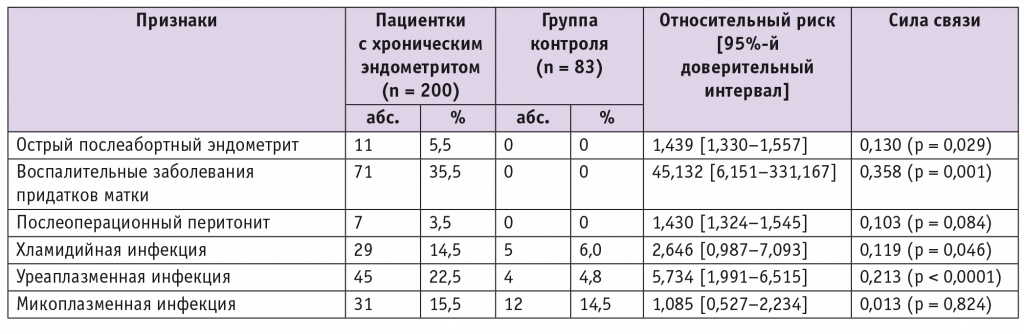
Анализ факторов риска развития ХЭ с определением ОР и силы связи был проведен в объединенной когорте пациенток первой и второй групп (табл. 2). Показано, что клинико-анамнестическими факторами риска развития ХЭ являются острый послеабортный эндометрит (ОР = 1,439) и послеоперационный перитонит, обусловленный осложнениями аппендэктомии (ОР = 1,430). В то же время ДИ с высокой вариабельностью значений и выявленная сила связи не показали значимого влияния воспалительных заболеваний придатков (ОР = 45,132; ДИ: 6,151–331,167) и хламидийной инфекции (ОР = 2,646; ДИ: 0,987–7,093) на возникновение ХЭ, но они явились значимыми факторами риска развития ТБ (ОР = 1,539; ДИ: 1,325-1,545). Полученные нами данные не отличались от ранее представленных исследований, изучавших вопросы эпидемиологии и структуры бесплодия и причины его развития[7, 9–11].
Таблица 2
Оценка риска развития хронического эндометрита при воспалительных заболеваниях органов малого таза у обследованных женщин
Анализ репродуктивных неудач как факторов риска ХЭ у женщин с ТБ и НБ показал значимый ОР при преждевременных родах в анамнезе (ОР = 1,44; р = 0,039), повторных абортах (ОР = 1,503; p < 0,001), самопроизвольном выкидыше (ОР = 1,572; р = 0,001), неразвивающейся беременности (ОР = 1,597; р = 0,001) (табл. 3). Результаты аналогичны данным ранее представленных работ, в которых авторы рассматривали неразвивающуюся беременность как проявление недиагностированного ХЭ[6, 10].
Таблица 3
Оценка факторов риска развития хронического эндометрита, связанных с репродуктивным анамнезом обследованных женщин
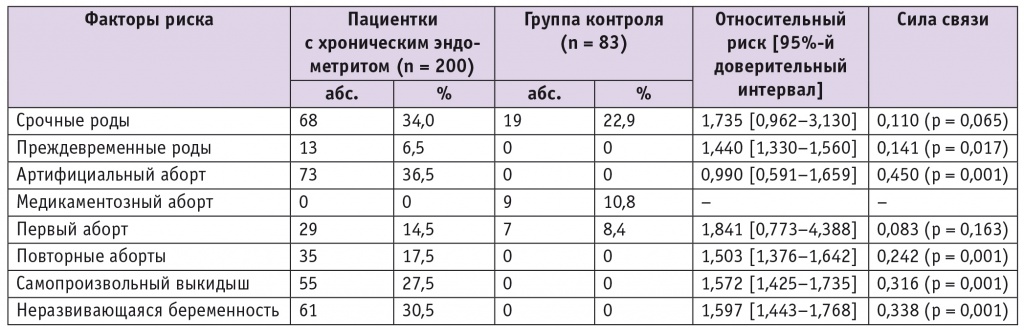
Примечание. Относительный риск не вычисляется, так как хронический эндометрит является константой b.
По результатам эхографии и гистероскопии была проведена стратификация по макротипам ХЭ. В группе с ТБ преобладающим явился гиперпластический макротип ХЭ (42,5%), при НБ — ХЭ без признаков гипер- и гипоплазии (58,2%). Для гипопластического макротипа были характерны очаговый фиброз эндометрия и внутриматочные синехии. По совокупности гистероскопических признаков диагноз ХЭ был правомочен у 80,0% пациенток с ТБ и у 81,1% с НБ.
Морфологическое подтверждение ХЭ в группах с репродуктивными неудачами показало ряд различий между пациентками с бесплодием и НБ. Совокупность известных морфологических критериев позволила констатировать, что в группе ТБ преобладала неполная морфологическая форма ХЭ (81,0%), в группе НБ — полная (68,0%) (p < 0,05). В группе контроля сочетаний признаков, характерных для ХЭ, не отмечено.
Корреляционный анализ показал, что независимо от макротипа между основными морфологическими признаками ХЭ существует корреляционная зависимость, при которой вслед за повышением уровня инфильтрации лимфоидными элементами стромы эндометрия формируется неблагоприятное микроокружение — фибротическая реакция стромы, обусловленная формирующимся профибротическим цитокиновым каскадом при ХЭ (выявлена умеренная положительная корреляция: r = 0,69; р < 0,05).
У пациенток с неполной морфологической формой ХЭ диагностическая ценность метода возрастает при иммуногистохимическом определении субпопуляций лимфоцитов эндометрия — плазматических клеток с фенотипом CD138, Т-лимфоцитов CD4, В-лимфоцитов CD20. Специфическим иммуногистохимическим признаком ХЭ в когортах женщин с ТБ и НБ явилось увеличение численной плотности данных субпопуляций лимфоцитов в множественных перигландулярных и периваскулярных лимфоплазмоцитарных воспалительных инфильтратах. Это несколько отличается от результатов ранее представленных исследований, в которых более детально рассмотрено влияние плазматических клеток на развитие ХЭ[14–17].
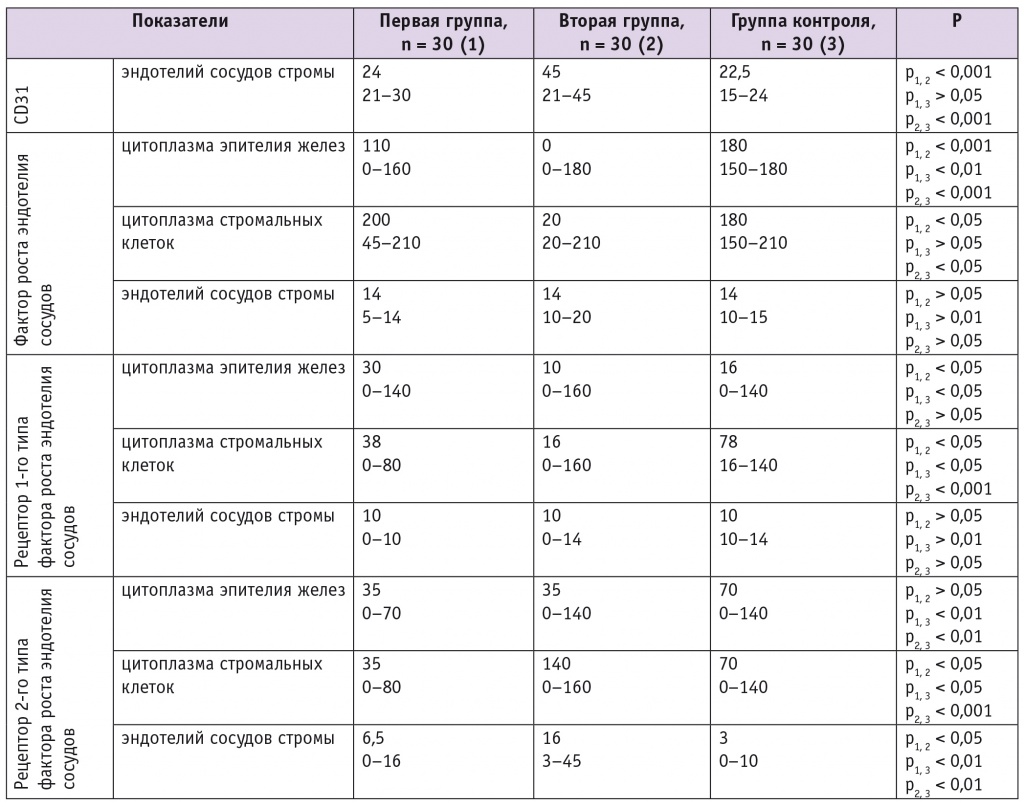
Показана роль дисбаланса уровня экспрессии фактора роста эндотелия сосудов (Vascular endothelial growth factor — VEGF) и его рецепторов 1-го и 2-го типов (VEGFR-1, VEGFR-2) в различных компонентах эндометрия и CD31 в эндотелии сосудов стромы эндометрия всех типов (артерии, вены, лимфатические сосуды) в формировании патологического эндометриального ангиогенеза (табл. 4):
- значительное снижение уровня экспрессии VEGF в цитоплазме эпителия желез и в цитоплазме стромальных клеток сопровождает склеротические изменения стенок спиральных артерий;
- повышение уровня экспрессии VEGFR-2 во всех компонентах эндометрия способствует формированию сосудов стромы, а низкий уровень экспрессии VEGFR-1 не обеспечивает ремоделирование сосудов и приводит к патологическому ангиогенезу в эндометрии;
- высокий уровень экспрессии CD31 при ХЭ вызывает выраженный ангиогенез в строме эндометрия.
Таблица 4
Иммуногистохимические показатели факторов ангиогенеза у обследованных пациенток на 7–11-й день менструального цикла (50-й процентиль, min — max)
Примечания.
- Первая группа — 100 женщин с трубной формой бесплодия (ТБ) и хроническим эндометритом (ХЭ), вторая группа — 100 женщин с невынашиванием беременности в анамнезе и ХЭ, группа контроля — 83 женщины, не имевшие нарушений репродуктивного здоровья.
- Иммуногистохимическое исследование проведено примерно у каждой третьей пациентки исследованных групп.
Корреляционный анализ между уровнями экспрессии VEGF и CD31, определяющими степень васкуляризации эндометрия, показал минимально выраженную положительную корреляцию в группе контроля. При ТБ выявлена значимая (p < 0,05) умеренная отрицательная корреляционная связь (r = –0,38) между уровнем экспрессии VEGF и степенью васкуляризации эндометрия CD31. В группе НБ между исследованными параметрами имела место более выраженная отрицательная корреляционная связь ( r = –0,82; р < 0,05).
Результаты корреляционного анализа позволяют предположить, что хронический воспалительный процесс в эндометрии оказывает альтеративное влияние на сосуды стромы, способствует снижению уровня экспрессии VEGF (пускового фактора ангиогенеза) и ограничивает развитие нормальной сосудистой сети в эндометрии пациенток с НБ и, в меньшей мере, у женщин с ТБ. В ряде ранее представленных работ показано влияние на ангиогенез эндометрия менее специфичного маркера эндотелия сосудов CD34[18–21].
Отличительной особенностью ХЭ при репродуктивных неудачах является несоответствие строения эндометрия стадии менструального цикла (дисхроноз пролиферации железистого эпителия), которое обнаруживали при ТБ в 66,0% случаев, при НБ — в 94,0% и у 20,0% пациенток группы контроля с медикаментозным прерыванием предшествующей беременности. Формирование данного морфологического признака обусловлено закономерными изменениями:
- умеренно выраженной отрицательной корреляционной связью (r = –0,4; p < 0,05) между уровнем экспрессии рецепторов к эстрогену желез и выраженностью лимфоплазмоцитарной инфильтрации эндометрия;
- общей тенденцией среди пациенток с ТБ и НБ — снижением уровня экспрессии рецепторов к эстрогену желез при нарастании степени инфильтрации эндометрия лимфоидными элементами, в том числе с плазмоцитоидными чертами дифференцировки, которые обеспечивают реализацию иммунного ответа по гуморальному типу.
Сопоставление уровня экспрессии рецепторов к эстрогену желез и степени фиброза стромы эндометрия позволило прояснить патологическую цепочку образования гипопластического макротипа ХЭ:
- корреляционный анализ показателей уровня экспрессии рецепторов к эстрогену желез и фиброза стромы эндометрия выявил умеренно выраженную отрицательную связь (r = –0,24; р < 0,05);
- нарастание фиброза стромы приводит к снижению уровня экспрессии рецепторов к эстрогену желез и к торможению процессов пролиферации эндометрия;
- полученные данные позволяют предположить, что посттравматическое фиброзирование стромы эндометрия более значимо влияет на снижение уровня экспрессии рецепторов к эстрогену желез, чем воспалительные инфильтраты.
На основании проведенного исследования нами представлена концептуальная модель формирования патологического процесса в эндометрии при хронизации воспаления (рис.).
Рис. Модель патогенеза хронического эндометрита при репродуктивных потерях
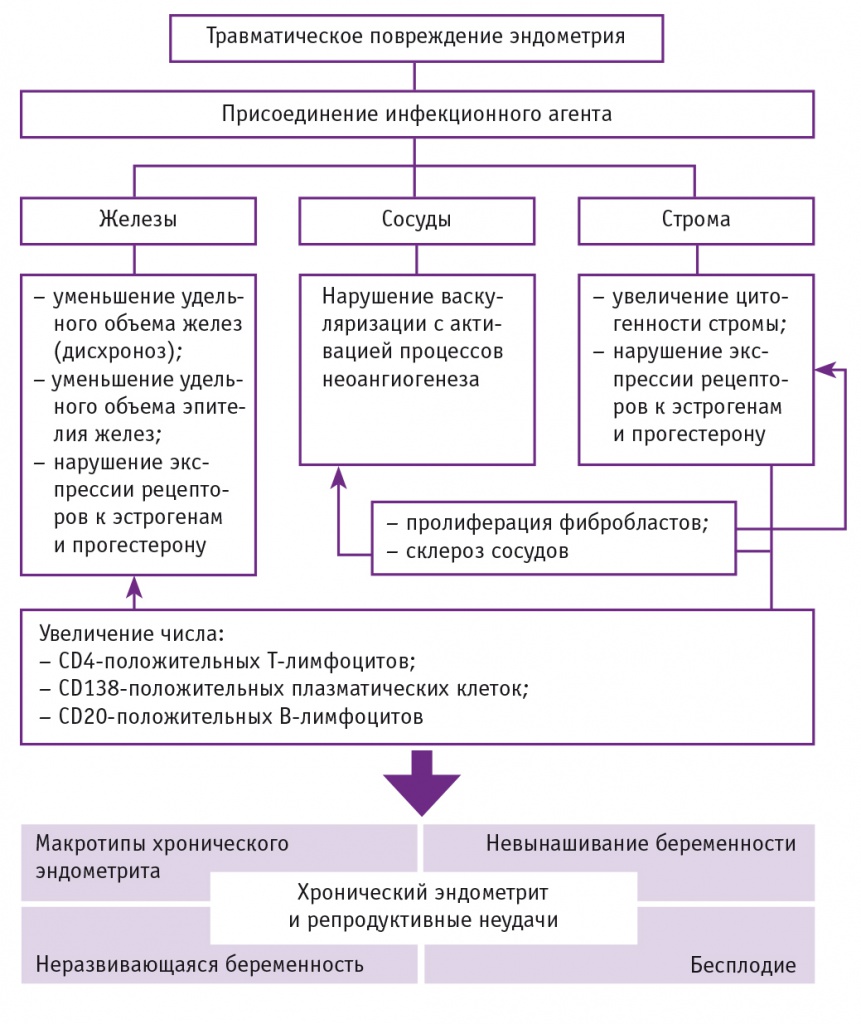
Полученные результаты позволили унифицировать и апробировать комплекс оздоровительных мероприятий в когортах пациенток с учетом репродуктивных неудач в преконцепционном периоде и с высокой эффективностью спланировать проведение программ ВРТ при ТБ и фертильных циклов после НБ. Частота наступления беременности на эмбриоперенос при определении уровня хорионического гонадотропина составила 48,0%, маточная беременность подтверждена у 46,0% женщин. У пациенток второй группы беременность наступила естественным путем в 97,0% наблюдений, в группе контроля — в 96,4%.
ЗАКЛЮЧЕНИЕ
Из представленного исследования можно заключить, что комплексный подход к диагностике хронического эндометрита (ХЭ) при репродуктивных неудачах должен быть основан на стратификации ХЭ по морфо- и макротипам в сочетании с иммуногистохимической детализацией рецептивности эндометрия.
Отличительной патогенетической особенностью ХЭ у женщин с трубным бесплодием (ТБ) и невынашиванием беременности (НБ) в анамнезе является несоответствие строения эндометрия стадии менструального цикла (дисхроноз пролиферации железистого эпителия). Формирование данного феномена обусловлено снижением уровня экспрессии рецепторов к эстрогену желез при нарастании уровня инфильтрации эндометрия лимфоидными элементами и процессов фиброзирования стромы. Ранняя гиперэкспрессия рецепторов к прогестерону желез и стромы эндометрия обуславливает нарушения механизмов нормальной пролиферации ткани и способствует развитию гиперпластических процессов. Нарастание цитогенности эндометрия запускает каскад структурных изменений в железистом, стромальном и сосудистом компонентах ткани. Нарушение рецептивности эндометрия связано со значительным снижением уровня экспрессии рецепторов к эстрогену в железах и ранней гиперэкспрессией рецепторов к прогестерону в железах и строме, что ведет к формированию дисхроноза эпителия желез и нарушает адгезивные способности ткани. Происходит фиброзирование стромы эндометрия и запускается сложная цепочка патологического ангиогенеза, что вызывает ишемию ткани и усугубляет процессы активации фибробластов, нарушает рецептивность эндометрия.
Полученные данные позволили расширить представления о патогенезе ХЭ у женщин с ТБ или НБ в анамнезе, оптимизировать систему лечебно-оздоровительных мероприятий на прегравидарном этапе, что способствовало реализации репродуктивной функции в исследованной когорте женщин.








