В связи со сложившейся в настоящее время угрозой депопуляции населения проблема охраны репродуктивного здоровья женщин детородного возраста выходит за традиционные рамки оценки ее актуальности[21]. Красной нитью сквозь эту проблему проходит аспект инфекционно-воспалительных заболеваний урогенитального тракта, неотъемлемой частью развития которых являются нарушения биоценоза влагалища — основной составляющей системы биологической противоинфекционной защиты гениталий[3, 7, 14, 23, 28].
К развитию дисбиотических сдвигов в составе влагалищной микрофлоры предрасполагают многочисленные факторы, в том числе доброкачественные болезни шейки матки, распространенность которых среди женщин детородного возраста достигает 15–20%[7, 17, 20, 25]. В свою очередь, нарушения биоценоза влагалища рассматривают как фактор риска развития и прогрессирования заболеваний шейки матки, поэтому необходимость их коррекции, в том числе с использованием деструктивных методов, у пациенток с доброкачественными болезнями шейки матки признана и одобрена учеными и клиницистами[2, 6, 9, 13]. Сам факт влияния ятрогенного повреждения эндо- и эктоцервикса на состояние микроэкосистемы влагалища не подлежит сомнению. Вместе с тем нарушение микробиоты влагалища служит одной из основных предпосылок к развитию осложнений после операций на половых органах[8, 13, 14]. Течение послеоперационного периода после манипуляций на шейке матки напрямую зависит от состояния влагалищного биотопа, определяющего защитный потенциал и репаративные возможности эпителия эндо- и эктоцервикса. Со своей стороны, деструкция шейки матки, транзиторная неполноценность эпителия, воспалительный процесс, обусловленный операционной травмой, могут повлечь за собой и отдаленные негативные последствия для микроэкосистемы влагалища.
Целью настоящего исследования явилось улучшение исходов деструктивного хирургического лечения доброкачественных болезней шейки матки.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было проведено в рамках основного направления научной деятельности кафедры акушерства и гинекологии с курсом перинатологии медицинского факультета Медицинского института Российского университета дружбы народов (РУДН) «Репродуктивное здоровье населения Московского мегаполиса и пути его улучшения в современных экологических и социально-экономических условиях» (номер государственной регистрации 01.9.70 007346, шифр темы 317712) в 2006–2011 гг. на базе женской консультации ГБУЗ «Городская поликлиника № 8» УЗ ЗАО г. Москвы (зав. женской консультацией — М. С. Устинова) и на клинических базах кафедры акушерства и гинекологии с курсом перинатологии медицинского факультета Медицинского института РУДН (зав. кафедрой — засл. деятель науки РФ, д. м. н., проф. В. Е. Радзинский) — в гинекологическом отделении ГКБ № 12 г. Москвы (зав. отделением — д. м. н., проф. В. Д. Петрова) и гинекологическом отделении № 40 ГКБ № 64 г. Москвы (зав. отделением — Л. А. Шеленина). В соответствии с существующими критериями описательно-оценочных методов медицинских исследований проведенное исследование было когортным проспективным[16].
Исследуемую группу составили 168 женщин, отобранных методом слепой рандомизации (каждая третья) из числа обследованных 411 пациенток репродуктивного возраста с доброкачественными заболеваниями шейки матки, соответствовавших критериям включения: возраст 18–45 лет; наличие доброкачественного невоспалительного заболевания шейки матки согласно МКБ-10 (N86 — эктропион шейки матки; N88.0 — лейкоплакия шейки матки; N88.1 — старые разрывы шейки матки; N88.4 — гипертрофия шейки матки; слабо выраженная (N87.0), умеренная (N87.1) и резко выраженная (N87.2) дисплазия шейки матки); наличие показаний к деструктивному лечению заболеваний шейки матки; согласие участвовать в исследовании. Критериями исключения были рак шейки матки, наличие абсолютных противопоказаний к деструктивному хирургическому лечению и несоблюдение рекомендаций врача.
В зависимости от метода деструкции шейки матки пациентки были стратифицированы на три группы: в первую вошли женщины, подвергшиеся радиоволновому воздействию (n = 63), во вторую — криодеструкции (n = 57), третью составили пациентки, которым производили диатермокоагуляцию или диатермоконизацию (ДЭК) шейки матки (n = 48). Эксцизию и конизацию выполняли при наличии аномальных кольпоскопических картин либо неблагоприятных результатов цитологического исследования. При возможности полноценного удаления всех кольпоскопически измененных тканей отдавали предпочтение эксцизии, вместе с тем конизация шейки матки в первой, второй и третьей группах была произведена соответственно у 66,7%, 63,2% и 68,8% пациенток (радиоволновая конизация — у 42 женщин, с применением метода криодеструкции — у 36, ДЭК — у 33).
Обследование женщин включало сбор анамнеза, общеклиническое и гинекологическое исследования, оценку биоценоза влагалища, состояния промежности и функции кишечника, расширенную кольпоскопию, цитологическое и морфологическое исследования.
Состояние биоценоза влагалища оценивали в динамике — до оперативного вмешательства, через месяц и через три месяца после деструкции шейки матки — по категориям: норма, носительство, бактериальный вагиноз (БВ) и вагинит. Интегральная оценка включала бактериоскопическое и бактериологическое исследования отделяемого влагалища с использованием стандартных методик и сред, определение pH влагалищного секрета с помощью индикаторной бумаги с диапазоном измерений 3,8–5,4 и 5,4–7,0 (артикул 1.09555.0003, Merck), обследование на урогенитальную инфекцию и ИППП методом ПЦР. Определяли наличие Lactobacillus spp., Gardnerella vaginalis, Prevotellа bivia, Streptococcus spp., Veillonella spp., Mobiluncus curtisii, Fusobacterium spp., Chlamydia trachomatis, Trichomonas vaginalis, Neisseria gonorrhoeae, Mycoplasma hominis, Ureaplasma urealyticum, Herpes simplex virus 1-го и 2-го типа, Cytomegalovirus, Human papillomavirus (HPV) 6, 11, 16, 18, 31, 42, 43-го серотипов.
За норму принимали отсутствие жалоб, микроскопически — наличие клеток плоского эпителия и лактобактерий, лейкоцитов не более 10 в п/зр, pH в пределах 4,0–4,5, концентрацию условно-патогенных микроорганизмов (УПМ) не выше 105–106 КОЕ/мл, содержание лактобактерий 107 КОЕ/мл и более. При выявлении УПМ, уреамикоплазм или грибов в концентрациях, превосходивших физиологические, и при отсутствии критериев БВ и воспалительной реакции констатировали носительство микроорганизмов. Диагноз БВ выставляли при отсутствии клинико-лабораторных признаков воспаления и наличии трех или четырех из следующих критериев: обильные прозрачные и гомогенные выделения, часто с неприятным запахом, покрывающие всю слизистую влагалища и шейки матки, легко удаляемые тампоном; pH более 4,5; обнаружение при микроскопии ключевых клеток; положительный аминный тест[11, 25]. Вагинит диагностировали на основании жалоб на патологические бели и другие симптомы воспаления, а также учитывая микроскопические признаки в отделяемом влагалища: эпителиальных клеток мало; содержание лактобактерий менее 106 КОЕ/мл, вплоть до полного отсутствия; лейкоцитов от 30–40 до сплошь в п/зр; pH в пределах 5,6–6,5; концентрация УПМ выше 107 КОЕ/мл.
При выявлении БВ или вагинита пациенткам проводили предоперационную подготовку и лечение в послеоперационном периоде. С учетом показаний в соответствии с Реестром лекарственных средств России для предоперационной коррекции нарушений биоценоза влагалища использовали хлоргексидина биглюконат (Гексикон, суппозитории вагинальные, ОАО «Нижфарм», Россия) по 1 суппозиторию интравагинально 2 раза в сутки в течение 10 дней, при необходимости курс лечения продлевали до 14 дней. Для профилактики нарушений биоценоза и коррекции выявленных нарушений с 15-го дня после деструктивного вмешательства с учетом наличия дополнительного метаболического и регенерирующего действия применяли комбинированный препарат хлоргексидина биглюконат + декспантенол (Депантол, суппозитории вагинальные, ОАО «Нижфарм», Россия) по 1 суппозиторию интравагинально 2 раза в сутки в течение 10 дней.
По окончании лечения антимикробным препаратом определяли pH влагалищной среды, при уровне выше 4,5 в целях его нормализации использовали аскорбиновую кислоту для интравагинального введения (Вагинорм-С®, таблетки вагинальные, «Артезан Фарма ГмбХ и Ко.КГ», Германия) по 1 вагинальной таблетке 1 раз в сутки на ночь в течение 6 дней.
Расширенную кольпоскопию выполняли по общепринятой методике[18] при 12, 16, 25-кратном увеличении с применением кольпоскопа Opton (Германия). При оценке кольпоскопической картины использовали Международную классификацию кольпоскопических терминов (VII Всемирный конгресс по патологии шейки матки и кольпоскопии, Рим, 1990), в которой выделены нормальные и аномальные кольпоскопические образования.
Цитологическое исследование соскобов с поверхности шейки матки и из цервикального канала производили с помощью щетки Endobrush. Для оценки результатов использовали описательную систему характеристики мазков и классифицировали их по методу Папаниколау (PAP-smear test).
Морфологические исследования были проведены по общепринятым методикам, гистологическому исследованию подвергали ткани шейки матки, взятые посредством прицельной биопсии, эксцизии, конизации, а также материал, полученный в результате кюретажа цервикального канала.
Для статистической обработки результатов исследования в качестве основного программного обеспечения применяли пакет прикладных программ Statistica 6.0 фирмы StatSoft Inc. (США). Значимость различий оценивали с помощью непараметрических критериев Вилкоксона — Манна — Уитни для несвязанных совокупностей и методами вариационной статистики с использованием критериев Стьюдента (t) и χ2, различие между величинами признавали статистически значимым при p < 0,05 (t > 2,0). Для корреляционного анализа применяли методы Пирсона и Спирмена, при абсолютном значении коэффициента корреляции r ≥ 0,75 связь оценивали как сильную, при 0,25 < r < 0,75 — как умеренную, при r ≤ 0,25 — как слабую. Для выявления факторов риска формирования нарушений биоценоза влагалища и предикторов развития БВ и вагинита после деструкции шейки матки использовали логистический регрессионный анализ. На первом этапе исследовали вероятность отсутствия ассоциации каждого фактора с событием (БВ и вагинитом). При p < 0,05 принимали гипотезу о значимости фактора для изучаемого бинарного события. Независимые предикторы вычисляли с помощью критерия χ2[16].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные в ходе настоящего исследования результаты подтвердили точку зрения большинства авторов, считающих, что доброкачественные заболевания шейки матки характерны для молодых женщин[2, 5]. Средний возраст 168 обследованных пациенток составил 34,4 ± 8,2 года и не различался в группах (р > 0,1).
Средний возраст сексуального дебюта женщин исследуемой когорты составил 17,9 ± 3,9 года (р > 0,1) и варьировал во всех группах от 14 до 27 лет.
Аборты в анамнезе отмечены у 64,3% пациенток (р1–2, 1–3 < 0,1; р2–3 > 0,1), в том числе у 35,2% — неоднократные (р1–2, 1–3 < 0,1; р2–3 > 0,1), каждая пятая женщина (20,2%) перенесла три аборта и более (р > 0,1). У 5,4% женщин ранее были самопроизвольные выкидыши, 2,4% страдали привычным невынашиванием беременности (р > 0,1). Роды в анамнезе отмечены у 88,1% пациенток (р > 0,1), в том числе у 72,0% — осложненные (р1–2, 1–3 < 0,1; р2–3 > 0,1). У каждой десятой пациентки (11,5%) родоразрешение было несвоевременным (р > 0,1): у 8,1% имели место преждевременные роды, у 3,4% — переношенная беременность (р1–2, 1–3 < 0,1; р2–3 > 0,1). Акушерские травмы промежности перенесли 28,6% женщин (р1–2, 1–3 < 0,1; р2–3 > 0,1), в том числе 14,3% — разрыв промежности 2-й степени (р1–2, 2–3 > 0,1; р1–3 < 0,1). Разрывы шейки матки в родах отмечены у 44,0% пациенток (р1–2, 2–3 > 0,1; р1–3 < 0,1), причем у половины из них (23,2%) — 2-й степени (17,2%) и 3-й степени (6,0%) (р1–2, 1–3 < 0,1; р2–3 < 0,05). Операции и оперативные пособия в родах (акушерские щипцы, ручное обследование полости матки) в анамнезе выявлены у 11,3% пациенток (р > 0,1), каждой пятой женщине (22,6%) в родах производили перинеотомию, эпизиотомию (р1–2, 1–3, 2–3 < 0,1). У 5,4% рожавших женщин были роды крупным плодом (р > 0,1).
Использовали контрацепцию лишь 63,2% пациенток (р < 0,1), в том числе презерватив — 45,8% (р1–2, 1–3 < 0,1; р2–3 > 0,1), доля внутриматочных и гормональных контрацептивов оказалась одинаковой (соответственно 7,2% и 7,2%), спермициды применяли 3,0% (р > 0,1).
Наличие вредных привычек выявлено у 45,2% женщин (р1–2, 1–3 < 0,1; р2–3 > 0,1), преимущественно табакокурение (44,0%; р1–2, 1–3 < 0,1; р2–3 > 0,1), негативное влияние которого на заболевания шейки матки, особенно ассоциированные с HPV-инфекцией, активно обсуждается[5, 27].
Хронические экстрагенитальные заболевания (ХЭГЗ) отмечены у 97,0% пациенток (р1–2, 1–3 < 0,1; р2–3 > 0,1), их распространенность в изучаемой когорте составила 1747,2‰ (по группам: 1713,4‰, 1778,2‰ и 1749,4‰; р1–2, 1–3, 2–3 < 0,1). В структуре ХЭГЗ (р1–2, 2–3 < 0,1; р1–3 > 0,1) лидировали классы болезней органов и систем, обеспечивающих функциональную активность репродуктивной системы: органов пищеварения — 17,4% (р1–2, 1–3 < 0,1; р2–3 > 0,1); эндокринной системы, нарушения питания и обмена веществ — 16,9% (р1–2, 1–3, 2–3 > 0,1); органов дыхания — 15,3% (р1–2 < 0,1; р1–3, 2–3 > 0,1); системы кровообращения — 15,3% (р > 0,1); мочевыделительной системы — 10,1% (р1–2, 2–3 > 0,1; р1–3 < 0,1). ХЭГЗ, протекающие с развитием иммунной дисфункции и формированием очагов латентной инфекции (хронический тонзиллит, хронический гайморит, хронический пиелонефрит, хронический энтероколит, аллергические заболевания, анемия), выявлены у каждой третьей женщины во всех группах (34,5%, р > 0,1), что созвучно данным ряда исследований[1, 24, 26].
Жалобы на запоры предъявляли 53,0% пациенток исследуемой группы (р > 0,1), при этом у каждой третьей женщины (36,3%; р1–2, 1–3 < 0,1; р2–3 > 0,1) запоры носили хронический характер. У 32,1% пациенток (р > 0,1) в анамнезе имелись указания на верифицированный дисбактериоз кишечника.
Гинекологические болезни отмечены у всех обследованных женщин (100,0%), их распространенность составила 1428,9‰ (по группам: 1413,7‰, 1452,4‰ и 1419,6‰; р1–2, 1–3, 2–3 < 0,1), при этом на каждую пациентку в среднем приходилось по 2,1 заболевания. В структуре сопутствующих гинекологических болезней преобладали расстройства менструации (24,3%, р1–2, 1–3, 2–3 > 0,1), миома матки (17,5%; р1–2, 1–3 < 0,1; р2–3 > 0,1), сальпингит, оофорит (10,7%, р1–2, 1–3, 2–3 > 0,1) и пролапс гениталий (10,7%, р1–2, 1–3, 2–3 < 0,1). Объективные признаки несостоятельности мышц промежности и тазового дна (снижение тонуса мышц, зияние половой щели, уменьшение длины передней промежности) выявлены у 17,3% пациенток без различия по группам (р < 0,1).
Расстройства менструации имели место у 38,1% женщин, при этом преобладали обильные нерегулярные менструации (р1–2 > 0,1; р1–3, 2–3 < 0,1) и дисменорея (14,9%, р1–2, 1–3, 2–3 > 0,1), что созвучно данным аналогичных исследований[6, 8].
Обращает на себя внимание высокая частота в анамнезе перенесенных пациентками полостных операций на органах брюшной полости и малого таза (32,1%, р > 0,1), что может способствовать формированию вторичной дисфункции тазовых органов, в том числе кишечника; при этом каждая третья из таких операций (13,1%; р1–2 > 0,1; р1–3, 2–3 < 0,1) была проведена на половых органах, преимущественно на придатках матки.
Выявлено, что 95,3% пациенток имели в анамнезе доброкачественные болезни шейки матки (в группах: 95,2%, 94,7% и 95,8%; р > 0,1), по поводу которых они получали лечение, в том числе деструктивное. Подобный факт отмечают многие авторы[4, 8]. Среди доброкачественных заболеваний шейки матки в анамнезе преобладали воспалительные болезни шейки матки (43,8%, р > 0,1), рубцовая деформация (20,0%, р > 0,1) и гипертрофия шейки матки (20,0%, р > 0,1), реже отмечены дисплазия (10,6%; р1–2 > 0,1; р1–3, 2–3 < 0,1) и лейкоплакия шейки матки (9,1%, р > 0,1). По поводу всех перечисленных заболеваний 50,0% женщин ранее подвергались деструктивному воздействию (р > 0,1), в том числе у 23,2% пациенток производили ДЭК, у 26,2% — радиоволновую эксцизию, у 3,0% — криодеструкцию, у 1,8% — лазерокоагуляцию, у 1,8% — химическую деструкцию.
Перенесенные сексуально-трансмиссивные инфекции, в том числе ИППП, выявлены в анамнезе у 32,1% женщин исследуемой когорты (р > 0,1), наиболее часто отмечены хламидийная (17,3%) и HPV-инфекция (16,1%), что не противоречит данным других исследователей[4, 6–8].
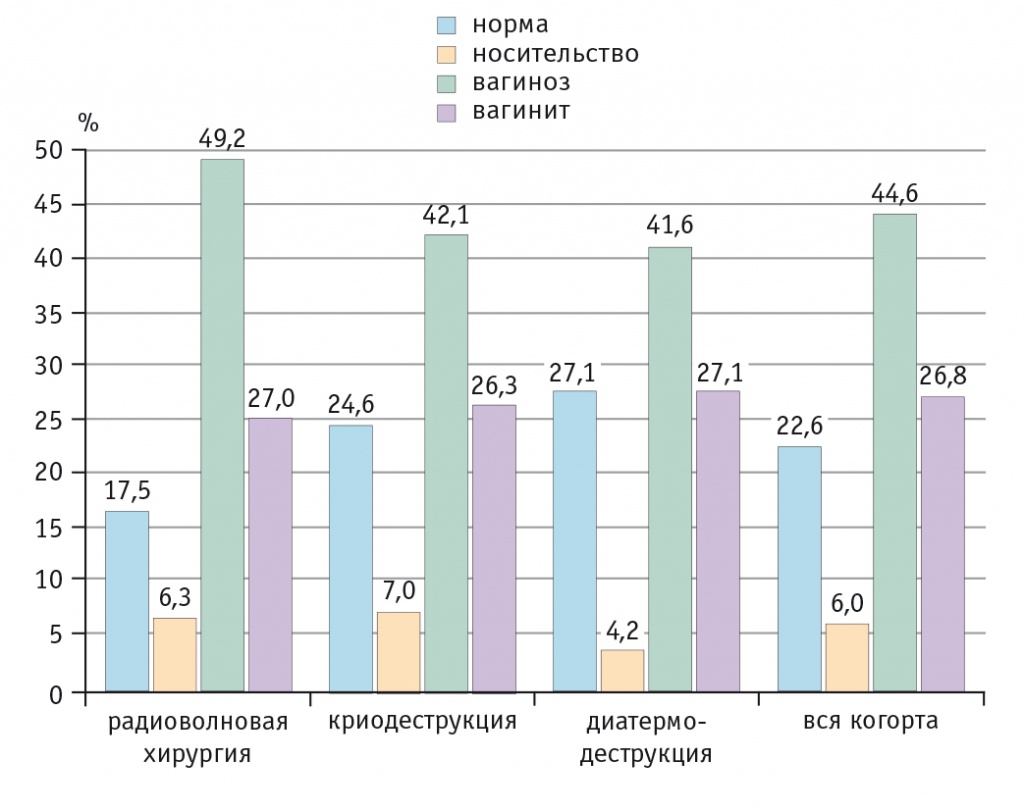
Комплексная оценка биоценоза влагалища до деструктивного лечения шейки матки (рис. 1) позволила установить, что для женщин, страдающих невоспалительными доброкачественными болезнями шейки матки, характерна высокая частота его нарушений (77,4%), в том числе вагиноза (44,6%) и вагинита (26,8%).
Рис. 1. Биоценоз влагалища у женщин исследуемой когорты до медикаментозной коррекции и до начала деструктивного лечения шейки матки, %
На момент исследования урогенитальные инфекции были выявлены у 41,9% женщин изучаемой когорты, в том числе HPV (16, 18, 31-й серотипы) — у 20,0%, кандидоз — у 16,7%, уреамикоплазменная инфекция — у 6,7%, герпетическая — у 10,0%. Различий между группами не получено (p > 0,1).
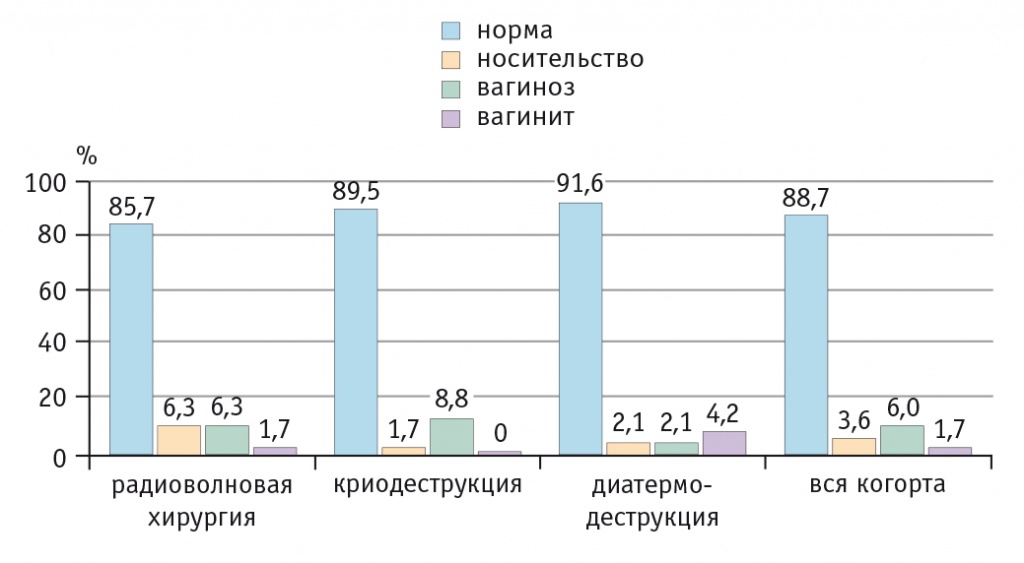
После поэтапной терапии хлоргексидином и аскорбиновой кислотой интравагинально пациентки жалоб не предъявляли, доля женщин с нормоценозом в исследуемой когорте возросла в 3,9 раза (р < 0,01), удельный вес дисбиотических состояний снизился в 5,3 раза (р < 0,01), вагинита — в 15,8 раза (р < 0,01) (рис. 2). Динамика во всех группах была сопоставимой (р > 0,1), пациенткам с вагинитом курс лечения был продлен до 14 дней.
Рис. 2. Биоценоз влагалища у женщин исследуемой когорты после медикаментозной коррекции до начала деструктивного лечения шейки матки, %
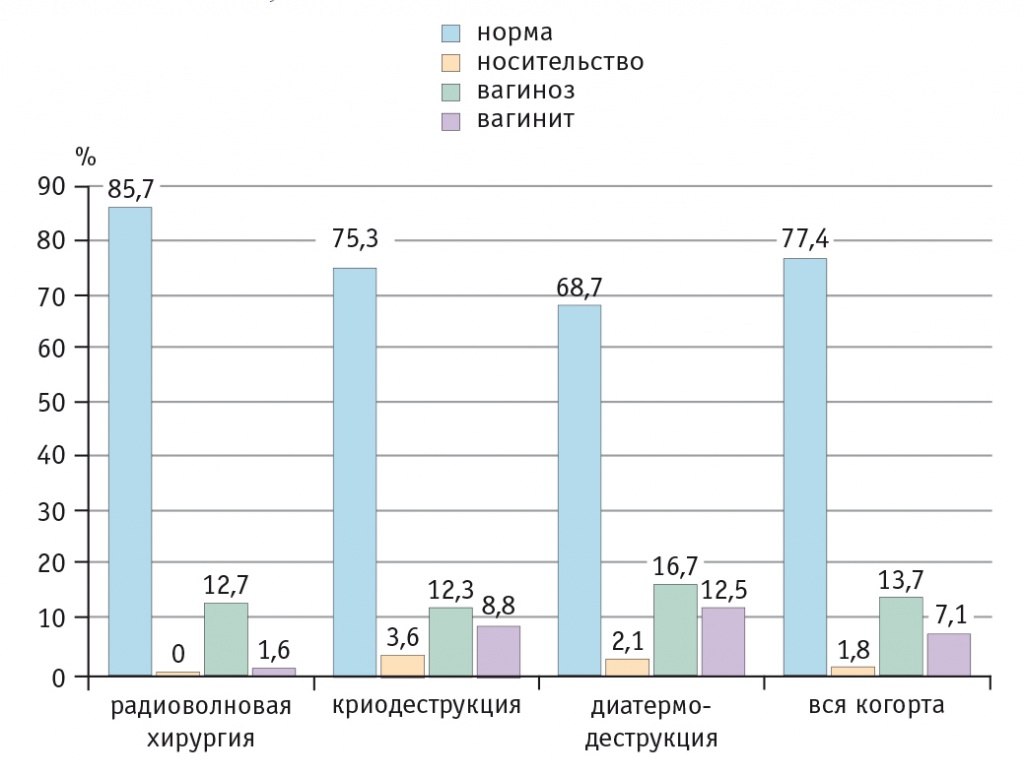
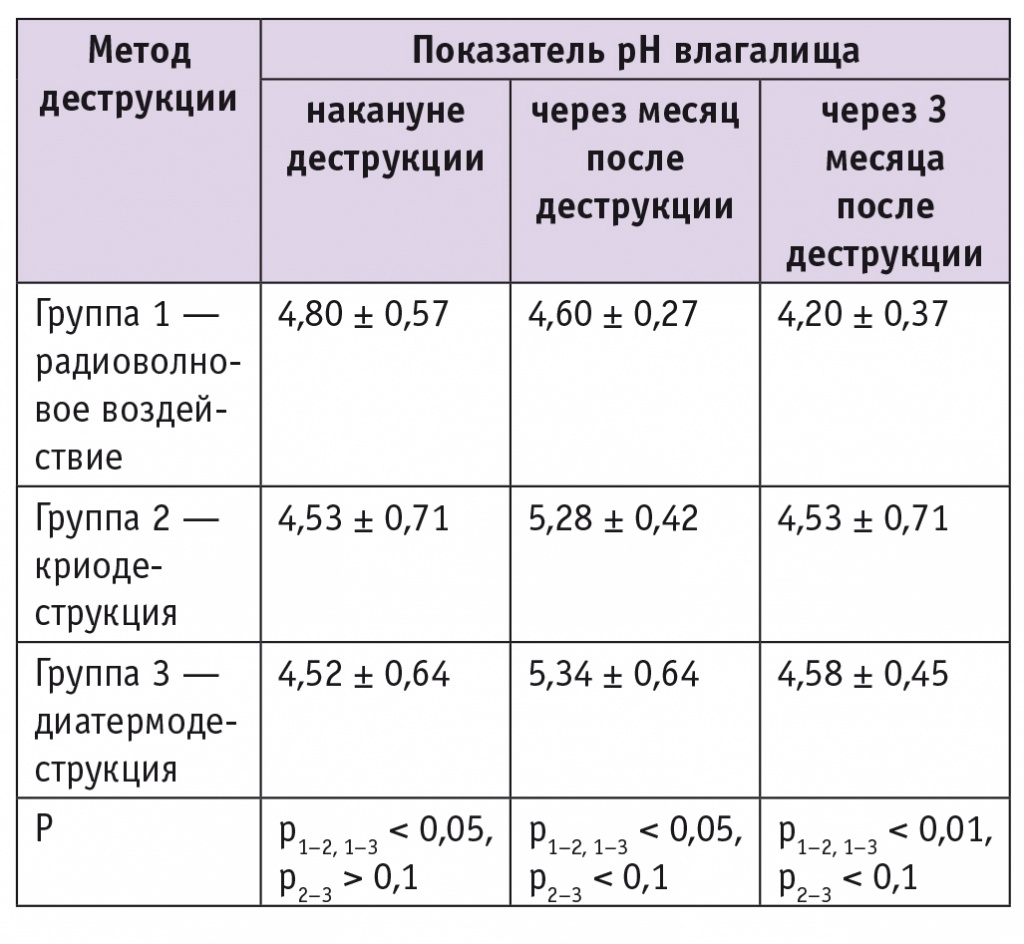
Полученные в ходе исследования результаты позволяют констатировать преимущества радиоволнового метода лечения в отношении влияния на биоценоз влагалища. Через месяц после деструктивного вмешательства нарушения биоценоза имели место у каждой пятой пациентки (22,6%) (рис. 3). При этом выявлено различие между группами женщин, перенесших радиоволновую деструкцию и ДЭК, по доле лиц с нормоценозом (р1–3 < 0,05; р1–2, 2–3 > 0,1) и вагинитом (р1–3 < 0,05; р1–2, 2–3 > 0,1).
Рис. 3. Биоценоз влагалища у женщин исследуемой когорты через месяц после деструктивного лечения шейки матки, %
Мы согласны с мнением целого ряда исследователей[4, 6, 8, 19, 22], что предпосылки к этому, по всей видимости, создаются особенностями заживления операционной раны при радиоволновом воздействии на ткани шейки матки, которое происходит под фибриновой пленкой, отторгающейся на 8–14-е сутки и сопровождается незначительными кровянистыми или сукровичными выделениями. Уже к 4–5-му дню послеоперационного периода под пленкой начинается эпителизация, которая к 4-й неделе после деструкции практически завершается. Включение в комплекс реабилитационных мер с 15-го дня местно комбинированного препарата хлоргексидина биглюконат + декспантенол, обладающего, помимо антисептического, метаболическим и регенерирующим действием, у пациенток после радиоволновой деструкции является максимально физиологичным, что не противоречит результатам многочисленных исследований[12, 15]. Нормализация pH влагалищной среды по окончании его применения путем использования таблеток аскорбиновой кислоты для интравагинального введения усиливает регенераторный потенциал слизистой влагалища, что отмечают многие авторы (рис. 4)[10, 25, 29].
Рис. 4. Биоценоз влагалища у женщин исследуемой когорты через 3 месяца после деструктивного лечения шейки матки, %
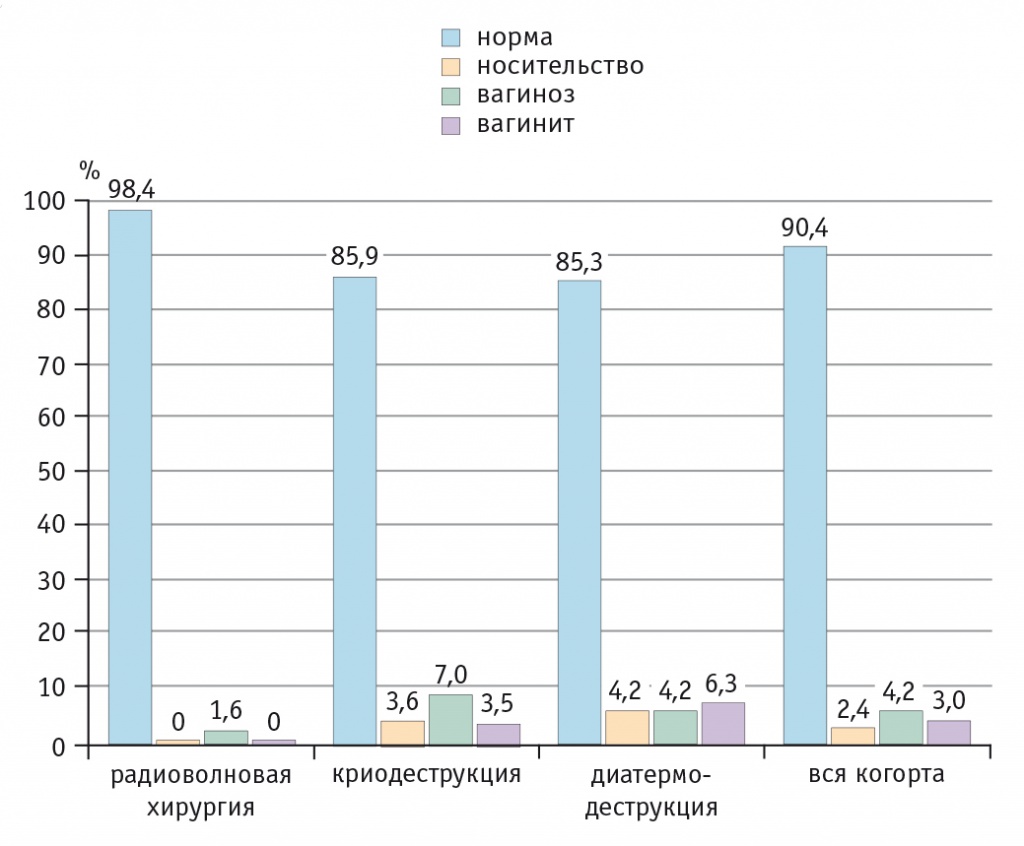
В результате через 3 месяца после деструкции шейки матки и завершения комплексной реабилитационной терапии удельный вес лиц с нарушениями биоценоза в сравнении с обследованием через месяц снизился более чем вдвое (до 9,6%, р < 0,05). При этом сохранилось различие между группой женщин, перенесших радиоволновую деструкцию, и другими группами по доле лиц с нормоценозом (р1–2, 1–3 < 0,05; р2–3 > 0,1).
Средний уровень pH влагалищного секрета до выполнения деструкции шейки матки составил 4,6 ± 0,72 и был выше в группе пациенток, перенесших радиоволновую деструкцию шейки матки. Как видно из данных, представленных в таблице, в этой группе уровень pH влагалища плавно снижался в динамике и статистически значимо различался по всем трем позициям (р < 0,01), что свидетельствовало об эффективности реабилитационной терапии.
Таблица
Динамика pH-метрии секрета влагалища до и после деструкции шейки матки (M ± m)
Вместе с тем в группах женщин, подвергшихся криодеструкции и ДЭК, несмотря на проведение соответствующейтерапии, имела место схожая негативная динамика — повышение уровня pH через месяц после деструкции, — что создавало предпосылки к развитию дисбиотических состояний. По-видимому, основное препятствие к нормализации pH и биоценоза — выраженность операционной травмы эпителия шейки матки.
Комплексное микробиологическое исследование показало, что доминирующими в микрофлоре влагалища у па-
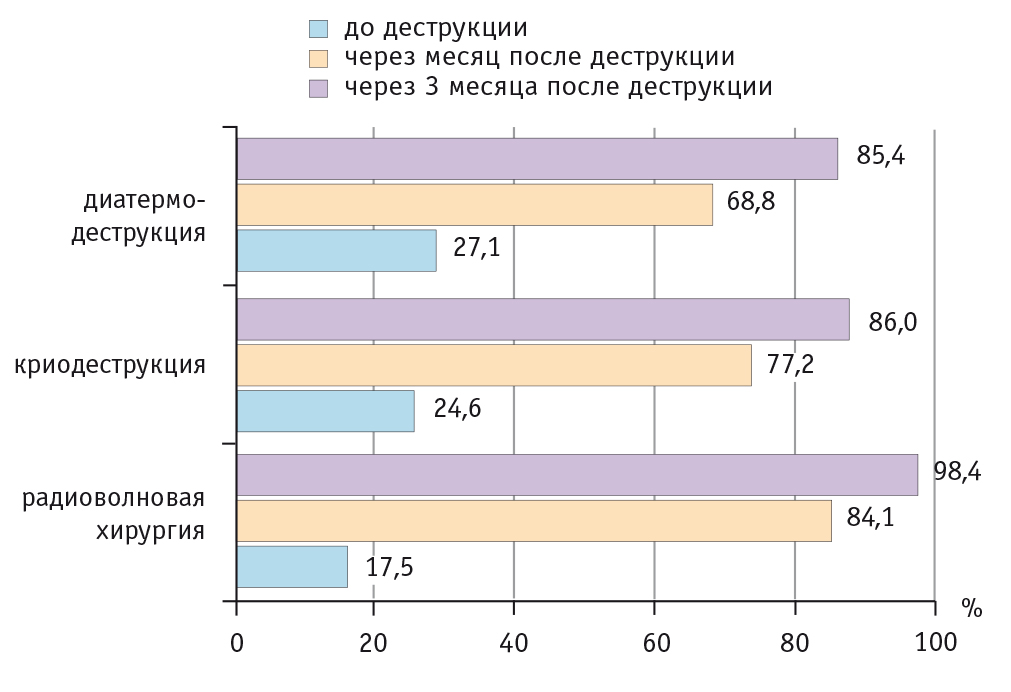
циенток изучаемой когорты перед деструкцией являются лактофлора и УПМ. В динамике изменение концентрации Lactobacillus spp. в титрах менее 107 КОЕ/мл и более — основного маркера нормоценоза влагалища — во всех группах носило сходный характер и демонстрировало рост после выполненной деструкции. Такой факт подчеркивают и другие авторы [8]. На наш взгляд, этому способствовала и антимикробная терапия. Положительная динамика была более выраженной в группе пациенток, перенесших радиоволновую деструкцию (рис. 5).
Рис. 5. Выделение Lactobacillus spp. в титрах < 107 КОЕ/мл и более у женщин исследуемой когорты до и после деструкции, %
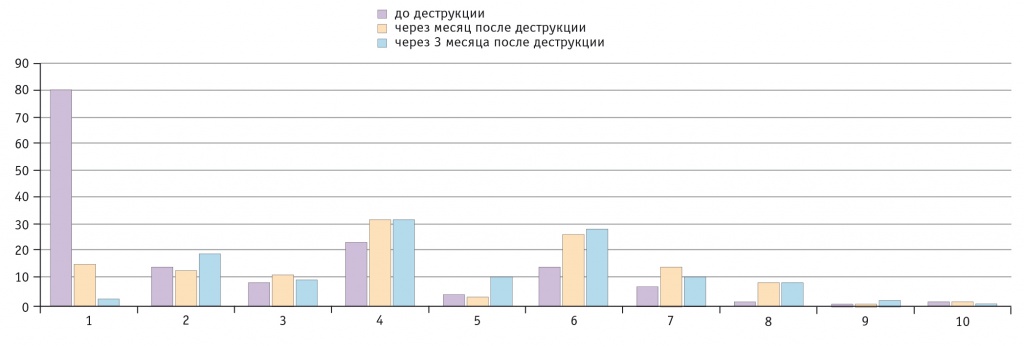
После деструкции шейки матки отмечалась тенденция к возрастанию бактериальной контаминации влагалища от 104–105 до 106–107 КОЕ/мл (рис. 6). При этом появились микроорганизмы, которые до вмешательства в высоких титрах не определялись (преимущественно кишечная микрофлора: Escherichia coli, Enterococcus faecalis, Streptococcus spp., Candida albicans, Klebsiella spp.).
Рис. 6. Суммарная обсемененность влагалища у женщин исследуемой когорты до и после деструкции (содержание в титрах > 103 КОЕ/мл по данным бактериологического исследования).
Примечание. 1 — Lactobacillus spp. (107 КОЕ/мл); 2 — Staphylococcus epidermidis; 3 — Streptococcus spp.; 4 — Enterococcus faecalis; 5 — Enterobacter; 6 — Escherichia coli; 7 — Candida albicans; 8 — Klebsiella spp.; 9 — Citrobacter; 10 — Proteus mirabilis
На основании полученных данных можно предположить наличие патогенетической связи между развитием нарушений биоценоза влагалища после деструкции шейки матки, функций кишечника и состоянием промежности. В ходе поиска такой взаимосвязи установлена корреляция между нарушениями биоценоза и несостоятельностью мышц промежности и тазового дна (r = 0,74). Проведенный анализ показал, что нарушение анатомии промежности, зияние половой щели и пролапс тазовых органов у женщин изучаемой когорты являются факторами риска развития БВ после деструкции независимо от ее метода (через месяц — 53,7%, р < 0,05; через 3 месяца — 71,4%, р < 0,05). При сочетании хронических запоров и дисбактериоза кишечника независимо от метода деструкции шейки матки имеет место почти прямая корреляция (r = 0,89) с возникновением вагинита (до деструкции — 95,6%, после нее — 100,0%, р < 0,01).
Полученные данные нашли свое подтверждение и в результате логистического регрессионного анализа. Установлено влияние на развитие БВ и вагинита после деструкции шейки матки таких факторов, как нарушение состоятельности мышц промежности и тазового дна (p = 4,98%), курение (р = 4,49%), метод деструктивного вмешательства (p = 1,0%), хронические запоры на фоне дисбактериоза кишечника (p = 0,01%), наличие урогенитальной инфекции и/или ИППП (p = 1,96%), HPV-инфекции (p = 0,35%); нарушения биоценоза влагалища накануне деструкции (p = 5,0%), аборты в анамнезе (p = 4,07%). Независимыми предикторами развития БВ и вагинита после деструкции шейки матки оказались несостоятельность мышц промежности и тазового дна (χ2 = 3,86), метод деструктивного вмешательства (χ2 = 6,64), хронические запоры на фоне дисбактериоза кишечника (χ2 = 16,35), курение (χ2 = 8,15), HPV-инфекция (χ2 = 8,51), наличие БВ или вагинита до деструкции шейки матки (χ2 = 3,81), аборты в анамнезе (χ2 = 6,04).
ЗАКЛЮЧЕНИЕ
Полученные результаты подтверждают существующие представления о том, что для пациенток с доброкачественными болезнями шейки матки характерна высокая частота сопутствующих нарушений биоценоза влагалища, в том числе бактериального вагиноза и вагинита, частота которых, по нашим данным, составила 44,6% и 26,8% соответственно.
В основе нарушений влагалищного биотопа после деструктивного лечения доброкачественных болезней шейки матки лежит контаминация микрофлорой кишечника в условиях повышения pH влагалища, степень выраженности которой коррелирует с вероятностью развития воспалительных осложнений в послеоперационном периоде (r = 0,68). Изменения биоценоза влагалища после деструктивного лечения шейки матки зависят от метода деструкции (r = 0,81). Самая благоприятная динамика наблюдается при использовании радиоволнового метода, когда стабильно сохраняется максимальная доля лиц с нормоценозом (85,7% через месяц, р1–3 < 0,05; 98,4% через 3 месяца, р1–2, 1–3 < 0,05), pH колеблется в пределах 4,1–4,8, бактериальный вагиноз выявляется не более чем у 12,7% женщин, вагинит — у 1,6%, в то время как после криодеструкции и диатермодеструкции на фоне повышения pH влагалища до 4,8–5,7 бактериальный вагиноз отмечается у 12,3% и 16,7% пациенток соответственно, вагинит — у 8,8% и 12,5%. Схожее влияние методов криодеструкции и диатермоконизации (ДЭК) на биоценоз влагалища реализуется через идентичные изменения pH влагалищной среды.
Нарушение анатомии и функциональной состоятельности промежности и тазового дна у женщин с доброкачественными заболеваниями шейки матки, требующими деструктивного лечения, независимо от его метода является фактором высокого риска (r = 0,74) развития бактериального вагиноза после деструкции (53,7–71,4%, р < 0,05), нарушение функции кишечника — фактором высокого риска развития вагинита (95,6–100,0%, р < 0,01). Негативное влияние этих факторов возрастает при использовании криодеструкции (р1–2, 1–3 < 0,05; р2–3 > 0,1) и ДЭК (р1–2, 1–3 < 0,01).
Предикторами нарушений биоценоза у женщин с доброкачественными болезнями шейки матки, требующими деструктивного лечения, служат метод деструкции (χ2 = 6,64), нарушение состоятельности мышц промежности и тазового дна (χ2 = 3,86), курение (χ2 = 8,15), HPV-инфекция (χ2 = 8,51), наличие нарушений биоценоза влагалища накануне деструкции (χ2 = 3,81), аборты в анамнезе (χ2 = 6,04), хронические запоры на фоне дисбактериоза кишечника (χ2 = 16,35).
Обязательным компонентом коррекции нарушений биоценоза до и после деструкции шейки матки является нормализация pH влагалищного секрета. Последовательная терапия хлоргексидином и аскорбиновой кислотой интравагинально (Вагинорм-С) позволяет восстановить нормоценоз на этапе предоперационной подготовки у 85,4% женщин. Последовательное применение комбинированного препарата хлоргексидин + декспантенол и аскорбиновой кислоты интравагинально (Вагинорм-С) с 15-х суток после операции способствует восстановлению нормоценоза через месяц у 77,4%, через 3 месяца — у 90,6% пациенток. Эффективность этой терапии в группе лиц, перенесших радиоволновую деструкцию, в 1,2 раза выше (р < 0,05).








