Существуют различные теории инициирования туморогенеза [5, 6]. Одна из них основана на том, что повышение уровней половых стероидов приводит к росту количества митозов, что, в свою очередь, увеличивает вероятность мутаций. Другая гипотеза предполагает наличие врожденной патологии — мутантных миоцитов, содержащих избыток рецепторов эстрогена. Согласно одной из версий, основополагающую роль в патогенезе миомы матки играют эстрогены и эстрогеновый рецептор α. Эта гипотеза подтверждена клинически: на фоне терапии агонистами ГнРГ (аГнРГ) гипоэстрогения сопровождается регрессом узлов миомы [7].
Однако говорить об основополагающем влиянии эстрогенов независимо от прогестерона неверно. В зависимости от условий прогестерон может как стимулировать, так и ингибировать пролиферацию клеток опухоли. В ткани миомы он действует через ядерные рецепторы и неядерные сигнальные механизмы. Ядерные прогестероновые рецепторы (ПР) имеют две основные изоформы: ПРА и ПРВ, соотношение которых в ткани опухоли равновесно, так же как и в окружающем ее миометрии. Кроме того, воздействие прогестерона осуществляется через сигналы, опосредуемые мембранными белками. Усиленная экспрессия ПР может ассоциироваться с ростом миом.
В совокупности эти данные свидетельствуют о том, что в росте миомы принимают участие эстрогены, прогестерон и их специфические рецепторы. Вероятно, оба эти гормона взаимодействуют следующим образом: эстрадиол обеспечивает экспрессию ПР, которые контролируют пролиферацию клеток опухоли. В патогенезе миомы большое значение имеет также неоангиогенез, он активируется при опухолевом росте и сопровождается патологическим ремоделированием сосудистой сети матки [8].
Миома матки ассоциирована с бесплодием и невынашиванием беременности: репродуктивная функция нарушается у каждой третьей женщины с миомой (32,1%) [1]. Особое значение для прогноза донашивания беременности имеют размеры узлов миомы и их расположение. При наличии узлов 0–2го типа и 3–5го типа, достигающих 50 мм в диаметре и более, деформирующих полости матки, чаще отмечают бесплодие, при узлах 3–6го типа размерами менее 50 мм в диаметре и/или без существенной деформации полости матки — невынашивание [6, 9].
Гормональная терапия миомы матки — патогенетически обоснованный способ консервативного лечения. Современные медикаментозные методы включают широкий спектр препаратов с различными механизмами действия [2, 10, 11]: аГнРГ, модуляторы эстрогенных сигналов (селективные модуляторы эстрогеновых рецепторов, ингибиторы ароматазы), селективные модуляторы ПР и прогестагены (могут стимулировать пролиферацию миомы и имеют весьма ограниченную эффективность) [12, 13].
Агонисты ГнРГ — синтетические соединения, структурно схожие с нативной молекулой ГнРГ. Они индуцируют стимуляцию секреции гонадотропинов после связывания с рецепторами ГнРГ и имеют более длительный период полувыведения по сравнению с натуральным ГнРГ. Согласно рекомендациям FDA, аГнРГ признаны единственным фармакологическим агентом, способным не только уменьшить клиническую симптоматику, обусловленную наличием заболевания, но и снизить объем узлов миомы [2]. Эффект аГнРГ заключается в индукции гипоэстрогенного состояния. Кроме того, аГнРГ снижают экспрессию митогенных и ангиогенных факторов (сосудистого эндотелиального фактора роста, фактора роста фибробластов и тромбоцитарного фактора роста), ингибируют пролиферацию клеток опухоли, индуцируют апоптоз in vitro. Однако необходимо применять терапию прикрытия, направленную на стагнацию побочных эффектов аГнРГ (приливов жара, снижения минеральной плотности костной ткани) [5].
Оперативное лечение миомы матки, безусловно, занимает важное место в тактике ведения, однако выбор в пользу миомэктомии должен быть персонифицирован и учитывать фертильные планы конкретной пациентки [1, 2]. Поскольку миому матки чаще диагностируют у женщин среднего и позднего репродуктивного возраста, требуется правильная оценка временнóго фактора. У женщин старше 35 лет вопрос о целесообразности оперативного лечения миомы матки на этапе подготовки к беременности остается дискуссионным. Выбор тактики зависит от возраста пациентки, состояния овариального резерва, размеров доминантного узла миомы, локализации узлов относительно полости матки, наличия анамнеза репродуктивных потерь, сопутствующих гинекологических и экстрагенитальных заболеваний. После миомэктомии требуется определенное время для формирования рубца на матке — дополнительного фактора риска акушерских осложнений (гистопатического разрыва матки, патологической плацентации, недонашивания, кесарева сечения и др.) [14].
Потому на этапе подготовки к беременности у женщин с миомой матки остается перспективным поиск надежных методов консервативной терапии для снижения объема узла и объема оперативного вмешательства соответственно. Кроме того, уменьшение узла в ряде случаев позволит избежать оперативного лечения миомы во время подготовки к беременности.
Цели исследования: 1) оценить эффективность терапии миомы матки аГнРГ у пациенток с репродуктивными потерями в анамнезе; 2) оценить течение и исходы беременности после применения аГнРГ; 3) обосновать использование аГнРГ в составе прегравидарной подготовки при сочетании миомы матки и анамнеза репродуктивных потерь.
Материалы и методы
Исследование проведено в ООО «Клиника вспомогательных репродуктивных технологий "Дети из пробирки"» (директор клиники — д. м. н. Э. В. Вартанян) — на клинической базе кафедры акушерства, гинекологии и репродуктивной медицины факультета повышения квалификации медицинских работников Медицинского института РУДН (заведующий кафедрой — членкорр. РАН, проф. В. Е. Радзинский) в период с 01.01.2014 по 31.07.2016. В когортное ретроспективное сравнительное исследование отобрана 71 пациентка с миомой матки и репродуктивными потерями в анамнезе.
Критерии включения: возраст моложе 41 года, концентрация антимюллерова гормона более 1,0 пг/мл, отсутствие тяжелой экстрагенитальной патологии, наличие узлов миомы типов 2–6 [15], диаметр доминантного узла от 20 до 50 мм, нормальный кариотип эмбриона при предыдущей беременности.
Критерии исключения: возраст 41 год и старше, наличие узлов миомы типов 0 и 1, размеры доминантного узла менее 20 мм и более 50 мм, концентрация антимюллерова гормона ≤ 1,0 пг/мл, верифицированные хромосомные аномалии эмбриона при предыдущей беременности, неустановленные причины невынашивания, наличие тяжелой экстрагенитальной патологии.
Измеряемыми критериями эффективности консервативной терапии миомы матки служили регресс объема доминантного узла миомы на 25% и более, изменение характера васкуляризации опухоли, частота наступления спонтанной беременности и репродуктивных потерь.
Участниц разделили на две статистически сопоставимые группы: первую группу составили 39 пациенток, получавших лечение аГнРГ бусерелином (Бусерелинлонг, ООО «Натива», Россия) в дозе 3,75 мг один раз в 28 дней в/м на преконцепционном этапе. Во вторую группу вошли 32 пациентки, не получавшие терапию аГнРГ до наступления спонтанной беременности.
Трансвагинальное УЗИ выполняли на 5–7й день менструального цикла. Трансвагинальную ультразвуковую доплерографию пациенткам первой группы делали на 19–22й день менструального цикла до начала терапии аГнРГ. Оценивали показатели периферического сосудистого сопротивления на уровнях левой и правой маточных артерий, аркуатных, радиальных, базальных и спиральных артерий вне зон расположения узлов миомы, а также характер перфузии узлов миомы. Для оценки перфузии в режиме импульсноволнового доплера получали огибающую доплеровского спектра при частоте повторения импульсов 500 Гц, фильтр устанавливали на уровне 50 Гц, при оценке кровотока на уровне спиральных артерий максимальная скорость потока составляла 6 см/с, а уголнезависимый показатель (индекс резистентности — resistance index, RI) определяли в автоматическом режиме. Соответствие параметров перфузии матки нормативным величинам устанавливали, опираясь на данные И. А. Озерской (2013) [16].
Трансвагинальные УЗИ и ультразвуковую доплерографию проводили, используя сканер Esaote MyLab 70 (Esaote, Италия), кавитальный датчик 6–10 МГц, в режимах серошкальной эхографии (2D), цветного доплеровского кодирования и импульсноволнового доплера. Последовательно получали изображения матки и яичников в сагиттальной и поперечной плоскостях, оценку размеров узлов миомы также проводили в данных плоскостях. Объем узла миомы рассчитывали по формуле:
0,523a × b × c,
где 0,523 — коэффициент для расчета объема круглых тел; а, b, c — взаимно перпендикулярные размеры узла.
На этапе прегравидарной подготовки все пациентки получали препарат фолиевой кислоты (фолиевая кислота 400 мкг + цианокобаламин 2 мкг + калия иодид 200 мкг) перорально по 1 табл./сут в течение 3 месяцев до зачатия и далее до 12 недель гестации, а также препарат прогестерона (микронизированный прогрестерон) в дозе 200 мг/сут интравагинально с 15го по 25й день менструального цикла (с учетом наличия в анамнезе невынашивания беременности) [17] в течение всего периода прегравидарной подготовки (с момента восстановления менструального цикла после отмены аГнРГ у женщин первой группы) и далее до 12 недель гестации.
Математическую обработку полученных результатов проводили с использованием методов описательной статистики на персональном компьютере с помощью программы Exсel 2007. ДИ указан как M ± m, где М — медиана, а m = 2σ (два стандартных отклонения). Различия считали достоверными при р < 0,05.
Результаты
Группы были сопоставимы по возрасту и массе тела участниц. Средний возраст составил 34,8 ± 4,9 года, средний ИМТ — 26,7 ± 4,2 кг/м2. Отмечали высокую частоту гинекологических заболеваний и репродуктивных потерь в анамнезе в обеих группах (табл. 1).
Таблица 1
Анамнез обследованных женщин, n (%)
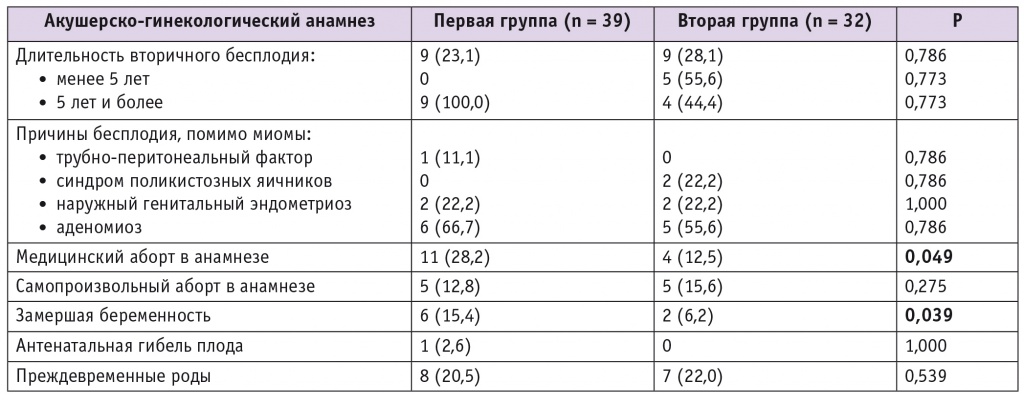
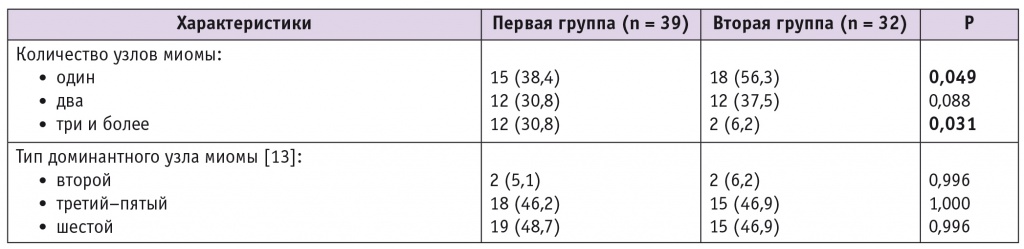
Количество и расположение узлов миомы представлены в таблице 2. Средний объем доминантного узла в группах значимо не различался и составил 31,1 ± 12,2 см3.
Таблица 2
Характеристики миомы матки у обследованных женщин, n (%)
Что касается особенностей перфузии матки до начала терапии аГнРГ, то средний RI в первой группе на уровне маточных артерий составлял 0,68 ± 0,18; на уровне аркуатных артерий — 0,62 ± 0,12; на уровне радиальных артерий — 0,59 ± 0,11. При оценке перфузии на уровне базальных артерий кривые скоростей кровотока (КСК) определяли у 61,5% женщин, на уровне спиральных артерий — лишь у 43,6%, при этом средний RI на данном уровне в случаях, когда КСК были зафиксированы, составил 0,51 ± 0,11, а снижение показателей КСК отмечали у 70,6% пациенток. Показатели RI на всех уровнях сосудистого дерева матки в обеих группах были сопоставимы.
При изучении характеристик перфузии доминантного узла миомы у женщин первой группы установлено: у 79,5% участниц зарегистрирована васкуляризация по центральному и периферическому типу; Vps = 7,1 ± 1,6 см/с, RI = 0,32 ± 0,18; у 20,5% пациенток зафиксирована васкуляризация только по периферическому типу.
Средняя продолжительность терапии аГнРГ составила 4,2 месяца. По окончании лечения объем доминантного узла снизился у 76,9% пациенток (табл. 3). Уменьшение объема на 25% и более от исходного (что расценено как критерии эффективности консервативной терапии) произошло у 66,7% женщин. Средний объем доминантного узла после лечения составил 13,4 ± 1,6 см3 (р < 0,05). В среднем редукция объема доминантного узла достигла 43,1 ± 17,3%.
Таблица 3
Характер перфузии в бассейне маточных артерий у женщин первой группы, M ± m
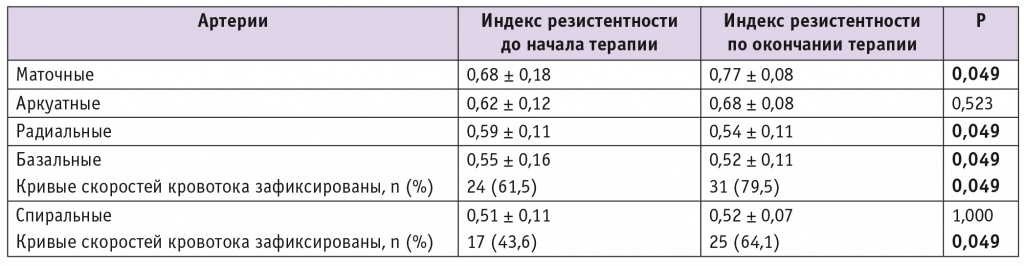
Характер перфузии в бассейне маточных артерий по окончании терапии аГнРГ изменился. Изменение показателей КСК на уровне маточных и радиальных артерий зафиксировано во всех наблюдениях: RI на уровне маточных артерий повысился, а на уровне радиальных артерий снизился (для обоих показателей р < 0,05). Улучшилась и перфузия в терминальных ветвях: после восстановления менструального цикла КСК в эндометрии выявлены у 64,1% женщин из первой группы. В дальнейшем именно у них наступила спонтанная беременность.
Среди женщин первой группы, у которых до начала терапии была зарегистрирована васкуляризация доминантного узла миомы по центральному и периферическому типу (n = 31), по окончании лечения аГнРГ у 77,4% наблюдалась васкуляризация лишь по периферическому типу с повышением скоростных показателей: Vps = 15,2 ± 3,4 см/с, RI = 0,65 ± 0,14, что отражает снижение перфузии (р < 0,05 для обоих параметров).
Спонтанная беременность по окончании терапии аГнРГ наступила у 25 (64,1%) женщин первой группы и у 27 (84,4%) участниц второй группы на фоне назначения рутинной прегравидарной подготовки. Среднее время от момента окончания консервативного лечения миомы матки до зачатия в первой группе составило 6,3 ± 3,1 месяца против 8,2 ± 2,2 месяца во второй (р < 0,05). В то же время частота репродуктивных потерь (табл. 4) у женщин, которым не проводили консервативную терапию миомы матки на преконцепционном этапе, была статистически незначимо выше. Беременность не закончилась деторождением у 8,0% пациенток первой и у 14,8% пациенток второй группы.
Таблица 4
Осложнения беременности у обследованных женщин, n (%)
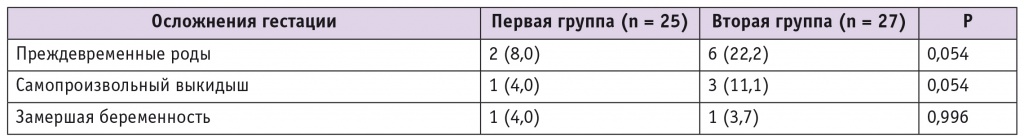
Беременность завершилась своевременными родами у 84,0% женщин первой и у 63,0% второй группы. Преждевременные роды произошли в сроке менее 32 недель гестации у 7,4% участниц второй группы, в первой группе в данном сроке гестации родов не было; в сроке 33–36 недель роды произошли у 8,0% женщин первой и у 14,8% второй группы. Перинатальные потери отсутствовали. Случаев нарушения питания узла миомы во время беременности в нашем исследовании не отмечено.
Обсуждение
Известно, что у больных миомой матки имеют место как снижение, так и утрата фертильности. Первичное бесплодие отмечается у 18–24%, а вторичное — у 25% женщин. Беременность на фоне миомы матки осложняется угрозой прерывания в 25–31% случаев. Частота невынашивания при интрамуральном расположении узла миомы составляет 22%, а при его субмукозном расположении достигает 80% по данным литературы [1, 8].
В нашем исследовании частота вторичного бесплодия в первой и второй группах составила 23,1% и 28,1%. Отягощенный акушерский анамнез имел место у 31 (79,5%) пациентки в первой и у 18 (56,3%) во второй группе (р < 0,05). Репродуктивные потери в анамнезе зафиксированы у 12 (30,8%) женщин в первой группе и у 7 (21,8%) во второй. Обращает на себя внимание высокая частота замершей беременности в анамнезе (15,4%) у участниц первой группы. Вероятно, такая структура репродуктивных потерь обусловлена тем, что в первой группе преобладали пациентки с двумя узлами миомы и более (24 (61,5%) против 14 (43,8%); р < 0,05), что согласуется с данными литературы [1, 8].
Результаты многочисленных исследований [18–21] демонстрируют высокую эффективность аГнРГ для уменьшения объема узлов миомы (на 20–70%) и объема матки (на 30–50%).
Анализ результатов нашего исследования показал, что средний объем доминантного узла снизился более чем на 25% от исходного у 66,7% пациенток (р < 0,05), а редукция объема доминантного узла составила в среднем 43,1%, что, бесспорно, указывает на высокую эффективность аГнРГ для консервативного лечения миомы матки и сопоставимо с данными других авторов [18–21].
В литературе разнятся сведения о характере васкуляризации узлов миомы до и после применения различных фармакологических препаратов для консервативной терапии миомы матки. По результатам исследования С. С. Chia и соавт. (2006), по окончании 4недельного курса лечения аГнРГ характер перфузии узла миомы существенно не изменился [22]. Однако N. Kanelopoulos и соавт. (2003) сообщили о значимом повышении показателей КСК на уровне маточных артерий по окончании 3месячного курса терапии аГнРГ, что указывает на снижение перфузии матки в целом и узла миомы в частности [23]. N. Takahashi и соавт. (2016) оценили с помощью МРТ степень регресса васкуляризации миометрия после применения аГнРГ в течение 4 месяцев в пилотном исследовании. Результаты этой работы показали уменьшение общего объема перфузии на 39% [24].
Анализ результатов нашего исследования свидетельствует, что изменение характера васкуляризации доминантного узла миомы по окончании терапии аГнРГ произошло у 77,4% женщин (р < 0,05). Наличие перфузии по периферическому типу с повышением показателей КСК — прогностически благоприятный признак, указывающий на значимое снижение риска пролиферации опухоли, что в целом согласуется с результатами последних зарубежных исследований [24].
Точные сведения о частоте наступления спонтанной беременности на фоне наличия миомы матки в литературе не представлены. По данным некоторых исследований, интрамуральное расположение узла может негативно влиять на частоту наступления беременности в протоколах ЭКО (ОР = 0,684; 95%ный ДИ: 0,587–0,796; p < 0,001) и частоту имплантации (ОР = 0,810; 95%ный ДИ: 0,696–0,941; p = 0,006) [25]. Однозначно доказано негативное влияние миомы матки на фертильность лишь в случае субмукозно расположенного узла. В то же время установлено, что наличие миомы даже без деформации полости матки ассоциировано со снижением частоты живорождения на 18–27% (95%ный ДИ: 4–44%) при лечении бесплодия методом ЭКО [6].
По результатам нашего исследования частота наступления спонтанной беременности после проведения терапии аГнРГ при наличии узлов миомы 2–6го типов составила 64,1%, что может косвенно указывать на обоснованность выбора данной консервативной тактики в составе прегравидарной подготовки.
Течение беременности у пациенток с миомой часто осложняется невынашиванием, преждевременными родами и может быть сопряжено с маловесностью при рождении. Результаты метаанализа P. C. Klatsky и соавт. (2008) показали, что наличие миомы матки ассоциировано с риском недонашивания (ОР = 1,5; 95%ный ДИ: 1,3–1,7) [26]. Установлено также, что при интрамуральном расположении узла миомы растет риск невынашивания (ОР = 1,747; 95%ный ДИ: 1,22–2,489; p = 0,002) [25].
Низкая частота репродуктивных потерь в нашем исследовании (8,0% в первой группе против 14,8% во второй) свидетельствует в пользу обоснования консервативной терапии миомы матки аГнРГ в составе прегравидарной подготовки на преконцепционном этапе. Подтверждением правильности данной тактики служит и более низкая частота преждевременных родов у женщин первой группы. Так, на преждевременные роды в анамнезе указывали 20,5% пациенток, а после терапии аГнРГ беременность не доносили до срока лишь 8,0% женщин. В группе пациенток, не получавших аГнРГ, этот показатель остался на прежнем уровне (21,9% и 22,2% соответственно).
Заключение
Применение агонистов ГнРГ (аГнРГ) (препаратa Бусерелинлонг) у пациенток с миомой матки в составе комплексной прегравидарной подготовки — высокоэффективный метод консервативной терапии данного гинекологического заболевания, позволяющий добиться редукции объема узла миомы и улучшения перфузии эндометрия. Эти эффекты имеют положительное значение для прогноза успешной имплантации.
После лечения миомы матки аГнРГ снижается частота репродуктивных потерь и недонашивания беременности, что обосновывает их использование у пациенток с миомой матки и анамнезом невынашивания беременности.








