ВВЕДЕНИЕ
Пролапс тазовых органов (ПТО) — заболевание тазового дна, которое оказывает негативное влияние на здоровье женщин во всем мире и остается одной из наиболее актуальных и сложных проблем гинекологии. Точная распространенность ПТО не установлена ввиду различных методов выполнения исследований, однако цифры мировой статистики в основном варьируют в диапазоне от 40% до 60%[1].
И большинство экспертов уверено в том, что это не предел: распространенность ПТО будет расти. Например, M.K. Lindsay (2009) отмечает, что с 2010 по 2030 г. частота ПТО возрастет на 35%[2]. Согласно прогнозам J.M. Wu и соавт. (2009), к 2050 г. 58,2 млн женщин США будут иметь как минимум одно дисфункциональное расстройство, связанное с состоянием тазового дна. При этом 41,3 млн из них будут страдать недержанием мочи, 25,3 млн — недержанием кала и у 9,2 млн будет наблюдаться ПТО[3]. Можно предположить, что к середине XXI века частота хирургических вмешательств по поводу несостоятельности мышц тазового дна (НМТД) и связанных с ней диагнозов увеличится более чем на 40%, а ежегодные расходы на операции будут расти в 2 раза быстрее, чем численность населения[4].
Проблема опущения тазовых органов имеет не только медицинские, но и экономические аспекты. Министерства здравоохранения различных стран ежегодно выделяют средства для оказания медицинской помощи таким пациенткам. Экономически развитые страны осуществляют бюджетное финансирование изучения и лечения ПТО, и затраты крайне велики[5]. Так, Швеция на лечение дисфункций тазового дна ежегодно направляет до 2% от общих средств здравоохранения[6].
С начала XXI века совершен ряд открытий в области перинеологии, однако ответы на главные вопросы еще не получены. За последние 20 лет проблема ПТО и НMТД стала одной из контраверсионных в гинекологии[7].
Внедрено множество хирургических методик коррекции тазовой десценции, и насчитывается несколько сотен видов пластических операций по поводу ПТО[8, 9]. Парадоксально, но число женщин с пролапсом гениталий (ПГ) при этом не уменьшается, что подтверждает прогнозы экспертов. Видимо, представления о патогенезе ПТО, которые лежат в основе существующих лечебных методов, недостаточны, а исследования проводятся хаотично.
К основным предикторам опущения тазовых органов относят хроническое повышение внутрибрюшного давления, менопаузу, акушерскую травму, дисплазию соединительной ткани, старение[10–13]. Значение каждого из этих факторов неоднозначно, в частности:
- возраст и эстрогенная депривация доказанно приводят к ПТО, что ставит под вопрос случаи возникновения тазовой десценции у женщин репродуктивного возраста[14];
- акушерская травма, считающаяся одним из самых обсуждаемых предикторов ПТО[15], противоречит возникновению тазовой десценции у нерожавших женщин и у женщин, родоразрешенных путем кесарева сечения[16];
- по доминирующей на сегодняшний день теории патогенез ПГ связан с системной дисплазией соединительной ткани (ДСТ)[17]. Исследованы такие генетические детерминанты слабой ДСТ, как COL1A1, MMP-2, TIMP-2, TGF-β1 и SMA, тропониновая система, но отчетливая патогенетическая картина пролапса пока отсутствует[18–21].
Несмотря на широкое мультицентровое изучение ультраструктурных нарушений соединительной ткани в контексте ДСТ как основы патогенетической концепции ПТО, маркеры последнего еще не найдены. По результатам биологических исследований, распространенность истинной системной ДСТ в человеческой популяции составляет всего лишь около одного процента. Соответственно, если ДСТ и является причиной ПТО, то у небольшого количества женщин. Объяснение патогенеза заболевания у большинства пациенток данными единичных случаев представляется нелогичным. Более того, не позволяя шире взглянуть на проблему патогенеза пролапса, такая научная парадигма имеет своей ценой потерю времени, сил и средств.
Контраверсионное мнение высказали I.A. Jakus и соавт. (2017)[22]. В своей работе исследователи показали снижение экспрессии маркера митохондриальных дыхательных комплексов во влагалищной стенке у женщин с ПТО, указывающее на уменьшение количества митохондрий и нарушение энергообеспечения ткани, которые могут приводить к деградации мышечной структуры влагалищной стенки.
Тазовое дно представлено не только соединительным компонентом, но и мышечной тканью[23]. Последняя исследована крайне мало, отчасти по причине неоднозначной роли акушерской травмы промежности в патогенезе ПТО, отчасти в связи со значительными техническими трудностями при биопсии мышц тазового дна. Исследованиям могут препятствовать также особенности структуры мышцы, любое внедрение в которую запускает необратимые дегенеративные процессы.
Однако УЗИ и МРТ мышц промежности подтвердили повреждение мышечной ткани (скрытые травмы промежности)[24]. При помощи УЗИ тазового дна и перинеометрии N.O. Nyhus и соавт. (2019) обнаружили у пациенток с НМТД и ПТО более слабое сокращение мышц промежности, чем у женщин, не страдающих данными заболеваниями[25].
Исследований, связанных с изучением морфологической структуры мышц промежности у пациенток с НМТД и ПТО, выявленными визуализационными методами, найти не удалось. Это предполагает, что повреждения возможны не только в области акушерской промежности, где они диагностируются в ходе физикального осмотра, но и за ее пределами[26]. Хотя именно структурные изменения мышечной ткани промежности и, как следствие, нарушение ее сократимости могут быть одним из ключевых звеньев патогенеза НMТД и ПТО. Изучение данной структуры может помочь глубоко осознать патогенез ПТО и в будущем разработать наиболее логичные и эффективные методы его диагностики, профилактики и лечения.
Целью данного исследования стало расширение представлений о патогенезе ПГ и НМТД с оценкой стандартных морфологических изменений m. levator ani.
МАТЕРИАЛЫ И МЕТОДЫ
Многоцентровое ретроспективное клинико-морфологическое исследование проведено в 2018–2019 гг. на кафедре акушерства и гинекологии с курсом перинатологии ФГАОУ ВО РУДН (заведующий кафедрой — член-корреспондент РАН, д. м. н., профессор В.Е. Радзинский), на базе отделения гинекологии и репродуктивной хирургии ГБУЗ «ГКБ № 29 им. Н.Э. Баумана ДЗМ» (главный врач — к. м. н. Н.М. Шапкин, заведующий отделением — к. м. н. Д.Г. Арютин), а также на базе патолого-анатомического отделения ГБУЗ «ГКБ № 31 ДЗМ» (главный врач — Н.М. Ефремова, заведующая отделением — д. м. н. Л.М. Михалёва).
В выборку были включены 40 пациенток с верифицированным диагнозом «недостаточность мышц тазового дна», осложненным передним, апикальным и задним пролапсом в разных сочетаниях, которые были диагностированы впервые на основании перинеологического и сонографического исследований.
Критерии включения:
- ПГ;
- роды per vias naturales в анамнезе;
- информированное согласие пациенток на участие в исследовании.
Критерии исключения:
- злокачественные новообразования различного генеза;
- отсутствие родов per vias naturales в анамнезе;
- гистерэктомия в анамнезе;
- доброкачественные новообразования матки и яичников на момент госпитализации;
- отказ от участия в исследовании.
По итогам обследования у пациенток были диагностированы несостоятельность мышц тазового дна (N81.8), опущение стенок влагалища с формированием цисто- и ректоцеле (N81.1), неполное выпадение матки (N81.2), полное выпадение матки (N81.3). Данные диагнозы послужили показаниями к оперативному лечению и позволили методом механической рандомизации разделить участниц исследования на три группы:
- с опущением стенок влагалища (группа I, n = 20);
- с неполным выпадением матки (группа II, n = 13);
- с полным выпадением матки (группа III, n = 7).
Общий и гинекологический статус оценивали при помощи бимануального, манометрического (перинеометрия), сонографического исследований и вагинальной пальпации с определением силы мышц промежности по Оксфордской шкале[27, 28].
Оперативное вмешательство выполняли в условиях стандартно оборудованной операционной. Операциями выбора служили передняя кольпоррафия, влагалищная экстирпация матки, задняя кольпоррафия, леваторо- и перинеопластика. Пациенткам с сопутствующим диагнозом «непроизвольное мочеиспускание» (N39.3) проводили уретропексию, устанавливали слинговую систему по методике TVT-O или SYRENE.
Во время оперативного вмешательства осуществляли биопсию медиальной порции m. levator ani (m. puborectalis) по следующей методике. Заднюю спайку преддверия влагалища рассекали в горизонтальном направлении при помощи скальпеля, после чего заднюю стенку влагалища рассекали продольно, стенки влагалища отсепаровывали, выделяли ножки m. levator ani. Выполнив наложение на m. levator ani трех отдельных викриловых швов и фиксировав ее, специальным инструментом для панч-биопсии (Epitheasy medax Ref: EPT600-00) прицельно иссекали биоптат мышцы диаметром 3 мм с двух сторон от centrum tendineum. У каждой пациентки биоптаты брали в двух стандартных точках: на 4 см выше анального отверстия и на 2 см латеральнее сухожильного центра слева и симметрично справа. При наличии рубца на промежности вследствие акушерской травмы дополнительно проводили его биопсию (третья точка).
В качестве контроля были взяты биоптаты m. levator ani с одной стороны от centrum tendineum у пациенток без НМТД и ПТО, оперированных по поводу ретенционных кист влагалища (n = 2). Клинические данные этих женщин в изученную выборку не вошли.
Биопсийный материал фиксировали в автоматическом гистопроцессоре Leica ASP 30. Проводили фиксацию в 10%-м формалине и 95%-м этиловом спирте, далее в ксилоле и горячем парафине. После заливки материала парафином в станции Leica EG 1150 готовили гистосрезы толщиной 4 мкм с последующей их окраской гематоксилином и эозином и по Маллори в автоматических станциях Leica ST 5010 и CV 5030. Микроскопическое исследование выполняли на триокулярном микроскопе Leica DMLB (окуляры с увеличением 10×) с использованием цифровой камеры Leica DFC 420. В полученных фрагментах рассчитывали площадь фиброза в процентах от общей площади гистологического среза с помощью программного обеспечения ImageScope Color M, измерения калибровали с применением объекта-микрометра для микроскопа с ценой деления 0,01 мм.
Окраска по Маллори используется для исследования волокнистых структур соединительной ткани. В основе метода лежит уникальное свойство анилинового синего окрашивать коллагеновые волокна в зеленовато-голубой цвет, а кислого фуксина — эластические волокна в красный цвет. В результате окраски коллагеновые волокна становятся темно-синими, а ядра, эритроциты, эластические волокна — красными; амилоид, гиалин и слизь окрашиваются голубым цветом, мышечная ткань — оранжевым, нейроглия — красно-фиолетовым цветом.
Статистические показатели рассчитывали в программе Statistica 10. Ввиду нормального распределения зависимой переменной (тест Шапиро — Уилка, p = 0,56) использовали параметрические методы статистики.
РЕЗУЛЬТАТЫ
Возраст пациенток варьировал от 36 до 77 лет и в среднем составил 59,5 ± 9,95 года. Информация о возрасте в группах с разными ПТО представлена в таблице 1.
Таблица 1
Численность групп и возраст обследованных женщин
* При сравнении с группами I и II p < 0,05.
В I и II группах пациентки были статистически значимо (p < 0,05) моложе, чем в III группе. Этот явилось ожидаемым результатом: более тяжелые формы заболевания закономерно чаще встречаются у женщин более старшего возраста. Между I и II группами статистически значимых возрастных различий не выявлено (p > 0,05).
На момент госпитализации для оперативного лечения НMТД и ПТО у обследованных женщин были выявлены те или иные экстрагенитальные заболевания, в среднем на одну пациентку приходилось по одному сопутствующему диагнозу. Наиболее распространенным экстрагенитальным заболеванием оказалась гипертензивная болезнь (I11), которой страдала каждая третья женщина (n = 15; 37,5%). Ожирение (E66) отмечалось у 11 женщин (27,5%), тогда как пациентки со сниженной массой тела (E40) отсутствовали; средний ИМТ составил 28,2 кг/м2. Варикозное расширение вен нижних конечностей (I83) наблюдалось у 7 пациенток (17,5%). Остальные болезни встречались с равной частотой.
Травму промежности в родах (разрывы, эпизиотомия) перенесли 26 пациенток (65,0%). Операций наложения акушерских щипцов и вакуум-экстракции плода в анамнезе у женщин изученной выборки не было.
В периоде постменопаузы находилась 31 женщина из 40 (77,5%), его длительность варьировала от 2 лет до 31 года (в среднем 9,7 ± 8,4 года).
Анамнез 28 (70,0%) пациенток отягощали гинекологические заболевания: невоспалительные заболевания шейки матки (псевдоэрозия — N86, дисплазия — N87, лейкоплакия шейки матки — N88.0), гиперпластические процессы эндометрия (N85.0), доброкачественные образования яичников (D27) и матки (D25), эндометриоз (N80). Рубцовая деформация шейки матки (старые рубцы) не была выявлена ни у одной женщины.
Временной промежуток от первых родов до момента появления жалоб, связанных с ухудшением состояния тазового дна, на момент обращения в клинику варьировал от 1 года до 50 лет (в среднем 31,2 ± 12,05 года). Пациентки жаловались в основном на дискомфорт, ощущение «инородного тела» в области промежности, недержание мочи при физических нагрузках и кашле, диспареунию.
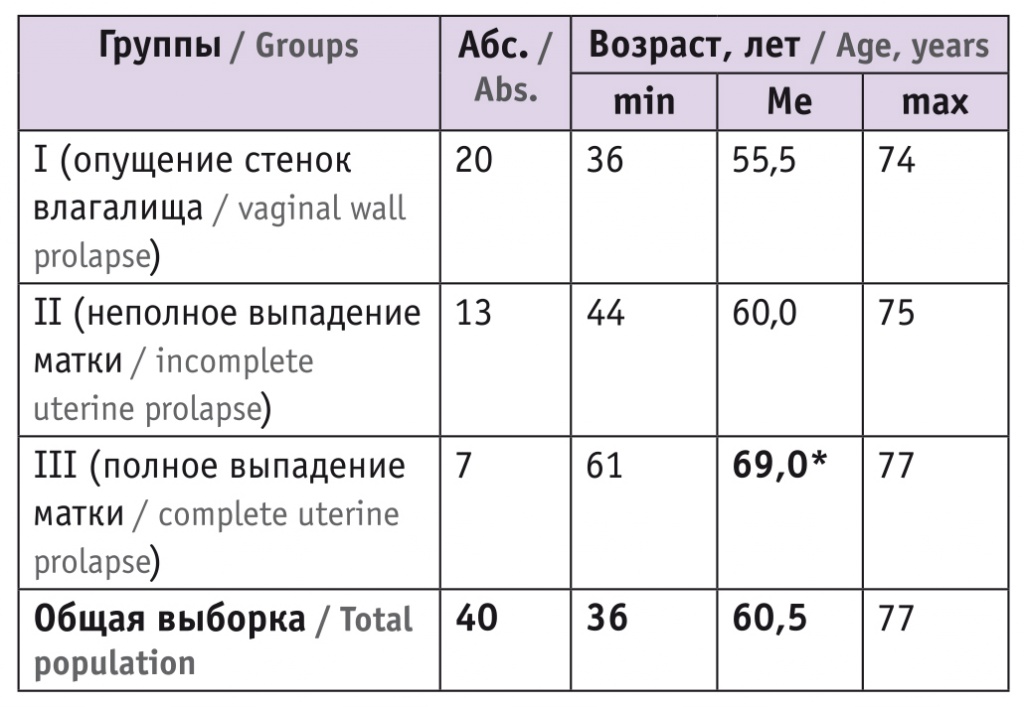
При микроскопическом исследовании биоптатов мышц промежности у двух женщин без НМТД и ПТО, оперированных по поводу ретенционных кист влагалища (для сравнения с группами исследования), получена морфологическая картина мышечной ткани без фиброза, которой не наблюдалось в исследованных группах (рис. 1).
Рис. 1. Патоморфологическая картина мышечной ткани без фиброза, окраска по Маллори, ув. ×10. Нормальная мышечная ткань окрашена в оранжевый цвет. Иллюстрация авторов
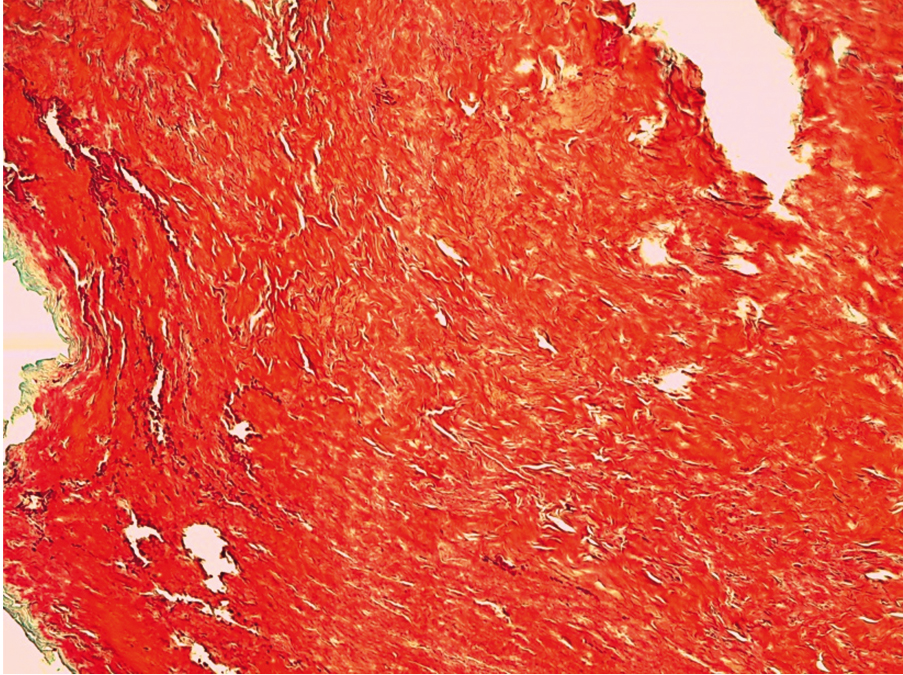
У всех пациенток изученной выборки был обнаружен фиброз мышечной ткани, расцененный как незначительный (1–25%), умеренный (25–50%) или выраженный (> 50%) (рис. 2–6).
Рис. 2. Патоморфологическая картина мышечной ткани с незначительным или умеренным фиброзом, окраска гематоксилином и эозином, ув. ×10. Фрагменты мышечной ткани представлены пучками поперечнополосатых мышечных клеток, ядра слегка вытянутой формы, оттесненные к периферии. В части мышечных клеток признаки дистрофии, местами видны фокусы более бледного цвета, в которых отсутствуют характерные структурные элементы мышечной ткани и ядра. Определяются тонкостенные сосуды с очагово или полностью склерозированной стенкой. Иллюстрация авторов
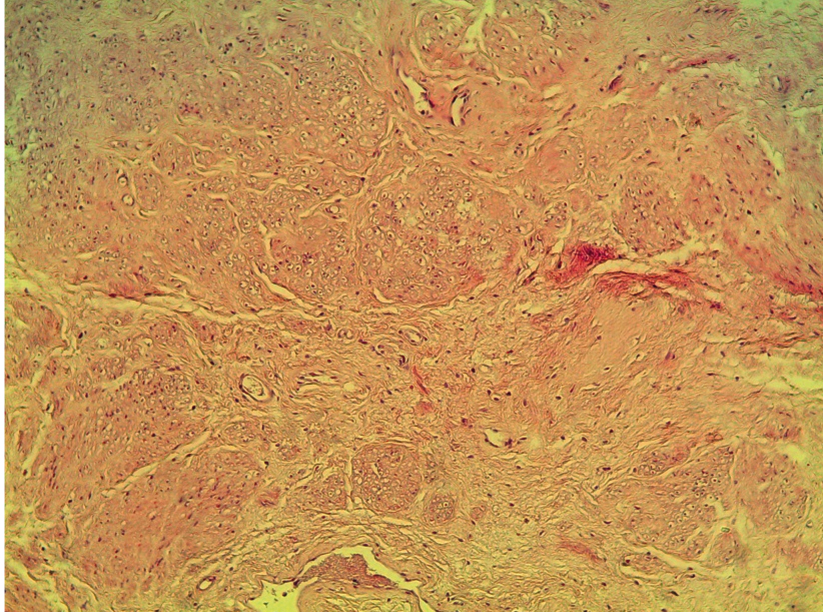
Рис. 3. Патоморфологическая картина мышечной ткани с незначительным фиброзом, окраска по Маллори, ув. ×10. Мышечная ткань окрашена в оранжевый цвет, соединительная ткань — в синий цвет. Объем соединительной ткани занимает до 25%. Иллюстрация авторов
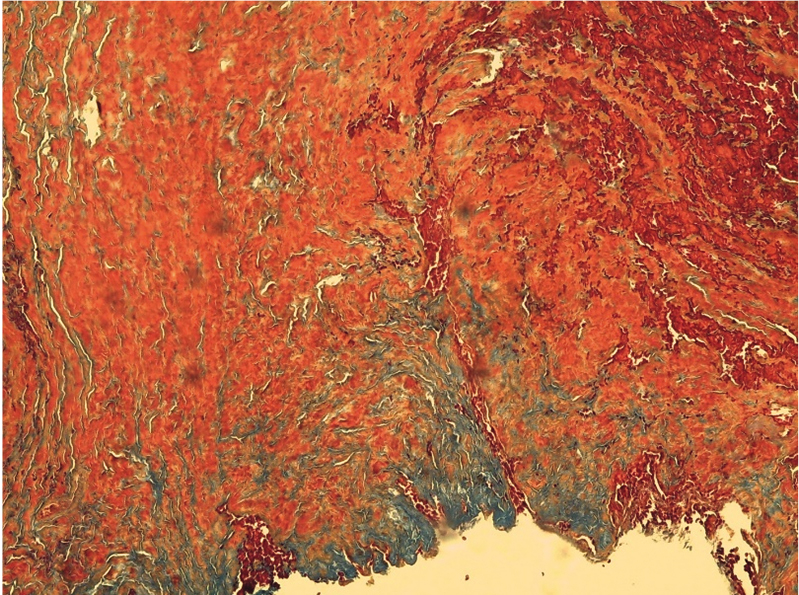
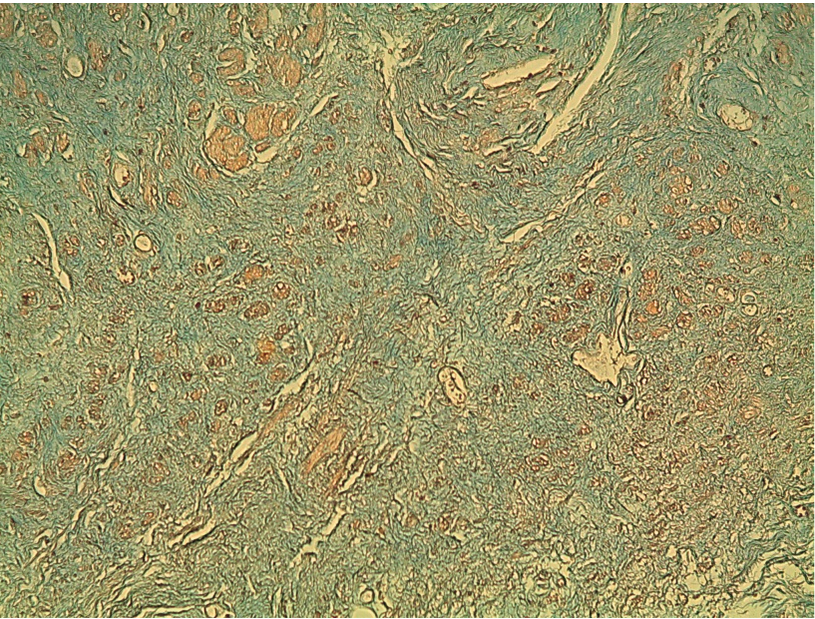
Рис. 4. Патоморфологическая картина мышечной ткани с умеренным фиброзом, окраска по Маллори, ув. ×10. Мышечная и соединительная ткань окрашена в оранжевый и синий цвет соответственно. Мышечная ткань имеет признаки структурной дезорганизации. Определяются тонкостенные сосуды, заполненные эритроцитами. Объем соединительной ткани занимает до 50%. Иллюстрация авторов
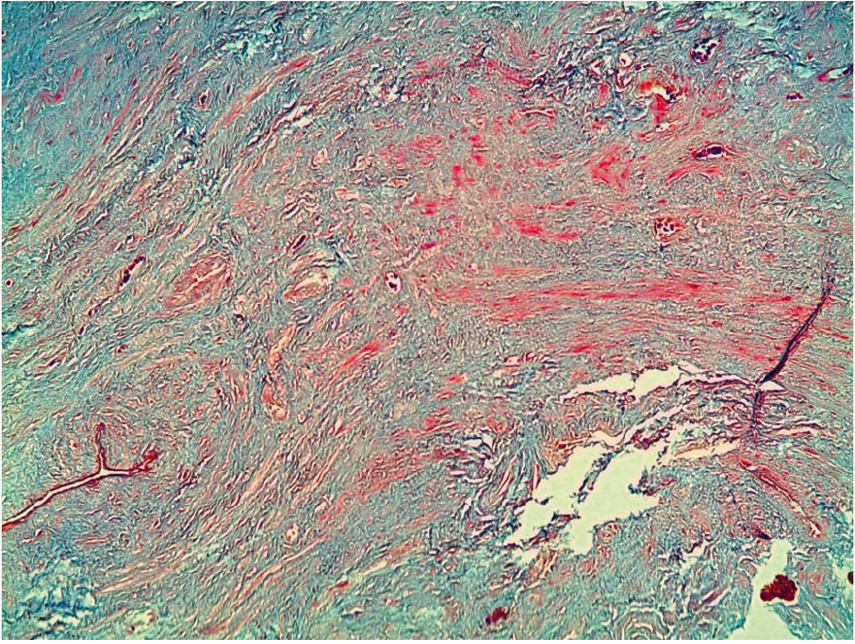
Рис. 5. Патоморфологическая картина мышечной ткани с выраженным фиброзом, окраска гематоксилином и эозином, ув. ×10. Фрагменты мышечной ткани представлены пучками поперечнополосатых мышечных клеток, ядра слегка вытянутой формы, оттесненные к периферии. Обширные фокусы бледного цвета, в которых отсутствуют характерные структурные элементы мышечной ткани и ядра. Сохранившаяся мышечная ткань с признаками структурной дезорганизации и атрофии. Тонкостенных сосудов определяется меньше, чем при незначительном и умеренном фиброзе. Иллюстрация авторов
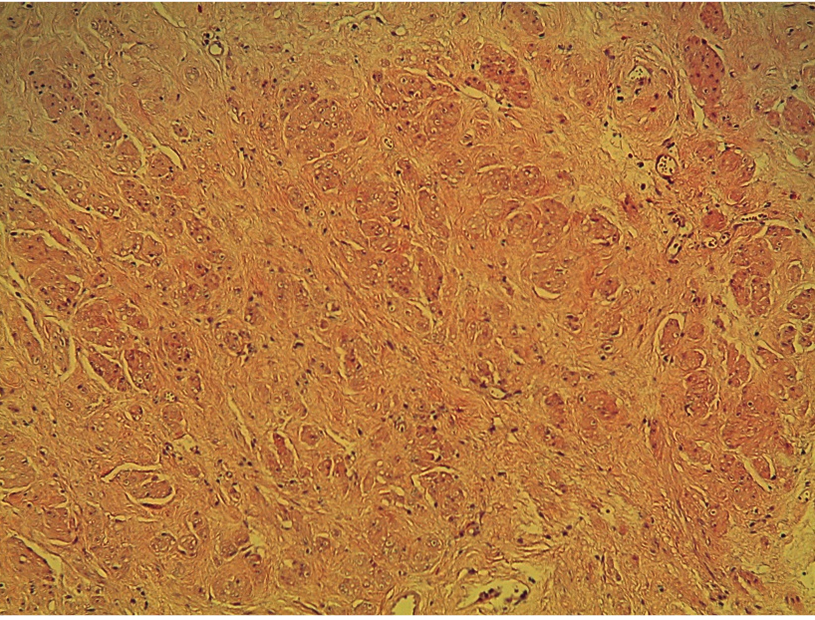
Рис. 6. Патоморфологическая картина мышечной ткани с выраженным фиброзом, окраска по Маллори, ув. ×10. Единичные фокусы мышечной ткани, окрашенной в оранжевый цвет, и большой объем соединительной ткани, окрашенной в синий цвет. Иллюстрация авторов
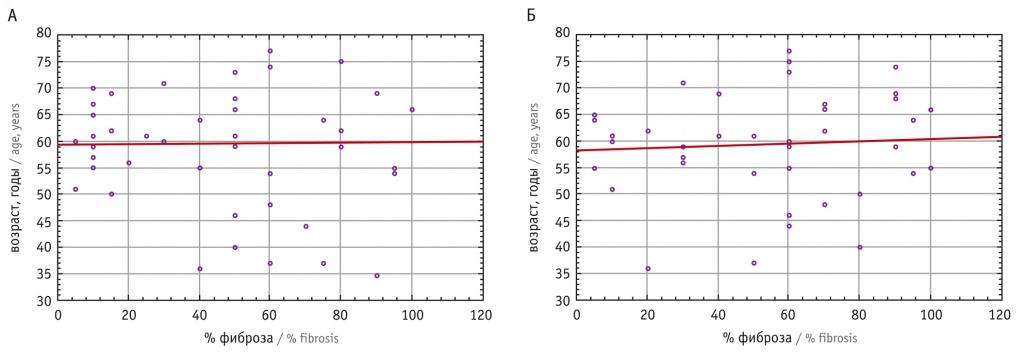
Для более объективной оценки степени фиброзирования выполнен расчет процентного отношения площади фиброза к общей площади гистологического среза, к полученным данным исследована зависимость площади фиброза в пределах каждой из исследуемых локализаций от возраста пациентки. Оказалось, что площадь фиброза не зависит от возраста (притом что от возраста зависит тяжесть ПТО): по коэффициенту Спирмена не было выявлено статистически значимой корреляции ни для левостороннего (r = 0,03, р > 0,05), ни для правостороннего фиброза m. levator ani (r = 0,05, р > 0,05) (рис. 7).
Рис. 7. Зависимость от возраста пациенток площади фиброза m. levator ani слева (А) и справа (Б) от сухожильного центра промежности
Пациенток с нулевым процентом фиброза в каком-либо биоптате, независимо от его локализации (слева, справа от m. levator ani и тем более из области рубца), ни в одной из трех групп не выявлено. По минимальным и максимальным долям фиброза в изученных локализациях группы также были сопоставимы (табл. 2).
Таблица 2
Фиброз m. levator ani у пациенток с несостоятельностью мышц тазового дна, Me (min; max), %
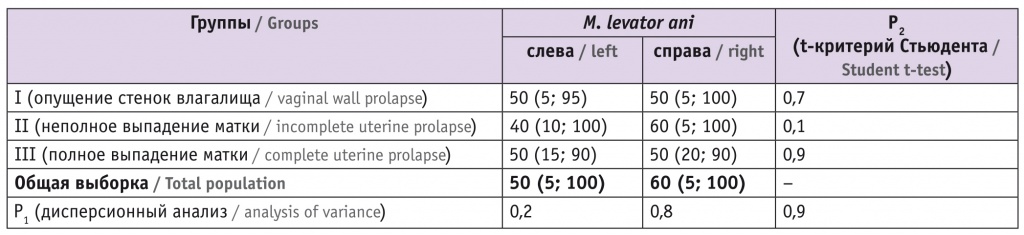
Примечание: p1 — при сравнении групп; p2 — при сравнении площади фиброза слева и справа.
В среднем фиброзирующий процесс у пациенток с НМТД и разными степенями ПТО в изученных биоптатах занимал около половины площади мышечной ткани. Выраженность процесса не была латерализована (!) и с одинаковой частотой наблюдалась слева и справа. Надо отметить, что проявления фиброза имели тенденцию к нарастанию в зависимости от утяжеления степени пролапса. Но если в I и II группах встречались пациентки с диффузным и тотальным замещением мышечной ткани соединительной (100% фиброза), то у женщин с полным выпадением матки тотальный фиброз не был обнаружен ни в одном из изученных биоптатов. У пациенток, оперированных по поводу неполного выпадения матки, выявлено незначительное увеличение медианы доли фиброза справа от centrum tendineum, слева это значение было меньше без статистической значимости различий (p = 0,1).
В анамнезе у 26 женщин (65,0% от общей выборки) имелась акушерская травма промежности (посттравматический рубец). Численность женщин с посттравматическим рубцом в группах исследования и оценка фиброза в области рубца и m. levator ani слева и справа у этих пациенток представлены в таблице 3.
Таблица 3
Фиброз m. levator ani у пациенток с несостоятельностью мышц тазового дна и акушерской травмой в анамнезе
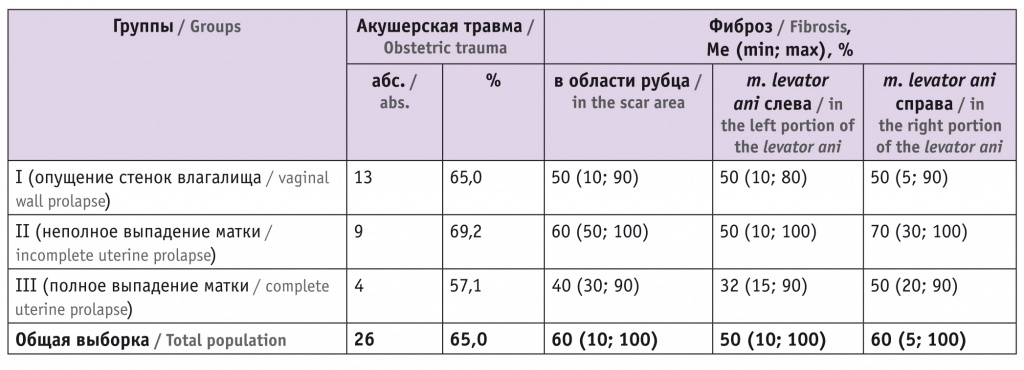
Доля фиброза в околорубцовой области у женщин с акушерской травмой промежности была неожиданно сопоставима с таковой в удаленных от рубца биоптатах m. levator ani у тех же пациенток, что говорит о равномерных декомпенсационных изменениях мышечной ткани, выходящих далеко за пределы стыка рубца и мышцы. Удивительный факт: медиана процентной доли фиброзной деградации области мышцы, расположенной около рубца, у женщин, оперированных по поводу полного выпадения матки, была меньше, чем в группах пациенток с более легкими степенями ПТО, без статистической значимости различий (p > 0,05). Но если у представительниц I группы, оперированных по поводу опущения стенок влагалища, встречались биоптаты с незначительным (10%-м) уровнем фиброза даже около рубца, то при полном выпадении матки ткань m. levator ani в околорубцовой области никогда не была фиброзирована менее чем на треть (min = 30%), а у пациенток, страдавших неполным выпадением матки (группа II), доля деградации всегда составляла более половины гистологического среза (min = 50%). У пациенток II группы обнаружено самое значительное фиброзирование в области рубца.
У всех пациенток посттравматические рубцы на промежности находились справа от задней спайки, что характерно для акушерских травм. Представляет интерес, что у женщин с рубцом на промежности, не имевших выраженного пролапса (I группа), фиброз был одинаково выражен и в области рубца, и слева, и справа от centrum tendineum, то есть развивался независимо от нарушения целости мышечной ткани. Этот же показатель в группах с манифестированным пролапсом характеризовался латерализацией вправо: во II и III группах фиброз был больше выражен со стороны акушерской травмы, чем с контрлатеральной стороны — слева от задней спайки (p < 0,05). Во всех группах женщины после верифицированной акушерской травмы имели несколько бо́льшую площадь гистологического среза, измененную фиброзом, чем в целом по группе (см. табл. 2).
Отсутствие нормальной морфологической картины без фиброзных включений во всех изученных биоптатах, полученных от пациенток с НМТД, статистически незначимая латерализация фиброзирующего процесса мышечной ткани вправо у женщин с рубцом на промежности и отсутствие линейной зависимости распространенности фиброзной ткани в гистологических срезах от степени тяжести пролапса говорят о том, что процесс фибро-адгезивных изменений развивается задолго до манифестации пролапса, но инициируется акушерской травмой. После манифестации пролапса патологические процессы в тканях тазового дна, видимо, уже не играют ведущей роли в патогенезе ПТО и не оказывают влияния на степень десценции тазовых органов.
ОБСУЖДЕНИЕ
Отсутствие биоптатов без признаков фиброза указывает на наличие дефекта мышечной ткани во всех исследованных случаях, что подтверждает гипотезу о влиянии морфологических изменений мышечной ткани на НМТД и ПТО. Исходя из существующего дефекта мышечной ткани, можно предположить, что запуск патогенетического процесса повреждения и последующей деградации мышечной ткани тазового дна, скорее всего, происходит не только в области акушерской промежности, но и за ее пределами и после определенного временно́го промежутка приводит к НMТД и ПТО.
Возможно, развитие событий определяется скрытой травмой промежности, поиск которой не был задачей данного исследования. Такой травмой можно было бы объяснить деградацию мышечной ткани даже у пациенток без рубца на промежности.
Фиброзирующий процесс, выявленный у женщин с травмами промежности со стороны, контрлатеральной этим травмам, при той же степени распространения, свидетельствует об анатомическом единстве всего тазового дна. Таким образом, локально возникшая травма промежности лишь запускает деградацию, а декомпенсационным атрофическим изменениям подвергается весь мышечный пласт тазового дна. Возможно, развитие тотальной деградации мышц промежности является процессом симметричного формирования грыжевых ворот — продрома манифестированного ПТО.
По нашему предположению, отсутствие связи между группами исследования, которые, по сути, представляли разные степени пролапса, и площадью фиброза (p > 0,05) указывает на то, что процесс деградации мышечной ткани запускается задолго до первых проявлений ПГ. Это косвенно подтверждает также отсутствие корреляции между площадью фиброза и возрастом пациенток.
В основе патогенеза генитального пролапса лежит прогрессирование фиброзно-адгезивной деформации мышц леваторного комплекса. Об этом свидетельствует умеренное и выраженное распространение фиброза во всех группах исследования, чего не наблюдалось у женщин без пролапса.
ЗАКЛЮЧЕНИЕ
Дальнейшее исследование мышечной структуры тазового дна с более широким применением визуализационных диагностических методов для определения дефекта мышечной ткани поможет выявить все звенья патогенеза пролапса тазовых органов, что, в свою очередь, облегчит решение задач, связанных с профилактикой и лечением заболевания.
Поступила: 16.03.2020
Принята к публикации: 18.06.2020








