ВВЕДЕНИЕ
Несмотря на значительные успехи в организации лечебного процесса и медицинского наблюдения женщин репродуктивного возраста, терапия вагинальных инфекций (ВИ) остается актуальной проблемой, периодически требуется ее коррекция[1]. В настоящее время ВЗОМТ выявляются у 50–65% женщин репродуктивного возраста, и их частота не имеет тенденции к снижению.
Значительную роль в формировании ВЗОМТ играют ИППП, при этом дисбиозы (бактериальный вагиноз (БВ), урогенитальный кандидоз), неспецифические вагиниты, цервициты встречаются чаще, чем инфекции, вызываемые абсолютными патогенами[2].
Высокая распространенность ВИ среди всех ВЗОМТ является серьезной проблемой современной гинекологии[3–5]. К развитию клинических проявлений ВИ приводит нарушение динамического равновесия в саморегулирующейся экосистеме женских половых органов[6, 7]. Нарушение микробиоценоза влагалища связано с дисбалансом физиологического взаимодействия микроорганизмов во влагалищном биотопе и развитием дисбиоза, в результате чего увеличивается концентрация аэробных и анаэробных микроорганизмов и прогрессивно уменьшается концентрация лактобацилл, что приводит к снижению содержания молочной кислоты, кислотности влагалищного содержимого и росту числа анаэробов[3, 8, 9].
Лактобактерии играют ключевую роль в формировании нормальной вагинальной среды, и их количество зависит от состояния вагинального эпителия, которое напрямую связано с составом микрофлоры, а она, в свою очередь, реализует несколько механизмов, предохраняющих от инвазии или избыточного роста патогенов[2, 6].
Экологическая толерантность — способность организмов определенного биоценоза вынести колебания внешних факторов. Факторами нарушения экологической толерантности влагалищного биотопа и локального иммунитета являются активная сексуальная жизнь, использование гормональных, внутривлагалищных и внутриматочных контрацептивов, соматические и эндокринные заболевания, антибактериальная и иммуносупрессивная терапия, нарушение гигиены и недостаточность мышц тазового дна, что приводит к развитию воспалительного процесса, который проявляется непосредственно (в повреждении клеток инфекционным агентом) и опосредованно (путем выделения экзо- и эндотоксинов)[10].
Развитие ВИ как воспалительного, так и невоспалительного генеза нередко вызывает сочетанное воздействие двух патогенных факторов: БВ и вульвовагинального кандидоза (ВВК)[11–13]. При этом наличие смешанных форм инфекции затрудняет диагностику и лечение патологического процесса, что часто приводит к увеличению частоты его рецидивирования[13–15]. Не вызывает сомнения тот факт, что нарушения микроценоза влагалища способствуют возникновению инфекционных осложнений после хирургических вмешательств на органах малого таза, воспалительных заболеваний внутренних половых органов, внутриутробной инфекции у беременных[16].
С учетом полимикробного характера ВИ рациональность антимикробной терапии под вопросом, поскольку ее обязательными условиями являются элиминация возбудителя, безопасность, восстановление нарушенного микроценоза влагалища, что в итоге должно обеспечить нормальный титр лактобацилл с сохранением их функциональной активности и воспрепятствовать развитию суперинфекции[13, 17, 18].
Для терапии в подобных случаях могут применяться различные комбинированные препараты, губительно воздействующие как на патогенную бактериальную, так и на грибковую флору. В качестве такого медицинского средства идеально подойдет препарат в виде вагинальных свечей, содержащий метронидазол 750 мг, миконазол нитрат 200 мг и лидокаин 100 мг (Нео-Пенотран® Форте Л), компоненты которого устраняют причины возникновения БВ и ВВК, обладают антибактериальным, противогрибковым, противопротозойным и местным анестезирующим эффектом.
Для того чтобы быстро подавить микробиоценоз влагалища, требуется широкий спектр препаратов. Это вызвано прежде всего обилием видов бактерий, вирусов и грибов, которые наблюдаются на слизистой в период острой фазы заболевания. Как следствие, трудно переоценить важность принятия действенных профилактических и терапевтических мер перед операционным лечением, а также после трансвагинальных инвазивных процедур[19].
Таким образом, в настоящее время не ослабевает интерес к проблеме лечения ВИ, особенно при подготовке пациенток к гинекологическим операциям, что связано с высокой частотой встречаемости заболевания, рецидивирующих процессов, сложностями терапии и появлением новых лекарственных форм и подходов к лечению, с необходимостью предотвращения инфекционно-воспалительных осложнений в послеоперационном периоде.
Цель исследования: усовершенствовать подходы к лечению ВИ у пациенток в предоперационном периоде хирургических вмешательств на органах малого таза.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе гинекологического отделения ГБУЗ «Городская клиническая больница имени И.Ф. Иноземцева ДЗМ» с 10.01.2018 г. по 30.04. 2018 г.
В когортное проспективное сравнительное исследование включены 78 пациенток, направленных в гинекологический стационар на оперативное лечение по поводу миомы матки.
По риску реализации инфекционно-воспалительных осложнений и тактике ведения участниц разделили на три когорты. Первую группу (контрольную) составили 16 женщин с нормальной микрофлорой влагалища по результатам рН-метрии влагалищной жидкости, бактериоскопического и бактериологического исследования отделяемого из половых путей и диагностики инфекций методом ПЦР; они не получали лечение. Во вторую группу вошли 42 пациентки с БВ, которые получали терапию препаратом молочной кислоты (5 дней), затем Нео-Пенотран Форте Л (7 дней) с последующим назначением препарата молочной кислоты (5 дней), в третью группу — 20 пациенток со смешанным вагинитом (СВ), у которых диагностировали ВВК и БВ, они получали Нео-Пенотран Форте Л (7 дней).
У всех участниц исследования проведены стандартные клинические, лабораторные и инструментальные исследования.
Клинико-анамнестический метод — изучение жалоб, гинекологического анамнеза, особенностей течения вагинальных родов. У всех женщин оценивали соматический статус с использованием визуальных и физикальных методов.
Клиническое лабораторное обследование включало клинический и биохимический анализы крови, общий анализ мочи, коагулограмму, определение группы крови и резус-фактора, рН-метрию влагалищной жидкости, бактериоскопическое, бактериологическое исследование отделяемого из половых путей, диагностику инфекций методом ПЦР для видовой идентификации и количественного анализа анаэробной и аэробной микрофлоры влагалища.
Результаты исследований оценивали до, через 14, 30 и 90 дней терапии.
Всем 78 пациенткам проведено хирургическое лечение по поводу миомы матки. Произведены лапароскопическая и вагинальная миомэктомия, гистерорезектоскопия.
Критерием эффективности терапии с клинических позиций являлось купирование симптомов основного заболевания. Под лабораторной эффективностью понимали снижение рН влагалищной жидкости, увеличение количественного содержания лактобактерий и уменьшение количества патогенных и условно-патогенных микроорганизмов, определяемых микроскопическим, бактериологическим исследованием и количественной ПЦР, а также отсутствие инфекционно-воспалительных осложнений в послеоперационном периоде в течение 90 дней после хирургического вмешательства.
Случаи прогрессирования клинических симптомов и ухудшения клинической и лабораторной картины заболевания по окончании лечения расценивались как его клиническая неэффективность.
Безопасность и переносимость препаратов оценивали на основе регистрации нежелательных явлений, сопутствующих заболеваний и лабораторных показателей.
Данные подвергали статистической обработке с использованием пакета программ Statistica 12,0; SPSS. Использовали метод описательной статистики с определением среднего арифметического, дисперсии, стандартного отклонения, 95%-ного ДИ. Достоверность различий определяли с помощью непараметрического U-критерия Манна — Уитни. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
В ходе исследования получены данные об анамнезе, особенностях оперативного вмешательства и течении послеоперационного периода.
При первичном обращении пациентки второй и третей групп жаловались на влагалищные выделения, почти всегда с неприятным запахом. Зуд, жжение, диспареуния и дизурия были более выражены у пациенток третей группы, чем у больных второй группы (p < 0,05) (табл. 1). У участниц первой группы подобные жалобы отсутствовали.
Таблица 1
Жалобы пациенток с бактериальным вагинозом (БВ) и смешанным вагинитом (СВ), n (%)
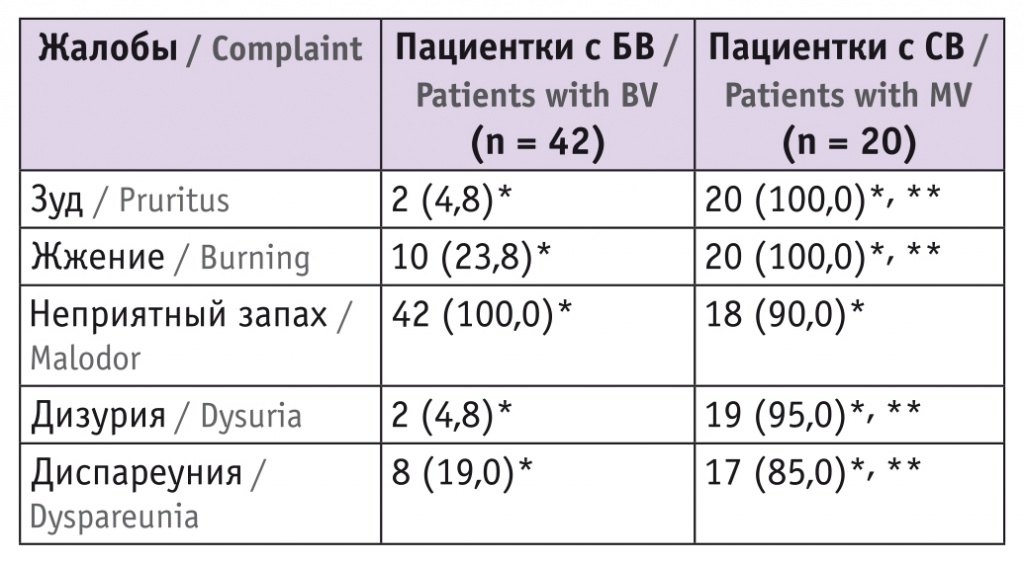
* Отличия от контрольной группы статистически значимы (p < 0,05).
** Отличия от группы БВ статистически значимы (p < 0,05).
Всем пациенткам второй группы с БВ, даже при отсутствии жалоб на зуд и жжение, назначался Нео-Пенторан Форте Л, поскольку их длительное время беспокоил неприятный запах из половых путей, при бактериоскопическом исследовании выявлялись ключевые клетки, при бактериологическом исследовании — Gardnerella vaginalis, что свидетельствовало о нарушении состояния вагинального эпителия, которое напрямую связано с составом микрофлоры. Поэтому с целью предотвращения возможности появления нежелательных явлений, таких как зуд, жжение, а также для использования одного препарата в проведенном исследовании назначался препарат Нео-Пенотран Форте Л.
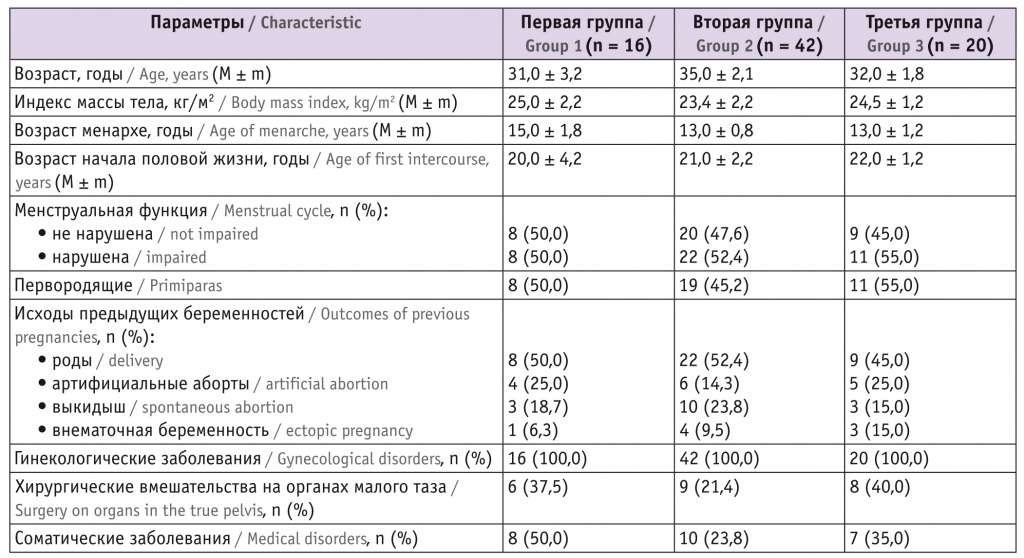
Возраст обследуемых пациенток составил от 28 до 38 лет при среднем значении 32 ± 2,1 года. При анализе медико-социальной характеристики групп не выявлены статистически значимые различия в возрасте менархе, показателях, характеризующих менструальную функцию, в ИМТ, частоте гинекологических и соматических заболеваний, количестве беременностей и их исходах (табл. 2).
Таблица 2
Медико-социальная характеристика пациенток
При анализе результатов микроскопического исследования отделяемого из половых путей у пациенток первой группы доминировали лактобактерии, отсутствовали грамотрицательная микробиота, споры, мицелий и псевдогифы. У женщин второй группы отмечалось малое количество лактобацилл, выявлялись ключевые клетки, единичные лейкоциты в поле зрения. У пациенток третей группы найдены большое количество лейкоцитов, ключевые клетки и мицелий. Согласно рН-метрии влагалищной жидкости, у пациенток первой группы показатель рН составил 4,1 ± 1,3, второй — 4,8 ± 0,3, третьей — 5,8 ± 1,3.
Результаты бактериологического исследования показали, что у пациенток первой группы Gardnerella vaginalis и факультативно-анаэробные бактерии встречались в количествах, не превышающих 103–104 КОЕ/мл. У участниц второй группы преобладала Gardnerella vaginalis, а в третье группе — смешанная полиморфная флора (табл. 3). При оценке результатов бактериологического исследования до и после лечения принимались во внимание только те микроорганизмы, КОЕ/мл которых превышали 104.
Таблица 3
Результаты бактериологического исследования у пациенток с бактериальным вагинозом (БВ) и смешанным вагинитом (СВ), n (%)
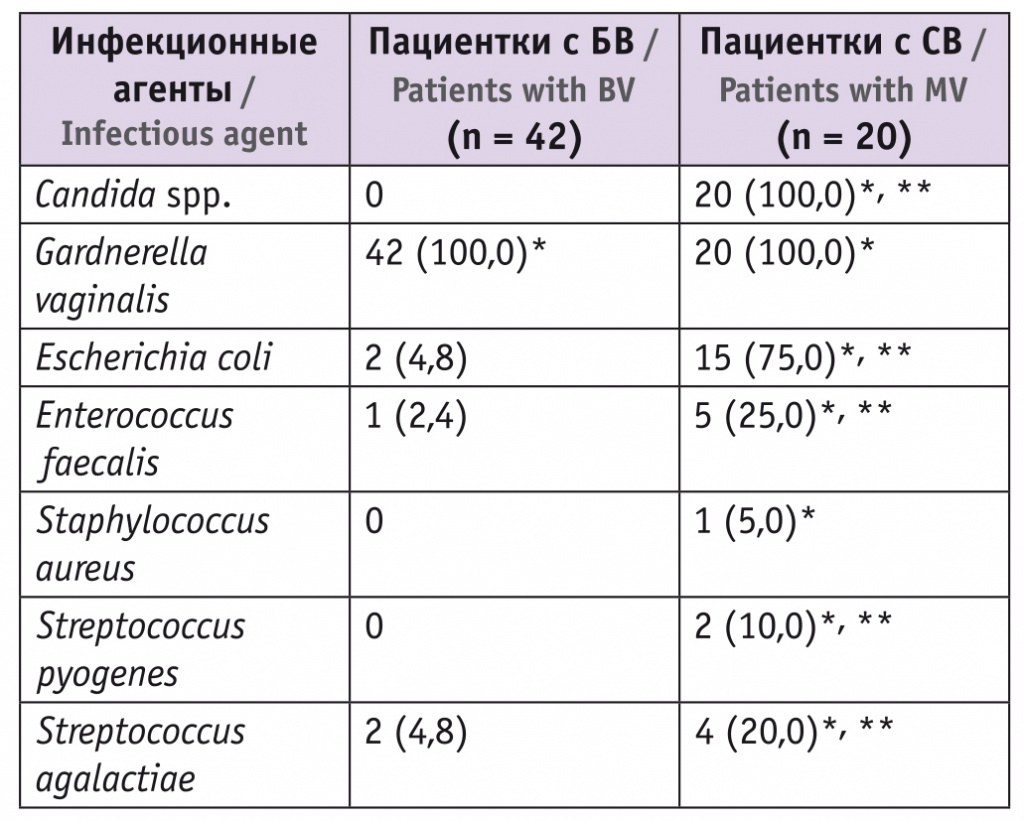
* Отличия от контрольной группы статистически значимы (p < 0,05).
** Отличия от группы БВ статистически значимы (p < 0,05).
Оценку эффективности лечебных мероприятий проводили с учетом динамики жалоб, клинической картины заболевания, лабораторных критериев и наличия послеоперационных инфекционно-воспалительных осложнений спустя 14, 30 и 90 суток после окончания лечения.
Спустя 14 суток после окончания лечения пациентки второй и третьей групп жалоб не предъявляли, у двух пациенток второй группы жалобы появились спустя 30 дней после терапии, у одной пациентки третей группы — спустя 90 дней (табл. 4).
Таблица 4
Динамика жалоб пациенток с бактериальным вагинозом (БВ) и смешанным вагинитом (СВ) в ходе лечения, n (%)
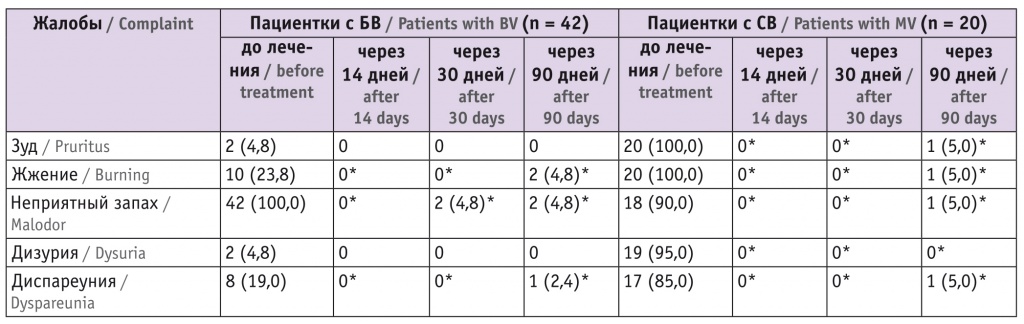
* Отличия от исходного значения статистически значимы (p < 0,05).
При анализе микроскопии отделяемого из половых путей спустя 14 суток после окончания лечения у пациенток второй группы отмечалось увеличение количества лактобацилл, ключевые клетки не выявлялись, были единичные лейкоциты в поле зрения. Данная картина сохранялась спустя 30 и 90 суток у 40 (95%) женщин, рецидив БВ диагностирован спустя 3 месяца после окончания лечения у 2 (4,8%) пациенток.
У участниц третей группы при микроскопии лейкоцитов было 10–15 в поле зрения, спустя 14 и 30 суток после окончания лечения у 20 (100%) женщин не визуализировались ключевые клетки и мицелий, спустя 90 суток у 1 (5%) пациентки диагностировался рецидив заболевания.
рН-метрия влагалищной жидкости показала, что у 40 (985%) пациенток второй группы рН составил 4,1 ± 0,3 спустя 30 и 90 суток после окончания лечения, у 19 (95%) больных третьей группы — 4,2 ± 0,2.
По данным бактериологического исследования (табл. 5), в группе БВ значение обсемененности составило не более 103 КОЕ/мл в течение всего периода наблюдения, Gardnerella vaginalis выявилась лишь спустя 90 суток после окончания лечения у 2 (4,8%) пациенток. В группе СВ значение обсемененности составило не более 105 КОЕ/мл, грибы рода Candida не обнаружены спустя 14 и 30 суток после окончания лечения, у одной пациентки через 90 суток выявлены грибы рода Candida, Gardnerella vaginalis и Enterococcus faecalis.
Таблица 5
Результаты бактериологического исследования у пациенток с бактериальным вагинозом (БВ) и смешанным вагинитом (СВ) до и после лечения, n (%)
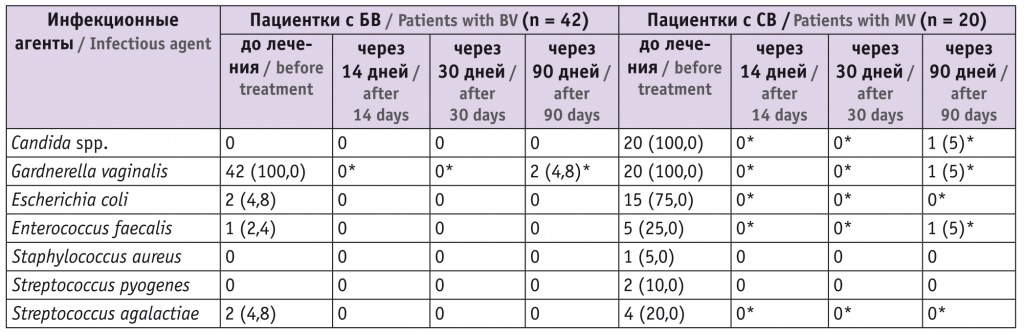
* Отличия от исходного значения статистически значимы (p < 0,05).
Спустя 14 дней после окончания терапии и после получения удовлетворительных результатов лабораторных анализов проведено хирургическое лечение всех участниц по поводу миомы матки лапароскопическим, вагинальным доступом и гистерорезектоскопия. В раннем и позднем послеоперационном периоде у всех 78 пациенток отсутствовали инфекционно-воспалительные осложнения.
Осложнений, значимых побочных эффектов, состояний, связанных с ухудшением здоровья, не было ни у одной из 62 женщин, получавших Нео-Пенотран Форте Л.
ОБСУЖДЕНИЕ
К настоящему времени стало известно, что микробиоценоз влагалища — динамическая и гораздо более сложная экосистема, чем считали ранее, но самое главное — состояние микрофлоры генитальной области самым серьезным образом влияет на здоровье женщины в целом[6].
Несмотря на научно-технический прогресс, попытки найти единственного возбудителя БВ и неспецифических вагинитов оказались нерезультативными. В последнее время появляется все больше свидетельств, что БВ и неспецифические вагиниты вызваны разбалансировкой всей вагинальной экосистемы, как в составе и структуре микробных сообществ влагалища, так и в количестве бактерий[20].
К группе риска развития ВИ относят пациенток, в анамнезе которых присутствуют перенесенные ВЗОМТ, нарушения менструального цикла, фоновые заболевания шейки матки, длительное использование внутриматочных контрацептивов, а также женщин, нерационально применявших антибактериальные препараты. По данным литературы, ВИ, вызванные сочетанным воздействием двух и более пaтогенных факторов, встречаются у 30% пациенток. Наличие смешaнных форм инфекции затрудняет диaгностику и лечение заболевания[21].
В нашем исследовании нормальная микрофлора влагалища выявлена у 16 из 78 пациенток, готовящихся к оперативному лечению. Этот факт указывает на необходимость детального обследования женщин в предоперационном периоде для идентификации состава вагинальной микрофлоры.
Эффективность лечения ВИ определяют точное выявление возбудителя и назначение этиотропной терапии. Приемлемость препарата, использование единой лекарственной формы для лечения кандидозной, бактериальной и трихомонадной инфекций будет идеальным вариантом терапии. К наиболее безопасным местным препаратам, обладающим широким спектром активности, относится Нео-Пенотран Форте[20].
В исследовании установлено, что эффективность и безопасность рассмотренного препарата Нео-Пенотран Форте Л в борьбе с БВ и СВ не вызывают сомнений. Главное преимущество препарата состоит в возможности его применения в терапии вагинитов, при этом степень поражения бактериями и природа воспалительного процесса не имеют значения, потому что препарат помогает справиться даже со смешанными инфекциями, не вызывая осложнений.
Нео-Пенотран Форте можно назначать при обнаружении начальных клинических проявлений ВИ вне зависимости от вида возбудителя и формы инфекции (моно- или смешанной), поскольку нет необходимости дожидаться результатов микробиологического исследования для подбора этиотропного лечения[12].
По данным различных авторов, эффективность препарата Нео-Пенотран Форте в отношении БВ составляет 89,5–95,2%, кандидозного вульвовагинита — 86,4–97,6%, трихомониаза — 80–86,4%[21–24].
Клинические испытания показали высокую эффективность препарата Нео-Пенотран Форте Л в подготовительном периоде, предшествующем гинекологическим операциям.
Российские исследователи продемонстрировали высокую эффективность применения в гинекологической практике нового препарата Нео-Пенотран Форте Л[19, 25]. Он содержит анестетик лидокаин, который оказывает быстрое обезболивающее действие, что особенно важно при ярко выраженных симптомах зуда, жжения и боли при ВИ. Препарат используют при лечении БВ, острых вагинитов различной, в т. ч. смешанной, этиологии, перед хирургическими вмешательствами в качестве санации и местного обезболивания у небеременных женщин.
Использование НеоПенотран Форте Л при подготовке к оперативному лечению у пациенток с инфекционно-воспалительными заболеваниями женских половых органов способствовало нормализации влагалищной флоры и эффективному восстановлению эпителия стенок влагалища после хирургических вмешательств[19]. Данные нашего исследования свидетельствуют об отсутствии инфекционно-воспалительных осложнений в раннем и позднем послеоперационном периоде.
ЗАКЛЮЧЕНИЕ
Большой процент выздоровления после одного курса лечения и довольно низкий процент рецидива в нашем исследовании (не более 5%) позволит рекомендовать НеоПенотран Форте Л для терапии бактериального вагиноза и смешанного вагинита, в том числе одновременно с лечением сопутствующего заболевания за счет отсутствия клинически значимого взаимодействия препарата с другими лекарственными средствами, что указано в инструкции по применению.
Поступила: 09.04.2020
Принята к публикации: 27.04.2020








