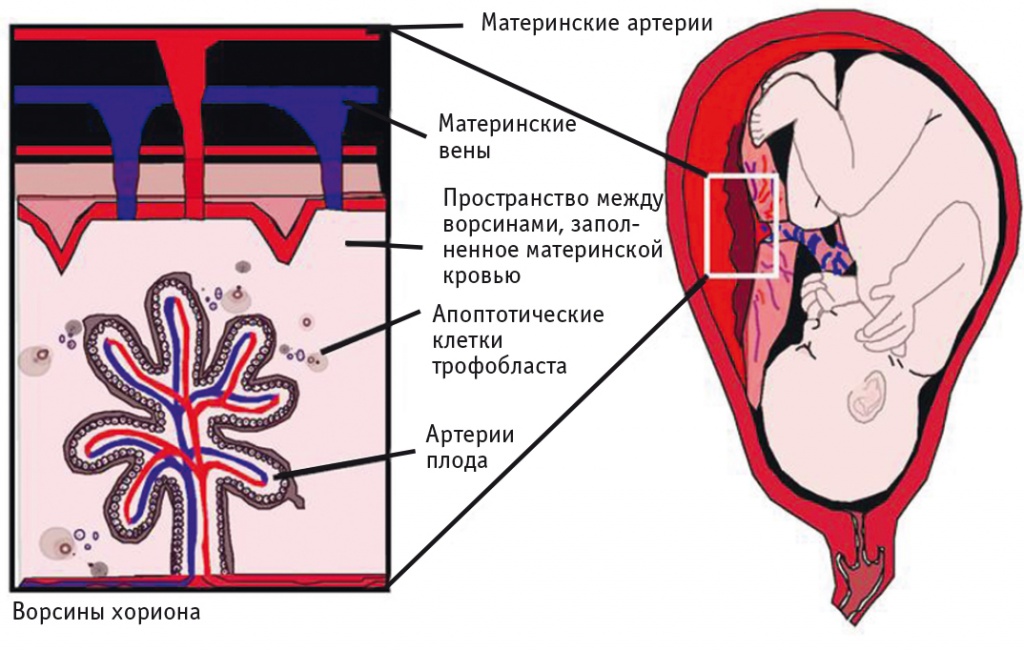
На рубеже веков возникло новое направление пренатальной диагностики, более надежное и безопасное для здоровья плода и матери, чем традиционные методы. Это направление, названное неинвазивной пренатальной диагностикой (НИПД), бурно развивается с конца 1990-х гг. [4]. НИПД основана на анализе плодного материала, проникающего в материнский кровоток (рис. 1).
Рис. 1. Механизм миграции генетического материала плода в кровоток матери [5]
Сегодня несколько разработок по НИПД доступны в качестве услуг для пациентов. В первую очередь это анализ внеклеточной фетальной ДНК (вкфДНК) для определения хромосомных аномалий плода [6], выполняемый на базе технологий Next-Generation Sequencing (NGS) — секвенирования нового поколения [12] или масс-спектрометрии [7]. Ввиду технической сложности и высокой стоимости оборудования такие технологии недоступны широкому кругу лабораторий, поэтому во всем мире лишь некоторые лаборатории предлагают исследования на основе NGS в виде услуг.
Однако такие анализы, как определение пола плода при риске заболеваний, сцепленных с полом, и резус-фактора плода у резус-отрицательных беременных, можно выполнять в условиях стандартно оснащенной клинической ПЦР-лаборатории с помощью коммерческих наборов реагентов. Благодаря сравнительно низкой цене наборы реагентов для ПЦР в режиме реального времени (ПЦР-РВ) доступны для многих учреждений, и такой анализ можно внедрить в широкую практику. Определение пола плода полезно при обосновании специальной терапии на этапе внутриутробного периода, например для лечения такого эндокринного расстройства, как врожденная дисфункция коры надпочечников [19]. Показано, что в качестве маркера половой принадлежности плода может выступать ген SRY: его присутствие в плазме крови беременной говорит о беременности мальчиком, а отсутствие — девочкой.
В некоторых странах успешно внедрена программа по диагностике резус-фактора плода для всех резус-отрицательных беременных [18]. Актуальность таких программ обусловлена высоким удельным весом (около 15%) людей с отрицательным резус-фактором среди населения североевропейского происхождения, соответственно у 15% всех беременных возможен резус-конфликт. Сегодня во многих странах мира, в том числе в России, предполагают «слепое» введение антирезусного иммуноглобулина всем резус-отрицательным женщинам, беременным от резус-положительного мужчины, в профилактических целях для снижения риска гемолитической болезни в текущей и последующих беременностях. Однако, по литературным данным, около 40% резус-отрицательных беременных носят резус-отрицательной плод [1], и в этих случаях рутинный анализ вкфДНК предотвращает излишнее применение антирезусного иммуноглобулина, поскольку профилактика показана только при беременности резус-положительным плодом.
Описанные направления достаточно хорошо развиты и в некоторых клиниках мира уже реализованы в виде услуг. Однако их распространение существенно ограничено тем, что на рынке практически нет наборов реагентов, пригодных для анализов в клинической лаборатории. Доступны лишь услуги с использованием тестов, что сопряжено с дополнительной, зачастую сроком не менее 3–5 дней, транспортировкой образца материнской крови или плазмы крови, а значит, снижением качества материала, увеличением срока выполнения анализа и его итоговой цены.
В данной статье представлены результаты мультицентровых испытаний наборов реагентов «Тест-SRY» и «Тест-RHD» для определения пола и резус-фактора плода.
Цель работы: установить прогностические характеристики определения пола и резус-фактора плода на ранних сроках гестации по крови беременной.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено многоцентровое исследование, обобщившее данные 13 государственных и частных лабораторий России, Украины и Казахстана за 2013–2015 гг. Получены результаты определения гена SRY (пола плода) в плазме крови 1423 беременных и гена RHD (резус-фактора плода) — в образцах 1680 резус-отрицательных беременных, при этом отрицательный резус-фактор у беременных определяли серологически. Все женщины подписали информированное согласие на выполнение исследований. Во всех случаях были доступны результаты определения пола или резус-фактора рожденного ребенка. Все включенные в исследование женщины имели одноплодную беременность, подтвержденную УЗИ на момент обследования. Молекулярно-генетический анализ проводили на сроках от 10 до 30 недель гестации.
Свежие образцы венозной крови собирали в пробирки объемом 8 мл с ЭДТА-антикоагулянтом, плазму крови отделяли от клеток с помощью центрифугирования при низкой скорости: 500–3000 g в течение 10 мин с последующим разделением плазмы и фрагментов клеток путем центрифугирования при 16000 g в течение 15 мин. Во избежание деградации вкфДНК, а также с целью сокращения в плазме крови доли материнской ДНК, высвобождающейся при лизисе лейкоцитов, эти процедуры проводили не позднее чем через 24 ч с момента взятия крови. Плазму крови отбирали в стерильные пробирки, свободные от ДНК, после чего выделяли вкфДНК.
Из всех образцов плазмы крови участниц исследования была выделена вкфДНК с помощью наборов «ДНК-Плазма-2» или «ДНК-Плазма-М» (ООО «ТестГен», Россия) либо с использованием наборов «ДНК-Сорб-B» (ООО «Интерлабсервис», Россия) по модифицированной методике.
Ввиду сложности генетического кодирования резус-фактора крови и существования нескольких генетических механизмов, приводящих к резус-отрицательному фенотипу, с целью повышения специфичности анализа ПЦР-РВ проводили по трем разным участкам гена RНD (экзонам 6, 7, 10) с помощью набора «Тест-RHD». Набор содержит все необходимые для реакции буферные растворы, ферменты, дезоксинуклеотидтрифосфаты (ДНТП), специфические праймеры для амплификации каждого из выбранных экзонов и специфичные для них флуоресцентно-меченые зонды. ПЦР-РВ осуществляли в различных амплификаторах (ДТprime и ДТlite производства «ДНК-Технология», Россия, IQ5 и CFX96 от Bio-Rad, США, Rotor-Gene 6000 от Corbett Life Science, Австралия). Параллельно ставили реакцию амплификации гена GAРDH с целью контроля выделения ДНК и прохождения ПЦР. Отрицательный и положительный контрольные образцы, присутствующие в наборе «Тест-RHD», анализировали при каждой постановке.
Аналогично детекции гена RНD, с помощью набора «Тест-SRY» в полученных образцах вкфДНК определяли ген SRY — маркер Y-хромосомы. Набор также содержит все необходимые для реакции буферные растворы, ферменты, ДНТП, специфические праймеры и флуоресцентно-меченые зонды для гена SRY. ПЦР-РВ проводили в указанных выше амплификаторах. Параллельно ставили амплификацию участка гена GAРDH с целью контроля выделения ДНК. Отрицательный и положительный контрольные образцы, присутствующие в наборе «Тест-SRY», анализировали при каждой постановке.
После родов пол новорожденного определяли визуально, резус-фактор — серологически. Затем эти данные сравнивали с результатами исследования вкфДНК во время беременности. Несовпадающие результаты фиксировали.
РЕЗУЛЬТАТЫ
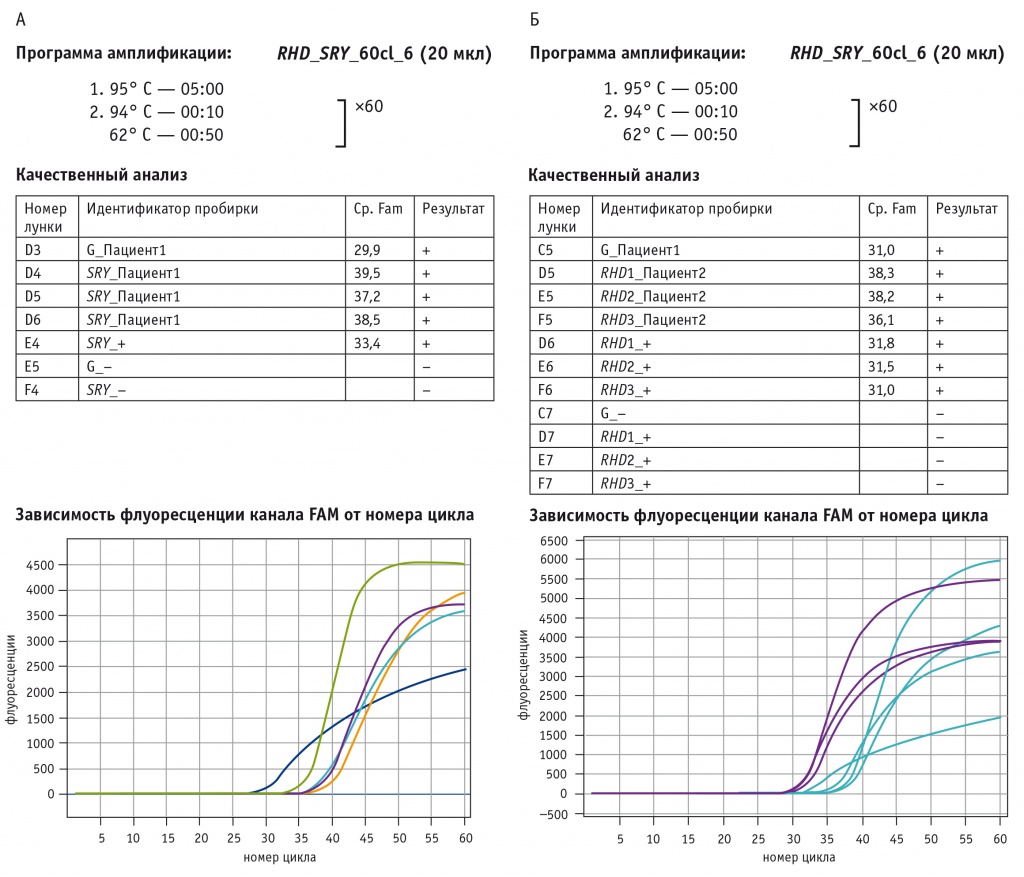
Пример результатов исследования, отвечающих всем необходимым параметрам верного прохождения реакций, приведен на рисунке 2.
Рис. 2. Примеры положительных результатов полимеразной цепной реакции в режиме реального времени: а — «Тест-SRY», б — «Тест-RHD»
В таблице 1 приведены сводные результаты анализов, полученные в различных лабораториях.
Таблица 1
Результаты анализа образцов для определения пола и резус-фактора плода в различных лабораториях и количество несовпадений
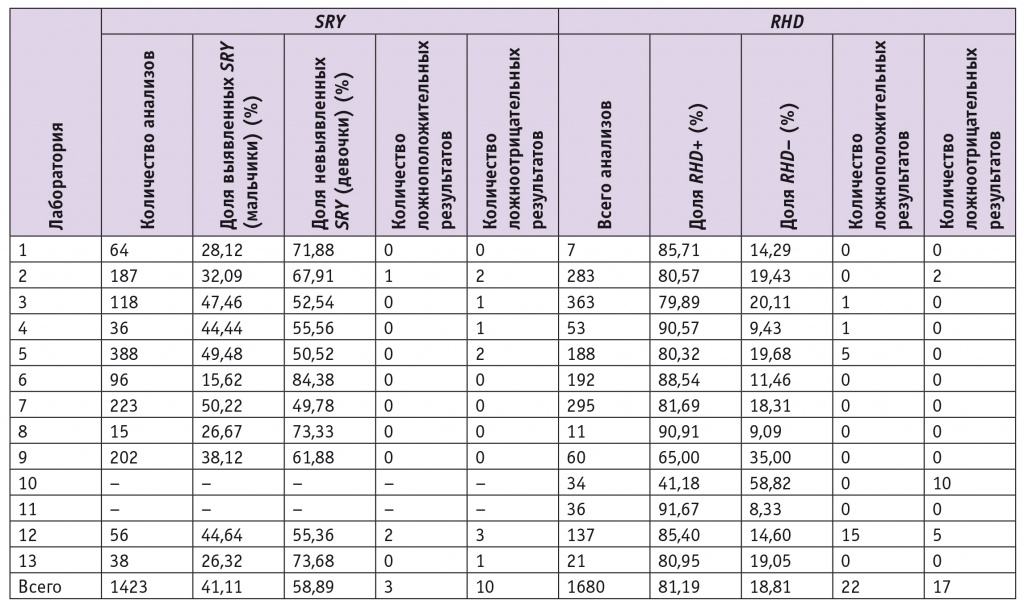
Из 1423 образцов, проанализированных по полу плода, ген SRY выявлен в 585 (41,11%) наблюдениях и не выявлен в 838 (58,89%). При исследовании резус-фактора в 1364 (81,19%) из 1680 образцов определен положительный резус-фактор и в 360 (18,81%) — отрицательный.
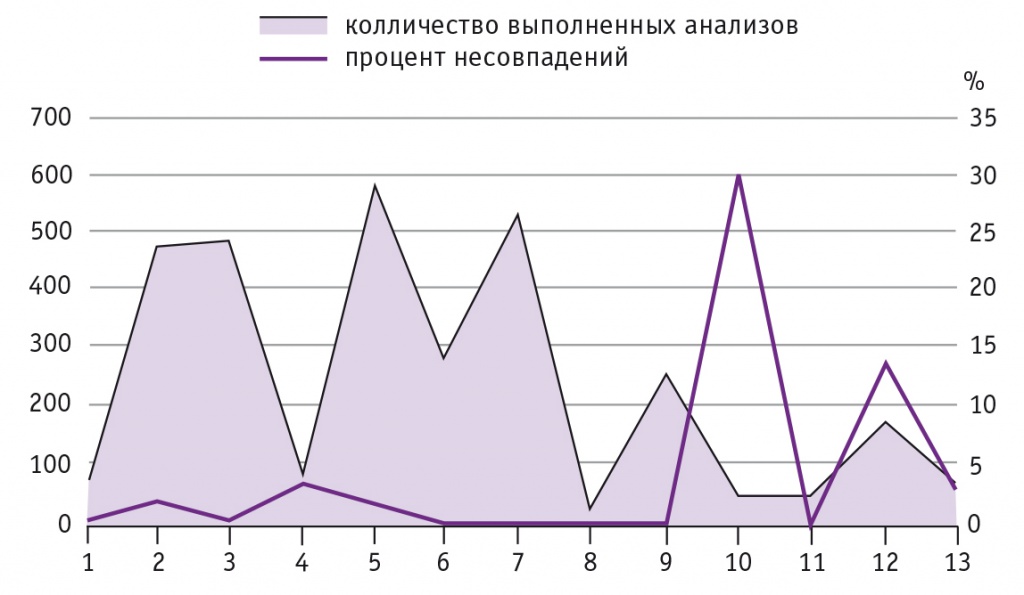
Зафиксировано несколько несовпадений (ложноположительных и ложноотрицательных результатов). Стоит отметить, что среди лабораторий, выполнявших анализ, количество несовпадений распределяется крайне неравномерно. На рисунке 3 количество выполненных анализов сопоставлено с процентной долей несовпадений (суммированы ложноотрицательные и ложноположительные результаты). Только в двух лабораториях наблюдается нетипично высокое количество ошибок.
Рис. 3. Выполненные анализы и процентная доля несовпадений результатов по лабораториям
Тем не менее для расчета диагностических характеристик методов были использованы данные, полученные во всех лабораториях, без отклонения нетипичных данных. Результаты приведены в таблице 2.
Таблица 2
Диагностические характеристики методов по определению генов SRY и RHD в крови беременных с учетом нетипичных данных
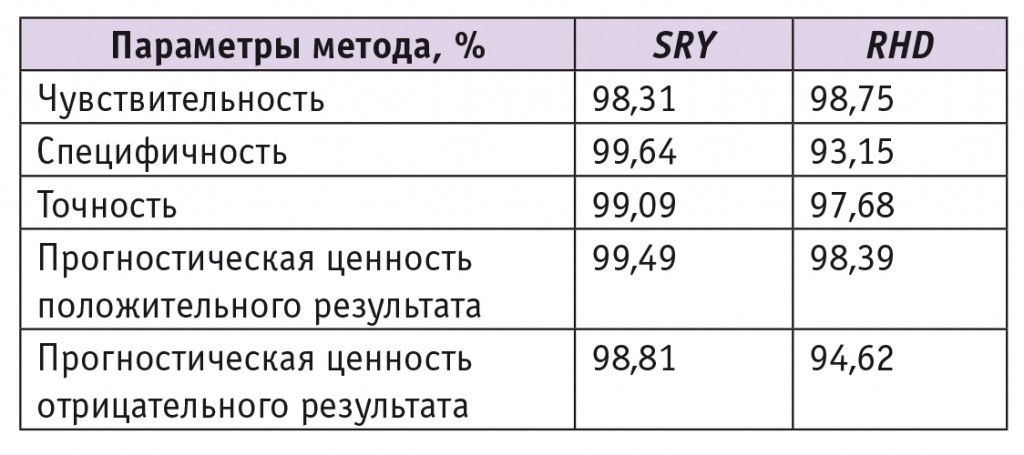
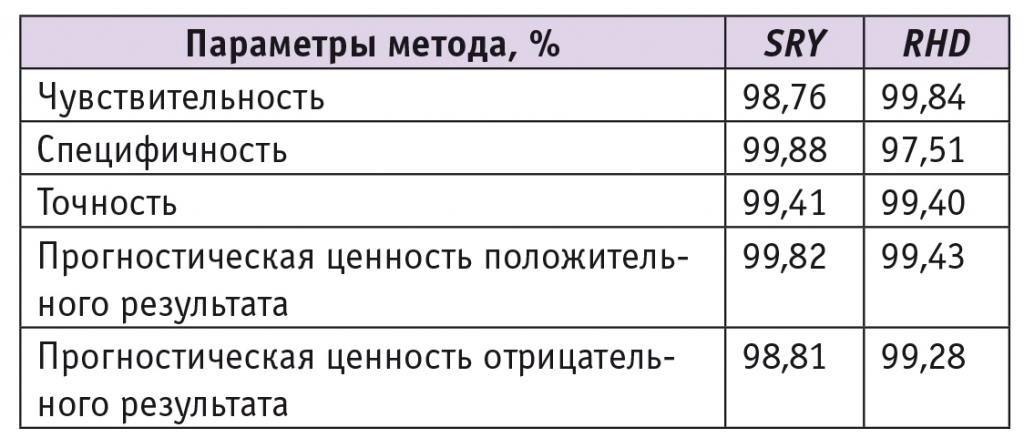
Результаты без учета лабораторий 10 и 12, получивших нетипично высокое относительное количество несовпадающих результатов, приведены в таблице 3.
Таблица 3
Диагностические характеристики методов по определению генов SRY и RHD в крови беременных с исключением лабораторий, получивших нетипично большое количество несовпадений
ОБСУЖДЕНИЕ
В России не зафиксировано тенденции к снижению количества беременных женщин с резус-сенсибилизацией. В год регистрируют около 270 тыс. беременных с отрицательным резус-фактором [2, 3]. Такая острая ситуация диктует необходимость разработки стратегии мониторинга и профилактики резус-конфликта матери и ребенка. Основываясь на последних достижениях науки и зарубежном опыте, следует включать в стандартное тестирование определения резус-фактора плода у беременных с отрицательным резус-фактором. При этом выбранные методики должны отличаться высокими показателями чувствительности и специфичности. Важно отметить, что наборы для ПЦР-анализа не могут обеспечить достаточной точности исследований без соблюдения условия качественного выделения ДНК из плазмы крови. В среднем доля вкфДНК составляет 3,4% тотальной ДНК, выделенной из плазмы крови беременной на сроке от 10 до 17 недель. Этого количества вкфДНК достаточно для молекулярно-генетического анализа. К концу II триместра количество фетальной ДНК нарастает и достигает 6,2% [13, 14]. Следует принимать во внимание усредненное значение приведенных показателей, что не исключает вероятности индивидуально низкой концентрации вкфДНК в крови беременной. В случае изначально низкого уровня фетальной ДНК возможна ситуация, когда в пробирку для ПЦР-амплификатора попадают буквально единичные молекулы ДНК или не попадают совсем.
Таким образом, если на этапе пробоподготовки ДНК не выделена или выделена неаккуратно, то ПЦР не идет. По этой причине для устранения проблем, связанных с низкой концентрацией ДНК, в наборах «Тест-SRY» использован подход с постановкой трех дублей реакций, а в наборах «Тест-RHD» — трех разных экзонов гена RHD. Данное решение позволяет в 3 раза снизить вероятность ложноотрицательного результата. Кроме того, для оценки качества выделения ДНК и минимизации вероятности ложноотрицательных результатов в наборы включены реагенты для определения гена GAPDH. Ген GAPDH считается геном «домашнего хозяйства» и всегда присутствует в плазме крови [20].
Следует отметить, что для клинико-диагностических ПЦР-лабораторий методики работы с вкфДНК новы и непривычны в первую очередь из-за того, что для выделения ДНК необходим большой объем плазмы крови. Следовательно, на этапе внедрения метода в лаборатории возможны ошибочные результаты, количество которых со временем снижается. По данным настоящего исследования, процентная доля несовпадающих результатов очень низка в лабораториях, которые предоставили данные после этапа отработки методики, и высока среди выполнивших мало анализов.
Полученные нами данные по диагностическим характеристикам коррелируют с результатами зарубежных исследователей. Так, согласно одному из самых ранних сообщений по этой теме, статье К. Finning и соавт., диагностическая точность выбранной методики составила 97%. В исследование были включены 137 женщин, беременных первым ребенком; авторам удалось достоверно проанализировать вкфДНК только на 11-й неделе беременности [9]. J. M. Minon и соавт. удалось добиться чувствительности методики 98,8%, в исследовании участвовали 563 беременных, и достоверные результаты были получены на сроке от 10 недель беременности [15]. Диагностическая точность 95% была получена и С. González-González и соавт. на сроке 11–16 недель беременности [10].
Согласно литературным данным, а также результатам анализов, диагностическая точность, чувствительность и специфичность методики повышаются с увеличением срока беременности. Это обусловлено ростом количества генетического материала плода в кровотоке матери.
В ходе настоящей работы проанализированы всего 3103 образца плазмы крови беременных. В общей сложности получены 25 (0,81%) ложноположительных и 27 (0,87%) ложноотрицательных результатов. Это сопоставимо с количеством ложноположительных и ложноотрицательных результатов в аналогичных исследованиях. Например, М. Sedrak и соавт. сообщают о двух ложноположительных результатах для методики выявления генотипа резус-фактора плода у 90 резус-отрицательных беременных [16]. По данным С. Sesarini и соавт., чувствительность выбранной ими методики составила 94,4%, специфичность — 75%. Прогностическое значение выявления резус-положительного гена — 85%, в то время как прогностическое значение выявленного резус-отрицательного гена — 90–97,2% [17].
Таким образом, данные, полученные в настоящем исследовании, соответствуют литературным и даже превосходят их.
Ложноположительные результаты можно объяснить тем, что генетически резус-фактор у плода положительный, но функция гена подавлена или ограничена, и серологически этот резус-фактор не определяется. Кроме того, ложноположительные результаты могут свидетельствовать о незрелости антигенной структуры эритроцитов [4].
В аналогичных исследованиях при достаточно большой выборке участников эксперимента авторы выявляли более 2% ложноотрицательных результатов. Это может быть связано с точечными мутациями в гене RHD плода, индивидуально низким уровнем апоптоза клеток плода, деградацией ДНК на этапе выделения или хранения, неустойчивостью продуктов ПЦР и другими факторами [11].
Важность определения резус-фактора плода очевидна. Всем женщинам с резус-отрицательным фактором на сроке 11–17 недель беременности можно провести анализ резус-фактора плода, и лишь при подтверждении резус-положительного фактора надо принимать решение о профилактике антирезусным иммуноглобулином. В Российской Федерации всем резус-отрицательным женщинам, беременным от резус-положительного мужчины, показано введение антирезусного иммуноглобулина на сроке 28 недель беременности и в течение 72 ч после родов, а также после абортов и инвазивных процедур [1].
Стоимость иммуноглобулина достаточно высока, некоторые производители получают его из препаратов донорской крови, что не всегда безопасно для женщин. Кроме того, процедура введения иммуноглобулина может сопровождаться нежелательными побочными эффектами: развитием реакции гиперчувствительности, анафилактическим шоком, артралгиями и др. Только при внедрении пренатального определения резус-фактора плода можно добиться целенаправленной, обоснованной профилактики резус-конфликта, выполняя ее только в случаях беременности резус-положительным плодом.
Настоящее исследование определения пола плода по вкфДНК, выделенной из плазмы материнской крови, при помощи ПЦР-РВ продемонстрировало точность и высокую надежность разработанного метода уже с 10-й недели беременности. Расхождения с данными, полученными после родов, могут быть связаны с различиями в способах выделения ДНК и низкой концентрацией вкфДНК у отдельных беременных.
Присутствие вкфДНК в плазме крови беременных обозначило новый источник материала для пренатального определения пола, так как традиционные инвазивные методы выявления заболеваний, сцепленных с полом, чреваты высоким риском и неприменимы до 11 недель беременности, а по результатам УЗИ пол можно определить лишь с 13-й недели, что связано с формированием наружных половых органов [8].
Следует отметить резко негативное отношение авторов статьи и лабораторий, применяющих методику по определению пола, к селекции плодов по полу с последующим прерыванием беременности. Производитель реагентов «Тест-SRY» рекомендует перед выполнением анализа использовать форму информированного согласия, в которой беременная подписывается, что выполняет этот анализ не в целях прерывания беременности. Кроме этого, лабораториям следует выполнять анализ после 12 недель беременности, когда прерывание беременности без медицинских показаний уже невозможно.
ЗАКЛЮЧЕНИЕ
Пренатальная диагностика резус-фактора плода у резус-отрицательных беременных на основе ПЦР в режиме реального времени (ПЦР-РВ) — простой и надежный метод с высокой чувствительностью и точностью уже на 10-й неделе беременности. Используя данные анализа, а также результаты клинического и лабораторного обследования беременной, врач может принять решение о необходимости профилактического введения антирезусного иммуноглобулина. Методика неинвазивного определения пола ребенка на основе анализа внеклеточной фетальной ДНК, выделенной из плазмы крови беременной, с помощью ПЦР-РВ очень точна, надежна и применима как в целях удовлетворения интереса родителей, так и при необходимости выявления угрозы развития у плода заболеваний, сцепленных с полом.








