Миома матки — наиболее распространенная доброкачественная опухоль женских половых органов [1]. Ее диагностируют у 77% женщин репродуктивного возраста, при этом симптомы фиксируют только у 25% из них. Тот факт, что в большинстве случаев миома матки протекает без клинических проявлений [7], объясняет наличие контраверсий в вопросе лечения бессимптомной миомы.
Согласно современным отечественным [1] и зарубежным [14] клиническим руководствам, при бессимптомном течении миом, за исключением случаев опухолей больших размеров, нет оснований для оперативного вмешательства или медикаментозной терапии. С другой стороны, у пациенток с нереализованной репродуктивной функцией выжидательная тактика стратегически не оправдана [5]. По мнению экспертов, лечение нужно начинать сразу после постановки диагноза, поскольку при пассивном наблюдении заболевание, вероятнее всего, будет прогрессировать [3]. Поэтому большому числу пациенток предлагается медикаментозное или хирургическое лечение миомы даже при отсутствии жалоб для профилактики возможных неблагоприятных репродуктивных последствий.
Определяющим в решении этого спора будет доказательное подтверждение того, что даже бессимптомная миома матки ухудшает репродуктивную функцию, а удаление узлов способно восстановить фертильность. В настоящее время вопрос о влиянии бессимптомной миомы на репродуктивную функцию окончательно не решен. Считается доказанным, что миоматозные узлы, деформирующие полость матки (International Federation of Gynecology and Obstetrics (FIGO) L0–L2) [11], снижают частоту наступления беременности [9, 12], а их удаление улучшает репродуктивные результаты [6]. Субсерозные узлы (FIGO L5–L7), наоборот, не влияют на фертильность, и удаление небольших субсерозных миом не повышает вероятность зачатия [9, 15].
До сих пор окончательно не ясно, оказывают ли какое-либо действие на фертильность небольшие интерстициальные узлы без деформации полости матки (FIGO L3–L5) [11], метаанализ обзора Кокрейн показывает, что удаление таких интерстициальных миом существенно не улучшает репродуктивную функцию [8].
Вопрос о целесообразности миомэктомии при интрамурально и субсерозно расположенных миомах небольших размеров (менее 4–5 см) остается спорным [5]. Соответственно, и вопрос выбора оптимальной лечебной тактики у пациенток с нереализованными репродуктивными планами и бессимптомной миомой без деформации полости матки остается открытым.
Еще один дискутабельный момент — целесообразность и оптимальные схемы послеоперационной адъювантной терапии.
Медикаментозная терапия, направленная на торможение гормональной стимуляции опухоли, используется перед миомэктомией у пациенток с выраженной постгеморрагической анемией для уменьшения кровопотери и размеров матки, а также в случаях, если предполагается, что после лечения возможно будет выполнить операцию менее инвазивным доступом. После миомэктомии адъювантную терапию применяют для предотвращения повторного роста миоматозных узлов. Эффективность пред- и послеоперационного медикаментозного лечения миомы для улучшения репродуктивных результатов до сих пор не изучена.
На момент формирования дизайна данного исследования перспективным методом лекарственного воздействия на миому признана избирательная блокада рецепторов прогестерона, поскольку миома матки может являться прогестерон-зависимым патологическим процессом [1, 3]. Прогестерон стимулирует в клетках лейомиомы выработку факторов роста и ингибитора апоптоза bcl-2. В результате в секреторную фазу цикла экспрессия маркеров пролиферации в клетках лейомиомы повышается, а активность апоптоза снижается. Модуляторы рецепторов прогестерона способны конкурентно связываться с прогестероновыми рецепторами ткани миомы, исключая таким образом влияние эндогенного прогестерона.
Наиболее изученным препаратом в этой группе является мифепристон, применяемый для лечения миомы матки с 1993 г. Эффективность препарата в терапии миомы матки неоднократно доказана зарубежными и отечественными исследованиями. Метаанализ Q. Shen и соавт. 2013 г. [13], включающий 11 рандомизированных исследований, 780 пациенток с симптомной миомой матки, показывает, что мифепристон уменьшает объем миомы матки и купирует клинические симптомы, связанные с миомой. Авторы обзора полагают, что предоперационная терапия мифепристоном существенно снижает хирургические риски, а лечение миомы мифепристоном в пременопаузе часто позволяет избежать оперативного лечения. В России для лечения миомы зарегистрирован препарат мифепристона Гинестрил с дозировкой 50 мг для приема 1 раз в сутки, который и был нами использован.
Цель исследования: оценить эффективность лапароскопической миомэктомии для восстановления фертильности у пациенток с интерстициальной миомой матки, страдающих первичным или вторичным бесплодием; уточнить показания для проведения адъювантной терапии после миомэктомии; на основании результатов собственного исследования и доказательных научных данных выработать оптимальную тактику прегравидарной подготовки пациенток с миомой матки в зависимости от размера и типа миоматозных узлов.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное наблюдательное исследование включили 126 пациенток с первичным или вторичным бесплодием и миомой матки, находившихся на обследовании и оперативном лечении в клиниках МУЗ «ГКБ № 7» и МУЗ «ГКБ № 18» г. Казани с 2010 по 2014 г. Исследование проведено на базе кафедры акушерства и гинекологии № 2 Казанского государственного медицинского университета (заведующий кафедрой — И. Ф. Фаткуллин).
Возраст пациенток варьировал от 24 до 42 лет, в среднем составил 33,8 ± 4 года. Участниц последовательно стратифицировали в три группы, по 42 женщины в каждой, с использованием стратегии попарного отбора с уравниванием условий (возраст, количество миоматозных узлов). Пациенткам первой группы с 8-го дня после операции назначали препарат антигестагенового ряда мифепристон 50 мг ежедневно в течение 4 месяцев. Во второй группе применяли агонисты ГнРГ (аГнРГ) трипторелин или лейпрорелин по 3,75 мг в/м 1 раз в 28 дней в течение 6 месяцев с 8-го дня после операции. Контрольная группа была отобрана по принципу «копи-пара» из пациенток, имеющих противопоказания к адъювантной терапии или отказавшихся принимать гормональные препараты по тем или иным причинам.
Предоперационное обследование включало стандартные общеклинические анализы, определение гормонального профиля, диагностическую гистероскопию для исключения субмукозного роста миомы, гистологическое исследование эндометрия, трансвагинальную эхографию и доплеровское исследование на аппаратах экспертного класса.
Использованы следующие критерии включения в исследование: репродуктивный возраст, первичное или вторичное бесплодие, миома матки в виде интерстициальных миоматозных узлов (FIGO L3–L5, средний размер узла — 4,4 ± 1,5 см) без деформации полости матки, согласие на участие в протоколе исследования.
Всем пациенткам проведены лапароскопическая миомэктомия без проникновения в полость матки с послойным ушиванием ложа миоматозного узла, адгезиолизис, интраоперационная проверка проходимости маточных труб, все женщины прошли послеоперационную реабилитацию.
Для статистической обработки результатов использовали параметрические и непараметрические критерии; кумулятивную частоту рецидивов миомы матки анализировали по методу Каплана — Мейера с вычислением статистически значимой разницы при помощи логарифмического рангового критерия. Зависимость вероятности наступления беременности после миомэктомии от тех или иных факторов определяли методом множественной регрессии. Различия между значениями считали достоверными при р < 0,05.
РЕЗУЛЬТАТЫ
Срок наблюдения за пациентками составил от 2 до 6 лет, в среднем — 3,5 года. Все женщины планировали беременность после операции. Вопрос восстановления фертильности решался под наблюдением репродуктолога. Беременность наступила у 52 (41,3%) оперированных, в среднем через 14 ± 6 мес после миомэктомии. Из них 47 родоразрешены в срок путем операции кесарева сечения, 5 были беременны на момент написания статьи. Из оставшихся 74 пациенток 22 (17,5%) за время наблюдательного исследования вышли из репродуктивного возраста (старше 43 лет), оставшиеся 52 находятся на учете репродуктолога. Рецидивы зафиксировали по данным УЗИ у 48 (38,1%) больных. Факт рецидива миомы констатировали при появлении как минимум одного миоматозного узла более 1 см в диаметре. Средний интервал до появления первого рецидива составил 26 ± 6 мес в первой группе, 25 ± 6 мес во второй и 15 ± 3 мес в контрольной. Отмечено, что при одинаковой с аГнРГ эффективности для профилактики рецидивов мифепристон меньше влияет на гипофизарно-яичниковую систему и лучше переносится. В группах пациенток, применявших адъювантную терапию (мифепристон 50 мг или аГнРГ), частота рецидивов миомы в течение 6 лет после операции оказалась примерно в 1,7 раза меньше (30,7%, 33,3% и 55,2% соответственно).
Частота наступления беременности и появления рецидивов миомы матки после лапароскопической миомэктомии представлена на рисунке.
Рис. Частота наступления беременности и появления рецидивов миомы матки после лапароскопической миомэктомии
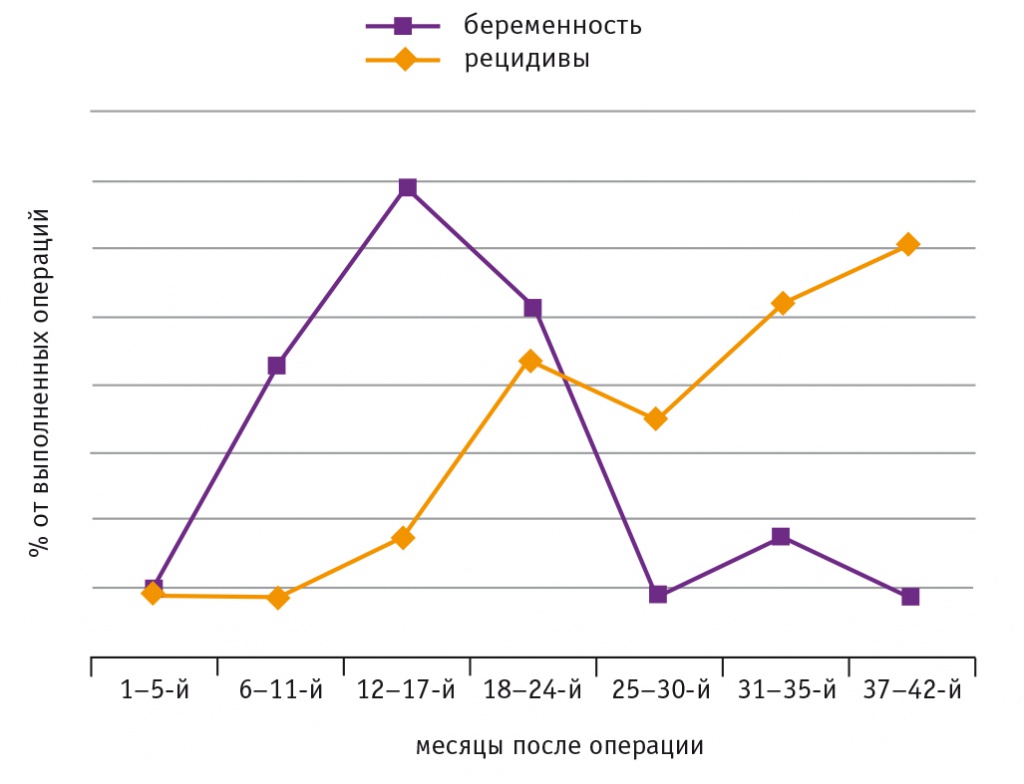
Большинство беременностей наступили в интервале от 6-го до 24-го мес после миомэктомии, максимальное количество — через 12–17 мес, в среднем — через 14 ± 6 мес. С увеличением времени, прошедшего после операции, число забеременевших резко снижается, тогда как количество пациенток с выявленным рецидивом миомы возрастает. В период 37–42 мес после миомэктомии у тех женщин, которые не реализовали репродуктивную функцию, вероятность обнаружения новых миоматозных узлов оказалась в 5 раз выше, чем наступления беременности.
С целью идентификации факторов, влияющих на вероятность наступления беременности после лапароскопической миомэктомии, проведен регрессионный анализ Кокса (табл.). Было изучено влияние на репродуктивную функцию адъювантной терапии после операции, количества удаленных миоматозных узлов, возраста пациентки, объема матки, наличия других возможных причин бесплодия, размера максимального узла, темпа роста миомы до операции, факта обнаружения рецидива миомы после миомэктомии, паритета до операции.
Таблица
Факторы, влияющие на наступление беременности после лапароскопической миомэктомии
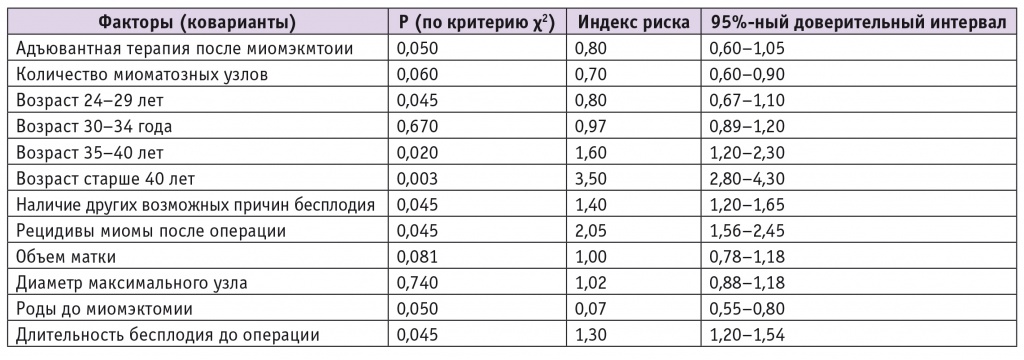
По данным проведенного расчета, вероятность наступления беременности после лапароскопической миомэктомии снижается в 3,5 раза при возрасте пациентки на момент операции старше 40 лет (p = 0,003; 95%-ный ДИ: 2,8–4,3), в 1,6 раза при возрасте 35–40 лет (p = 0,02; 95%-ный ДИ: 1,2–2,3). Появление новых миоматозных узлов уменьшает вероятность наступления беременности в 2,05 раза (p = 0,045; 95%-ный ДИ: 1,56–2,45), наличие других возможных причин бесплодия — в 1,4 раза (p = 0,045; 95%-ный ДИ: 1,20–1,65). Увеличивают возможность наступления беременности наличие родов в анамнезе до миомэктомии (p = 0,05), возраст младше 30 лет (p = 0,045). Количество удаленных миоматозных узлов, объем матки, диаметр максимального узла не оказывают значимого влияния на вероятность наступления беременности после операции. Методом регрессионного анализа изолированное влияние адъювантной терапии после миомэктомии на увеличение частоты наступления беременности в рамках данного исследования выявить не удалось. Тем не менее адъювантная терапия мифепристоном или аГнРГ отдаляет появление рецидивов, предоставляя пациенткам возможность реализовать репродуктивную функцию.
ОБСУЖДЕНИЕ
Репродуктивный прогноз после миомэктомии существенно ухудшается при возрасте женщины 35 лет и старше, при наличии других сопутствующих причин бесплодия, при длительности бесплодия до операции более 2 лет. В этих случаях польза выполнения миомэктомии для восстановления фертильности ограничена. Возникновение рецидива миомы матки после миомэктомии вдвое снижает вероятность наступления беременности, что свидетельствует о необходимости своевременной реализации репродуктивной функции после операции.
В нашем исследовании лапароскопическая миомэктомия привела к восстановлению фертильности у 41,3% пациенток с бесплодием и миомой, что согласуется с данными обзора лаборатории Кокрейн о том, что миомэктомия не всегда приводит к улучшению фертильности [7]. Большинство беременностей наступили в интервале 12–17 месяцев после миомэктомии, что подтверждает необходимость планировать беременность на возможно более ранний срок после операции с учетом состояния рубца на матке. Если пациентка хочет отложить реализацию репродуктивных планов, целесообразно применение адъювантной терапии для отсрочки возникновения послеоперационных рецидивов миомы. Кроме того, дополнительная медикаментозная терапия после хирургического вмешательства рекомендована при высоком риске рецидива заболевания — множественных миоматозных узлах, подозрении на наличие неудаленных при лапароскопической миомэктомии мелких миоматозных узлов. В качестве препарата выбора в адъювантной терапии можно рекомендовать антигестаген мифепристон 50 мг (Гинестрил) с учетом его щадящего влияния на гипофизарно-яичниковую систему и более быстрого восстановления менструальной функции.
ЗАКЛЮЧЕНИЕ
Удаление миоматозных узлов далеко не всегда способствует улучшению репродуктивной функции. В нашем проспективном наблюдательном исследовании лапароскопическая миомэктомия интерстициальных миоматозных узлов привела к восстановлению фертильности у 41,3% пациенток с бесплодием и миомой матки. Согласно полученным данным, репродуктивный прогноз после миомэктомии наиболее благоприятен для женщин в возрасте 24–34 года, в период 6–24 месяца после операции, но существенно ухудшается через 24 месяца после вмешательства, возможно, за счет увеличения частоты рецидивов, а также при возрасте пациентки 35 лет и старше и наличии сопутствующих причин бесплодия, длительности бесплодия до операции более 2 лет.
Наступление беременности необходимо планировать на возможно более ранний срок (6–24 месяца) после миомэктомии, индивидуально, с учетом состояния рубца на матке. При высоком риске рецидива миомы (множественные узлы), при необходимости отложить реализацию репродуктивных планов целесообразно применение адъювантной терапии.
Таким образом, с учетом накопленных научных данных [6, 9, 11, 12] можно констатировать, что тактика прегравидарной подготовки пациенток с миомой матки зависит от размеров и локализации миоматозных узлов: миомэктомия оправдана в случае миоматозных узлов, деформирующих полость матки, субсерозных и интрамуральных миоматозных узлов больших и средних размеров. Показания к миомэктомии интерстициального узла менее 4 см, не деформирующего полость матки, преимущества и риски этого вмешательства должны обсуждаться индивидуально с учетом возраста и наличия других причин бесплодия.








