ВВЕДЕНИЕ
Несмотря на бурное развитие и достижения в области репродуктивной медицины, такие как усовершенствование методов культивирования эмбрионов и предимплантационное генетическое тестирование, частота имплантации в циклах ЭКО остается неудовлетворительной [1, 2]. Справедливости ради следует констатировать тот факт, что многие бесплодные пары, обращающиеся в клиники репродуктивной медицины, к сожалению, сталкиваются с клинической ситуацией, ассоциированной с повторными неудачами имплантации (ПНИ) [2, 3].
ПНИ многими авторами определяется как ненаступление клинической беременности после переноса эмбрионов высокого качества по крайней мере в трех последовательных циклах ЭКО при отсутствии каких-либо органических факторов, снижающих ее шансы [4]. В клиническом протоколе «Вспомогательные репродуктивные технологии и искусственная инсеминация» Минздрава РФ 2019 года такую клиническую ситуацию называют «Повторные неудачные попытки переноса эмбрионов (имплантации)» и относят к ней случаи трех неудачных попыток селективного (еСЕТ или еДЕТ) переноса «свежих» или размороженных эмбрионов у женщин моложе 35 лет и двух — у женщин 35 лет и старше при отсутствии каких-либо факторов, снижающих шансы наступления беременности.
Молекулярные механизмы, лежащие в основе патогенеза ПНИ, остаются предметом дискуссий [4, 5]. Предложено несколько этиологических причин, но до недавнего времени основное внимание уделялось эмбриону и особенно эмбриональной анеуплоидии [6, 7]. Однако даже перенос эуплоидных эмбрионов не всегда приводит к успешной имплантации [8]. Это может говорить о том, что недостаточная рецептивность эндометрия является основным ограничивающим фактором для достижения беременности [5, 9, 10].
Под рецептивностью понимается состояние эндометрия во время окна имплантации — короткого периода менструального цикла в середине лютеиновой фазы, когда эндометрий приобретает адгезивные свойства, способствующие синхронной имплантации эмбриона [1, 11]. В некоторых исследованиях сообщалось, что нарушение рецептивности эндометрия становится причиной примерно двух третей неудач имплантации [1, 5, 9].
Перекрестные связи между эмбрионом и эндометрием опосредуются многими биологически активными веществами, включая цитокины, молекулы адгезии, факторы роста и гормоны [1, 5, 11]. Большинство этих молекул вовлечены в иммунологический процесс, который играет ключевую роль в принятии полуаллогенного эмбриона материнским эндометрием и создании подходящей среды во время имплантации [1, 12].
Среди всех элементов, влияющих на неудачу имплантации эмбрионов высокого качества, иммунная система описывалась исследованиями и как ключевая, и как наиболее контраверсионная [1, 7]. В большинстве существующих исследований изучался только один или несколько маркеров, что имеет ограниченное значение, особенно при таком сложном процессе, как имплантация [13, 14]. В последние годы выдвинуто предположение, что основной причиной ПНИ является иммунный дисбаланс, а репродуктивная иммунология играет ведущую роль в ПНИ, однако до сих пор механизмы этих изменений остаются плохо изученными [7, 8]. Таким образом, исследование местного иммунитета эндометрия может помочь женщинам с необъяснимыми ПНИ в циклах ЭКО [3].
В связи с изложенным вопросы, касающиеся изучения ультратонких механизмов патогенеза имплантационной несостоятельности при ПНИ в рамках повышения эффективности программ ЭКО, представляют значительный интерес для практического здравоохранения и для женщин, планирующих использование ВРТ. Это и определило выбор цели и задач настоящего исследования.
Цель исследования: расширить представления об иммунологических аспектах патогенеза имплантационной несостоятельности эндометрия у пациенток с ПНИ в программах ЭКО.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное открытое сравнительное исследование включены 57 женщин (основная группа) в возрасте от 27 до 42 лет (средний возраст составил 36 ± 6,2 года) с клинически верифицированными ПНИ, согласно клиническому протоколу «Вспомогательные репродуктивные технологии и искусственная инсеминация». Группу морфологического контроля составили 30 фертильных женщин, имевших в анамнезе 2 и более родов доношенными здоровыми детьми и не имевших нарушений фертильности, давших добровольное информированное согласие на участие в исследовании.
Материалом исследования являлись биоптаты эндометрия, полученные путем пайпель-биопсии на 8–10-й день менструального цикла (в среднюю стадию фазы пролиферации) для объективной патоморфологической верификации состояния эндометрия. Полученные биоптаты после фиксации в 10%-ном забуференном формалине и гистологической обработки в автоматическом гистопроцессоре Leica ASP 30 (Германия) заливали в парафин на станции Leica EG 1150 (Германия). Производилась окраска срезов толщиной 4 микрометра гематоксилином и эозином при помощи станции Leica ST5010 (Германия).
Обзорное микроскопическое исследование материала проводилось посредством микроскопа Leica DMLB с использованием цифровой камеры Leica DFC420 (Германия). В полученных микропрепаратах осуществлялась патоморфологическая оценка состояния эндометрия.
Иммуногистохимическое исследование эндометрия с антителами с целью изучения местного иммунитета проводили с антителами к CD4+ (Т-лимфоциты) — клон SP35 Ventana, CD8+ (Т-лимфоциты) — клон SP57 Ventana, CD20+ (зрелые В-лимфоциты) — клон L26 фирмы DAKO, CD56+ NK — клон CD56+ 4 Leica Bond, CD138+ на плазматические клетки — клон MI15 DAKO. Иммуногистохимическое окрашивание производилось в иммуностейнере Ventana BenchMark Ultra IHdSH (США), Bond-maX (Германия). Для иммуноокрашивания использовали систему визуализации Ultra Vision TL-015-HD Lab Vision.
Экспрессию иммуногистохимических маркеров изучали в трех неперекрывающихся полях зрения при 400-кратном увеличении с помощью микроскопа Leica DMLB и цифровой камеры Leica DFC420 (Германия).
Для определения нормальности распределения параметров был применен критерий Колмогорова — Смирнова. Результаты иммуногистохимического исследования представлены в виде суммы DAB-позитивных клеток в полях зрения при 400-кратном увеличении. Все данные отображены в виде медианного значения — Me (25%; 75%).
Статистическое сравнение групп осуществлялось при помощи непараметрических методов. Для выявления статистической значимости результатов использовался критерий Манна — Уитни. В случае оценки качественных признаков применен двусторонний критерий Фишера. Результаты считались статистически значимыми при р < 0,05.
Обработку данных проводили с использованием пакета программ электронных таблиц Microsoft Excel и программы IBM SPSS Statistics 26.
РЕЗУЛЬТАТЫ
Эндометрий в средней стадии фазы пролиферации у пациенток с ПНИ продемонстрировал изменения экспрессии исследуемых иммунологических маркеров в сравнении с показателями группы морфологического контроля (табл.).
Таблица
Результаты иммуногистохимического исследования биоптатов эндометрия пациенток с повторными неудачами имплантации и фертильных женщин, Me (25%; 75%)
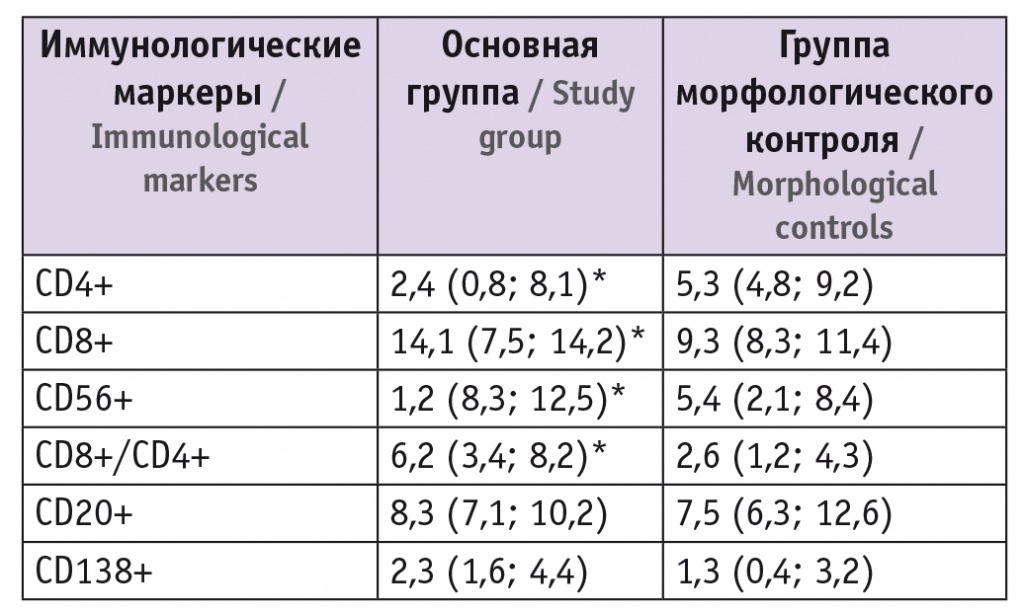
* Отличия от группы морфологического контроля статистически значимы (р < 0,05).
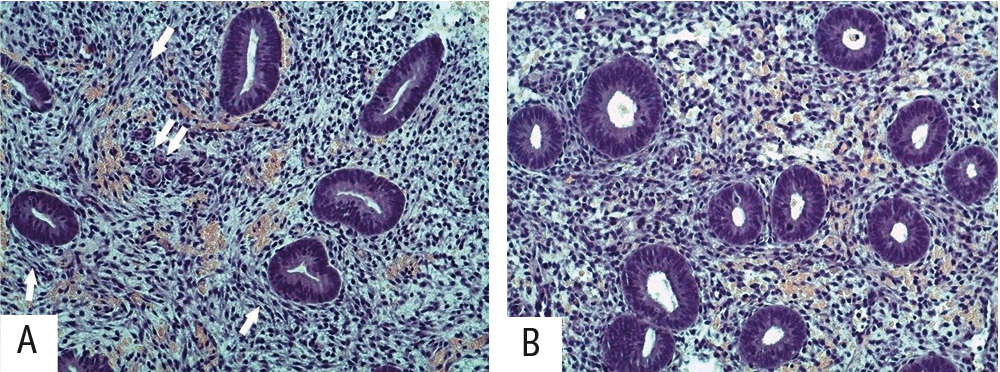
При патоморфологическом исследовании гистологических препаратов эндометрия, окрашенных гематоксилином и эозином, у пациенток основной группы маточные железы морфологически соответствовали средней стадии фазы пролиферации, в части образцов определялись невыраженные фокусы уплотнения стромы эндометрия за счет неких «завихрений», преимущественно вокруг маточных желез, и мелкие очаги воспалительной инфильтрации, а также умеренное утолщение стенки кровеносных сосудов, что может соответствовать слабо выраженному хроническому эндометриту (рис. 1).
Рис. 1. А — основная группа, бесплодие 1, повторные неудачи имплантации: эндометрий соответствует средней стадии фазы пролиферации, в строме и вокруг маточных желез определяются мелкие фокусы фиброза в виде «завихрений» (стрелки), утолщение стенок мелких артериальных сосудов (двойная стрелка). В — группа морфологического контроля: эндометрий соответствует средней стадии фазы пролиферации. Окраска гематоксилином и эозином, 200-кратное увеличение. Здесь и далее иллюстрации Мидибера К.Ю.
Для уточнения клеточного состава воспаления и состояния местного иммунитета у пациенток основной группы нами проведено иммуногистохимическое исследование.
В настоящем исследовании при иммуногистохимическом анализе биоптатов эндометрия в средней стадии фазы пролиферации у пациенток, страдающих ПНИ, отмечено статистически значимое увеличение числа экспрессированных CD56+ клеток (в почти в 2 раза) по сравнению с таковым у здоровых женщин (рис. 2 А, В).
Рис. 2. Иммуногистохимическое исследование пациенток с повторными неудачами имплантации (ПНИ) и участниц группы морфологического контроля (400-кратное увеличение). А — основная группа, бесплодие 1, ПНИ: положительная экспрессия CD56+, 34 клетки в поле зрения. В — группа морфологического контроля: положительная экспрессия CD56+; 7 клеток в поле зрения. С — основная группа, бесплодие 1, ПНИ: положительная экспрессия CD4+; 9 клеток в поле зрения. D — группа морфологического контроля: положительная экспрессия CD4+; 38 клеток в поле зрения. E — основная группа, бесплодие 1, ПНИ: положительная экспрессия CD8+; 23 клетки в поле зрения. F — группа морфологического контроля: положительная экспрессия CD8+; 27 клеток в поле зрения
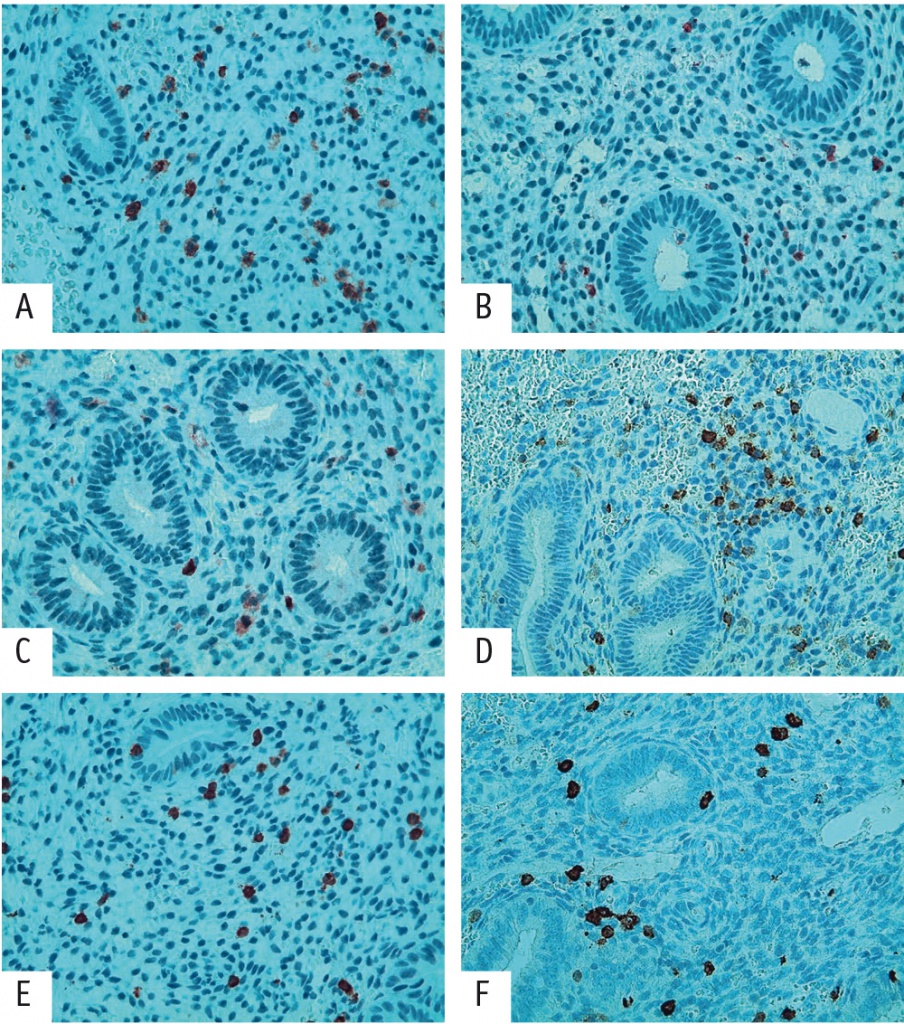
В дополнение к этому наблюдались статистически значимые уменьшение экспрессии клеток CD4+ (в 2,2 раза) (рис. 2 C, D) и повышение экспрессии CD8+ (в 1,5 раза) по сравнению с таковыми в группе морфологического контроля (рис. 2 E, F), что сопровождалось дисбалансом между CD4+ и CD8+ в сторону превалирования последних (см. табл.).
Выявлено также незначительное (в 1,1 раза) увеличение числа экспрессированных CD20+ клеток у пациенток с ПНИ (рис. 3 А, В).
Рис. 3. Иммуногистохимическое исследование пациенток с повторными неудачами имплантации (ПНИ) и участниц группы морфологического контроля (400-кратное увеличение). А — основная группа, бесплодие 1, ПНИ: положительная экспрессия CD20+; 6 клеток в поле зрения. В — группа морфологического контроля: положительная экспрессия CD20+; 2 клетки в поле зрения. С — основная группа, бесплодие 1, ПНИ: положительная экспрессия CD138+; 2 клетки в поле зрения. D — группа морфологического контроля: негативная экспрессия CD138+; 0 клеток в поле зрения
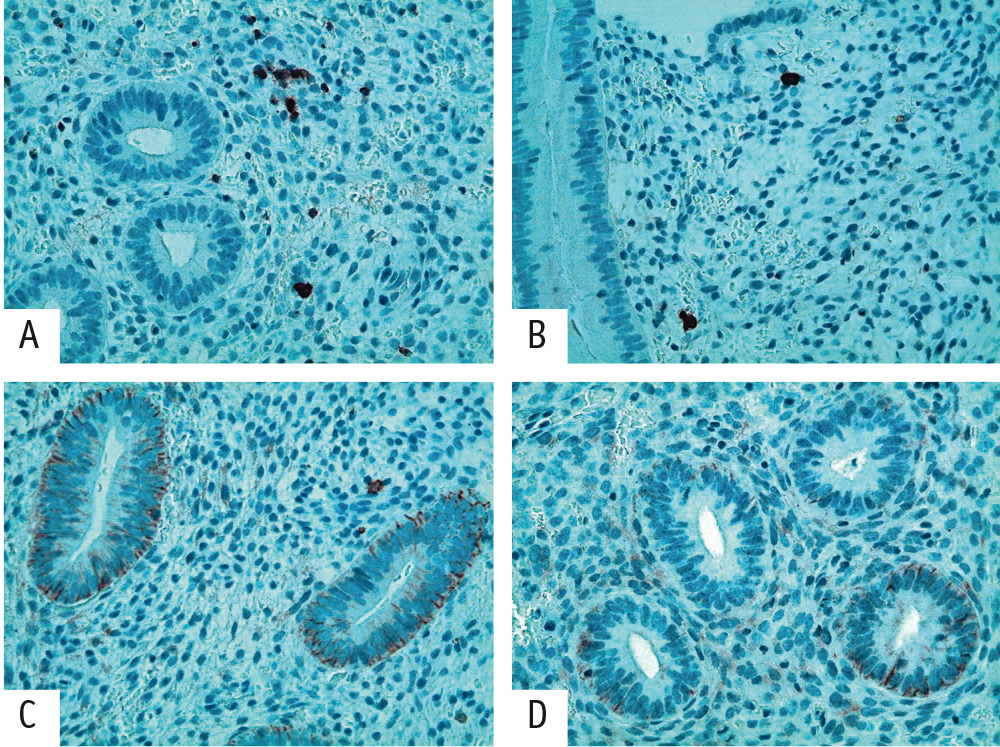
При иммуногистохимической реакции с антителом к CD138+ в 11% клинических наблюдений с ПНИ выявлены 1–2 плазматические клетки в строме (рис. 3 C, D), подтверждавшие наличие у этих пациенток слабо выраженного хронического эндометрита. У здоровых женщин они отсутствовали.
Полученные результаты комплексного патоморфологического исследования продемонстрировали дисбаланс в местном иммунитете эндометрия у пациенток с ПНИ между клетками CD4+ и CD8+ в пользу последних Т-лимфоцитов, у здоровых женщин, напротив, было больше CD4+.
Наряду с дисбалансом между Т-лимфоцитами нами выявлено увеличение числа маркеров зрелых В-лимфоцитов CD20+ в эндометрии пациенток с ПНИ по сравнению с показателем группы морфологического контроля.
Одновременно обнаружено статистически значимое повышение числа CD56+ клеток, относящихся к натуральным киллерам.
Результаты иммуногистохимического исследования сочетаются с патоморфологическими находками, свидетельствующими о наличии слабо выраженного хронического эндометрита у 11% пациенток с ПНИ. Полученные морфологические данные тесно связаны с иммунобиологией имплантации.
ОБСУЖДЕНИЕ
Эндометриальные гранулоциты (большие гранулярные лимфоциты) относятся к особой популяции NK-клеток. По сравнению с типичными естественными киллерами эндометриальные гранулоциты отличаются высокой экспрессией CD56 (адгезивной молекулы, участвующей в реакции цитотоксичности) при отсутствии других маркеров NK-клеток, а именно CD16 и CD57.
Популяция лейкоцитов эндометрия состоит в основном из маточных естественных клеток-киллеров (uNK), макрофагов и Т-клеток и заметно отличается от таковой в периферической крови [15]. Количество клеток CD56+ изменяется в течение менструального цикла с резким увеличением в середине секреторной фазы, начинающейся через 6–7 дней после сильного повышения уровня ЛГ, что является началом предполагаемого времени имплантации [16].
Приблизительно 10% NK-клеток стромы эндометрия являются CD56+ и CD16+, которые похожи, но не идентичны периферическим NK-клеткам, в то время как 90% популяции имеют различные фенотипы CD56 и CD16 [16, 17]. Субпопуляции маточных NK-клеток можно подразделить на два класса, которые отличаются маркерами, а также функциональными свойствами: цитотоксический класс CD56–CD16+ и проангиогенный класс CD56+CD16– [15, 18-20].
Данные, полученные в нашем исследовании, продемонстрировали статистически значимый рост числа CD56+ клеток, что свидетельствует о повышении плотности цитотоксической субпопуляции NK-клеток, а также позволяет косвенно предположить снижение плотности проангиогенной субпопуляции в строме эндометрия пациенток с ПНИ.
На сегодняшний день выделено множество Т-лимфоцитарных субпопуляций лейкоцитов, имеющих различную экспрессию антигенов и функциональную активность. Особенный интерес с позиции имплантационного потенциала представляют Foxp3+ T-регуляторные клетки, которые являются уникальными представителями супрессивных CD4+ T-хелперов, участвующих в реализации иммунной толерантности к собственным и чужеродным антигенам у людей и мышей [21-24]. Показано, что во время имплантации и беременности возрастает количество Treg-клеток в периферической крови как у людей [[25, 26], так и у мышей [27], а дальнейшие исследования выявили, что стимуляция плода аллоантигенами является основной движущей силой в увеличении числа Treg-клеток [28, 29].
Повышение уровней T-регуляторных клеток в день переноса эмбрионов было связано с более высокой частотой имплантации [30]. Данные, полученные в нашем исследовании, продемонстрировали относительное статистически значимое уменьшение экспрессии клеток CD4+ в строме пациенток с ПНИ, что позволяет предположить снижение иммуносупрессивной активности Т-регуляторных клеток в эндометрии. Повышенная экспрессия CD8+ предполагает увеличение концентраций цитотоксических Т-лимфоцитов, что является следствием недостаточной супрессивной активности регуляторных Т-хелперов в строме эндометрия пациенток с ПНИ.
В-лимфоциты (СD20+) в неизменном эндометрии единичны (обычно 1–3 клетки), в случаях развития хронического воспаления в эндометрии в зависимости от степени выраженности воспалительного процесса число CD20+ клеток может возрастать. В нашем исследовании у пациенток с ПНИ и наличием слабо выраженного хронического эндометрита число CD20+ клеток увеличивалось до 6. Одновременно в эндометрии у этих пациенток (около 11%) диагностированы единичные CD138+ (1–2 плазматические клетки), что позволят предположить, что хроническая инфекция в эндометрии не является ведущей причиной наблюдаемых изменений в экспрессии иммунных клеток.
ЗАКЛЮЧЕНИЕ
В основе патогенеза имплантационной несостоятельности у пациенток с повторными неудачами имплантации (ПНИ) лежит иммунологический дисбаланс в строме эндометрия, субстратом которого являются недостаточные концентрации проангиогенных NK-клеток, регуляторных супрессивных Т-хелперов, а также повышение плотности цитотоксического класса NK- и Т-клеток, что формирует два ключевых звена патогенеза — снижение иммунологической толерантности в полуаллогенной бластоцисте и нарушения процессов нормального ангиогенеза в строме эндометрия женщин с ПНИ.
С целью проверки этой гипотезы и определения клинической значимости иммуногистохимической оценки маркеров CD4, CD8, CD20 и CD56 для улучшения показателей имплантационной состоятельности и наступления беременности необходимо провести дальнейший анализ с бо́льшим размером выборки; однако мы можем предположить, что они могут служить высокоинформативными прогностическими маркерами ПНИ.
Поступила: 12.10.2021
Принята к публикации: 30.11.2021








